Artículo original
Biotecnología Vegetal Vol. 18, No. 2: 111 - 116, abril - junio, 2018
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Comparación de tres explantes para la regeneración vía organogénesis indirecta de Phaseolus vulgaris L.
Comparison of three explants for Phaseolus vulgaris L. the regeneration via indirect organogenesis
Dianella Iglesias1,2, Raúl Collado1, Lyselle Ruiz de León2, Damaris Torres1, Novisel Veitía1, Amanda Martirena-Ramírez1, Lourdes R. García1, Leonardo Rivero1
1Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54 830. Cuba. e-mail: raulc@ibp.co.cu
2Departamento de Biología, Facultad de Ciencias Agropecuarias, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54 830.
RESUMEN
El eje embrionario y los callos nodulares verdes han sido los explantes más utilizados para la transformación genética vía Agrobacterium tumefaciens de frijol común (Phaseolus vulgaris L.). Sin embargo, la obtención de plantas transgénicas a partir de estos explantes es ineficiente. Por ello, se requiere el estudio de otros explantes blanco. El objetivo de este trabajo fue comparar la respuesta en la regeneración de los explantes ½ NC-1, NC-1 y NC-2 en los cultivares 'ICA Pijao' y 'BAT 93'. Se cuantificó el número de explantes que formaron callos y se calculó el porcentaje de formación de callos por explante. Se le midió la longitud de los brotes, se cuantificó el número de brotes con formación de raíces, así como la longitud promedio de los brotes enraizados. Se obtuvieron valores similares entre los porcentajes de formación de callos para cada cultivar de forma independiente, así como en el porcentaje de callos que formaron brotes y el número promedio de brotes por callo. El tipo de explante empleado no influyó en el crecimiento de los brotes regenerados, en el porcentaje de brotes con raíces, así como en la longitud promedio de los brotes enraizados. El explante ½ NC-1 puede ser utilizado para la regeneración de plantas vía organogénesis indirecta en P. vulgaris cultivares 'ICA Pijao' y 'BAT 93'.
Palabras clave: brotes, callos, frijol común, raíces
ABSTRACT
The embryonic axis and green nodular calli were the most used explants for genetic transformation via Agrobacterium tumefaciens of common bean (Phaseolus vulgaris L). However, obtaining transgenic plants from these explants is inefficient. Therefore, the study of other target explants is required. The objective of this work was to compare the explants NC-1 and NC-2 explants with ½ NC-1 in the regeneration via indirect organogenesis of P. vulgaris cv. 'ICA Pijao' and 'BAT 93'. The number of explants that formed calli was evaluated and the percentage of calli formation per explant was determined. The length of shoots was measured, the number of shoots with root formation was quantified, as well as the average length of the rooted shoots. Similar values were obtained for the percentages of callus formation for each cultivar independently, as well as the percentage of calli that formed shoots and the average number of shoots per callus. The type of explant did not influence the growth of the regenerated shoots, the percentage of shoots with roots, as well as the average length of these rooted shoots. The ½ NC-1 explant can be used for plant regeneration via indirect organogenesis in P. vulgaris cv. 'ICA Pijao' and 'BAT 93'.
Keywords: shoots, calli, common bean, roots
INTRODUCCIÓN
Phaseolus vulgaris L. es una leguminosa estudiada en todo el mundo por su importancia económica, la cual se debe fundamentalmente a su aporte proteico a la dieta humana (Morales-Santos et al., 2017). Este cultivo es afectado por la incidencia de factores bióticos y abióticos que disminuyen su producción (Pandey et al., 2017).
La mejora genética constituye una alternativa para enfrentar los efectos de estos factores ambientales. En este sentido, el desarrollo de técnicas como la transformación genética resultan importantes para la obtención de plantas resistentes o tolerantes a estas condiciones de estrés (Eissa, 2013). Sin embargo, su empleo está condicionado al desarrollo de protocolos que proporcionen una diferenciación celular adecuada, el desarrollo de brotes, y la regeneración de la planta completa (Espinosa-Huerta et al., 2013).
En P. vulgaris, los protocolos establecidos para la regeneración de plantas in vitro se basan fundamentalmente en la organogénesis directa o el desarrollo de brotes a partir de varios tipos de explantes como meristemos de brotes apicales y nudos cotiledonares (Thảo et al., 2013). El origen multicelular de las plantas regeneradas a partir de la organogénesis directa en esta especie, durante la transformación genética, ha dado lugar a la producción de escapes y quimeras, por lo que ha obstaculizado la obtención de plantas (Mukeshimana et al., 2013; Collado et al., 2016).
Resultados obtenidos por Collado et al. (2016) indicaron que la transformación genética vía Agrobacterium tumefaciens mediante regeneración indirecta es una estrategia prometedora en P. vulgaris. Sin embargo, para validar completamente este enfoque como eficiente y reproducible, se requiere de esfuerzo adicional relacionado con la disminución del tiempo para obtener plantas transgénicas y la optimización de la selección de tejido transformado. Para ello, un factor a tener en cuenta es el tipo de explante blanco. En este sentido, investigaciones preliminares han revelado que una delgada capa de epidermis del eje embrionario unida a un cotiledón es capaz de desarrollar un callo nodular verde. Ello podría dar la posibilidad de experimentar con otro explante blanco utilizando el sistema de regeneración vía organogénesis indirecta propuesto por Collado et al. (2013). El nuevo explante denominado ½ NC-1 al poseer una capa muy fina de tejido regenerable podría ser un explante blanco más vulnerable para la infección por A. tumefaciens en comparación con los explantes NC-1 y NC-2 que tienen unido al cotiledón una sección de eje embrionario. Además, el uso de ½ NC-1 podría permitir una selección más estricta de las células transformadas y contribuir a reducir algunos pasos en el protocolo de transformación propuesto por Collado et al. (2016). Sin embargo, no se conoce la respuesta en la regeneración a partir de ½ NC-1. Por ello, el objetivo de este trabajo fue comparar la respuesta en la regeneración de los explantes ½ NC-1, NC-1 y NC-2 en los cultivares 'ICA Pijao' y 'BAT 93'.
MATERIALES Y MÉTODOS
Material vegetal
Semillas maduras de P. vulgaris cv. 'ICA Pijao' y 'BAT 93', provenientes del banco de germoplasma del Centro de Investigaciones Agropecuarias (CIAP), de la Universidad Central Marta Abreu de Las Villas.
Preparación de los explantes NC-1, NC-2 y ½ NC-1
Las semillas se lavaron con una solución de detergente y agua común durante 10 min. Luego se enjuagaron con agua común y se desinfectaron en etanol al 70% por 20 s y se transfirieron a una solución de hipoclorito de sodio (NaOCl) al 3% (v/v) durante 10 min. Posteriormente, fueron enjuagadas tres veces con agua desionizada estéril, con lo cual se eliminaron los residuos del desinfectante y se colocaron en medio de cultivo de germinación (MG, Tabla 1). El material vegetal se mantuvo a 27 ± 2 °C en oscuridad total durante tres días para la germinación.
Para la preparación de los explantes iniciales, posterior a la germinación se eliminó la testa y la raíz. En el cultivar 'ICA Pijao' para la obtención del explante NC-1 se separó un cotiledón con el nudo cotiledonal. En el cultivar 'BAT 93' se tomaron los dos cotiledones con el nudo cotiledonal (NC-2). Para la disección de ½ NC-1 a partir de los dos cultivares, se realizó una herida en la unión del cotiledón con el eje embrionario y se separó el cotiledón con una fina lámina de la epidermis del eje embrionario. El explante ½ NC-1 se comparó con el explante NC-1 en el caso del cultivar 'ICA Pijao' y con el explante NC-2 en el cultivar 'BAT 93', con el objetivo de determinar si este pudiera ser utilizado para la regeneración de plantas.
Formación de callos a partir de los explantes NC-1, NC-2 y ½ NC-1
Los explantes NC-1, NC-2 y ½ NC-1 se transfirieron a un medio de cultivo de formación de callos (MFC, Tabla 1) y se mantuvieron en cámaras de cultivo a 27 ± 2 °C, durante los primeros siete días en oscuridad. Luego, se eliminaron los brotes, se transfirieron nuevamente a MFC y se colocaron en una cámara de crecimiento con un fotoperíodo de 16 h luz/ 8 h oscuridad y una intensidad luminosa de 45 µmol m-2 s-1. A los 21 días de cultivo se cuantificó el número de explantes que formaron callos y se calculó el porcentaje de formación de callos.
Regeneración, elongación y enraizamiento de los brotes
Los callos nodulares verdes provenientes de los explantes NC-1, NC-2 y ½ NC-1, se separaron del explante inicial sin ser fraccionados y fueron colocados en un medio de cultivo para la regeneración de brotes (MRB, Tabla 1). El material vegetal se mantuvo en cámara de cultivo en las condiciones de fotoperíodo, temperatura e intensidad luminosa descritas para la formación de callos, por 21 días. Los brotes obtenidos fueron transferidos a un medio de cultivo de elongación y enraizamiento (MEER, Tabla 1) y se mantuvieron en las mismas condiciones de cultivo, por 30 días con subcultivos cada 15 días.
Se evaluó la capacidad de crecimiento de los brotes regenerados a partir de los explantes NC-1, NC-2 y ½ NC-1. Para ello, a los brotes obtenidos se les midió su longitud (cm) con una regla graduada para comparar la regeneración de los diferentes explantes. Se cuantificó el número de brotes con formación de raíces y se determinó la longitud promedio (cm) de los brotes enraizados.

Procesamiento estadístico
Los datos fueron analizados con el paquete estadístico PASW Statistics, versión 23, para Windows, se verificaron los supuestos de normalidad mediante la prueba Shapiro Wilk. Los datos que no seguían distribución normal se procesaron mediante análisis de varianza para dos variables no relacionadas mediante la prueba U de Mann Whitney y para varias muestras independientes, a través de la prueba H de Kruskal Wallis. En todos los casos las diferencias se consideraron significativas para un valor de p<0.05.
RESULTADOS Y DISCUSIÓN
Formación de callos a partir de los explantes NC-1, NC-2 y ½ NC-1
En P. vulgaris cv. 'ICA Pijao' y cv. 'BAT 93', los explantes NC-1, NC-2 y ½ NC-1 formaron callos nodulares verdes satisfactoriamente (Tabla 2). Se obtuvieron valores similares entre los porcentajes de formación de callos para cada cultivar de forma independiente sin diferencias significativas entre ellos.
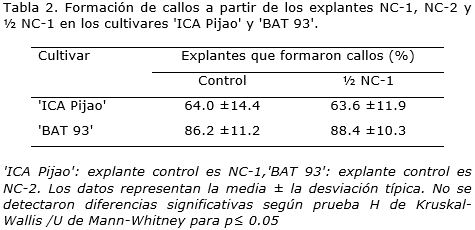
La comparación entre los explantes NC-1, NC-2 y ½ NC-1 no presentó diferencias significativas para la formación de callos morfogenéticos. Este resultado confirma que la región donde se inserta el cotiledón al eje embrionario tiene un alto potencial de regeneración (Collado et al., 2013). Esta respuesta similar de los tipos de explantes en la formación de callo pudo estar originada porque los tres están unidos al cotiledón. La presencia de uno o dos cotiledones en explantes de P. vulgaris ha tenido un efecto favorable en la formación de callos nodulares verdes (Collado et al., 2013).
Regeneración, elongación y enraizamiento de los brotes
Los callos provenientes de los explantes NC-1, NC-2 y ½ NC-1 presentaron valores similares en el porcentaje de callos que formaron brotes, el número promedio de brotes por callo, la longitud de los brotes formados, el porcentaje de brotes con raíces y la longitud promedio de los brotes con raíces para cada cultivar de forma independiente (Tabla 3, Tabla 4). No se encontraron diferencias significativas entre estos valores.


En este estudio se demostró que el empleo del explante ½ NC-1 para la regeneración de P. vulgaris en los cultivares 'BAT 93' e 'ICA Pijao' no afectó la eficiencia del protocolo establecido para los explantes NC-1 y NC-2. Esto pudo deberse a que en ambos explantes existen zonas o regiones que presentan células meristemáticas con capacidad para la regeneración (Mukeshimana et al., 2013).
Además, el tipo de explante empleado no influyó en el crecimiento de los brotes regenerados. Los brotes obtenidos a partir de callos originados del explante ½ NC-1 mostraron una longitud similar a los que se formaron a partir de callos derivados de NC-1 y NC-2.
Es de destacar que la longitud de los brotes regenerados a partir de callos en este trabajo, más que por el tipo de explante, estuvo determinada por el cultivar. Los brotes de 'ICA Pijao' presentaron una longitud dos veces mayor que aquellos regenerados en 'BAT 93'. Aspecto este que confirma la condición cultivar dependiente para el cultivo de tejidos de esta especie.
En el enraizamiento de los brotes formados a partir de los callos obtenidos de los explantes NC-1, NC-2 y ½ NC-1, tampoco influyó el tipo de explante. Dentro de un mismo cultivar, independientemente del tipo de explante, se observaron valores similares en el porcentaje de brotes con raíces, así como en la longitud promedio de estos brotes enraizados.
Similar a lo ocurrido con la longitud de los brotes regenerados, el porcentaje de brotes con raíces y la longitud promedio de los brotes enraizados, estuvieron más influenciados por el cultivar que por el tipo de explante. El cultivar 'ICA Pijao' tuvo mayor respuesta en el enraizamiento de brotes que 'BAT 93'. En otras investigaciones, sobre la regeneración de plantas de P. vulgaris a partir de nudos cotiledonales, Ahmed et al. (2002) destacaron, que solo los brotes con 2 cm o más de longitud formaron raíces. En el cultivar 'BAT 93' independientemente del tipo de explante empleado, la longitud de los brotes regenerados fue inferior a los 2 cm, y esta pudo ser la causa que generó bajo porcentaje de enraizamiento.
CONCLUSIONES
El cotiledón con una fina lámina de la epidermis del eje embrionario (½ NC-1) puede ser utilizado como explante para la regeneración vía organogénesis indirecta en Phaseolus vulgaris L., cultivares ‘ICA Pijao’ y ‘BAT 93’.
REFERENCIAS
Ahmed EE, Bisztray G, Velich I (2002) Plant regeneration from seedling explants of common bean (Phaseolus vulgaris L.). Acta Biologica Szegediensis 46(3-4): 27-28
Collado R, García L, Bermúdez-Caraballoso I, Veitía N, Torres D, Romero C, Martirena-Ramírez A, Ocaña B, Rojas LE, Angenon G (2016) Phaseolus vulgaris L. regeneration systems and their application for Agrobacterium-mediated genetic transformation. Biotecnología Aplicada 33(2): 2521-2523
Collado R, Veitía N, Bermúdez-Caraballoso I, García L, Torres D, Romero C, Lorenzo J, Angenon G (2013) Efficient in vitro plant regeneration via indirect organogenesis for different common bean cultivars. Scientia Horticulturae 153: 109-116; doi:10.1016/j.scienta.2013.02.007
Eissa EA (2013) Genetic transformation and regeneration of common bean (Phaseolus vulgaris L.) using Agrobacterium system. Egyptian Journal of Genetics and Cytology 42(1): 127-150
Espinosa-Huerta E, Quintero-Jiménez A, Cabrera-Becerra KV, Mora-Avilés MA (2013) Stable and efficient Agrobacterium tumefaciens mediated transformation of Phaseolus vulgaris. Agrociencia 47(4): 319-333
Morales-Santos ME, Peña-Valdivia CB, García-Esteva A, Aguilar-Benítez G, Kohashi-Shibata J (2017) Características físicas y de germinación en semillas y plántulas de frijol (Phaseolus vulgaris L.) silvestre, domesticado y su progenie. Agrociencia 51(1): 43-62
Mukeshimana G, Ma Y, Walworth AE, Song G, Kelly JD (2013) Factors influencing regeneration and Agrobacterium tumefaciens mediated transformation of common bean (Phaseolus vulgaris L.). Plant Biotechnology Reports 7(1): 59-70; doi:10.1007/s11816-012-0237-0
Pandey P, Irulappan V, Bagavathiannan MV, Senthil-Kumar M (2017) Impact of combined abiotic and biotic stresses on plant growth and avenues for crop improvement by exploiting physio-morphological traits. Frontiers in plant science 8: 537; doi:10.3389/fpls.2017.00537
Thảo NT, Thảo NTP, Hassan F, Jacobsen HJ (2013) In vitro propagation of common bean (Phaseolus vulgaris L.). Journal of Science and Development 11(6): 868-876
Recibido:16-02-2018
Aceptado:04-04-2018
Copyright (c) 2018 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
