Artículo original
Biotecnología Vegetal Vol. 18, No. 2: 125 - XXX, abril - junio, 2018
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 215
Efecto de la altura de las plantas de Coffea arabica cv. Caturra rojo J-884 obtenidas por embriogénesis somática en la adaptación ex vitro
Effect of the height of Coffea arabica cv. Caturra rojo J-884 plants obtained by somatic embryogenesis in the ex vitro adaptation
Raúl Barbón1, Nosleiby Ortiz2, Alina Capote1, Anabel Pérez1
1Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54 830. e-mail: raulb@ibp.co.cu
2Estación Experimental Agro-forestal de Jibacoa. Rincón Naranjo, Jibacoa. Manicaragua. Villa Clara. Cuba. CP 54 590.
RESUMEN
La propagación asexual mediante la embriogénesis somática se ha desarrollado en diferentes cultivares de cafeto (Coffea arabica L. y Coffea canephora Pierre ex Froehner). Esta investigación se realizó con el objetivo de determinar la influencia de la altura de las plantas de cafeto (Coffea arabica L.) cv. Caturra rojo J-884 obtenidas por embriogénesis somática en su adaptación ex vitro en vivero. Se conformaron tres tratamientos de acuerdo con la altura de las plantas: 1.5-2.0 cm, 2.1-3.0 cm y 3.1 - 4.0 cm. Las plantas fueron adaptadas en vivero en la zona del macizo de Guamuhaya. Se evaluaron las variables supervivencia, altura, área foliar, diámetro del tallo, número de pares de hojas, contenido de clorofila totales (SPAD), masa fresca, masa seca e índices fisiológicos (tasa asimilación neta, tasa de crecimiento absoluto, tasa de crecimiento relativo, índice de área foliar y razón de área foliar). Las plantas procedentes de embriogénesis somática con una altura inicial de 2.1- 3.0 cm y 3.1 - 4.0 cm presentaron las mejores características morfológicas y fisiológicas relacionadas con el crecimiento y desarrollo. Las plantas que inicialmente tenían una mayor altura presentaron los mayores valores de crecimiento relativo y absoluto con diferencias significativas con respecto a las plantas con una menor altura inicial (1.5 -2.0 cm y 2.1- 3.0 cm). Se comprobó que la altura inicial de la planta de cafeto cv. Caturra rojo J-884 obtenida por embriogénesis somática influye en la respuesta morfológica y fisiológica de esta en la adaptación ex vitro.
Palabras clave: adaptación ex vitro, café, embrión somático, índices fisiológicos, morfofisiología
ABSTRACT
The asexual propagation through somatic embryogenesis has been developed in different coffee cultivars (Coffea arabica L. and Coffea canephora Pierre ex Froehner). This investigation was carried out with the objective of determining the influence of the height of coffee plants (Coffea arabica L.) cv. Caturra red J-884 obtained by somatic embryogenesis in its adaptation in the nursery. Three treatments were formed according to the height of the plants: 1.5-2.0 cm, 2.1-3.0 cm and 3.1 - 4.0 cm. The plants were adapted in the nursery in the area of the Guamuhaya massif. The following variables were evaluated: survival, height, leaf area, stem diameter, number of leaf pairs, total chlorophyll content (SPAD), fresh mass, dry mass and physiological indexes (net assimilation rate, absolute growth rate, relative growth rate, leaf area index and leaf area ratio). Plants derived from somatic embryogenesis with an initial height of 2.1-3.0 cm and 3.1-4.0 cm presented the best morphological and physiological characteristics related to growth and development. The plants that initially had a higher height had the highest values of relative and absolute growth with significant differences with respect to the plants with a lower initial height (1.5 -2.0 cm and 2.1-3.0 cm). It was found that the initial height of the coffee plant cv. Caturra red J-884 obtained by somatic embryogenesis influences its morphological and physiological response in nursery adaptation.
Keywords: ex vitro adaptation, coffee, somatic embryo, morphophysiology, physiological indexes
INTRODUCCIÓN
Los estudios sobre la propagación asexual mediante la embriogénesis somática (ES) en cafetos (Coffea arabica L. y Coffea canephora Pierre ex Froehner) se iniciaron a nivel mundial en la década de los años 70, del siglo XX. Con la utilización de esta técnica se pretende establecer la producción de plantas de alto potencial productivo y reducir los costos de producción de posturas (De Rezende et al., 2016).
La adaptación de las plantas obtenidas in vitro a condiciones ambientales ex vitro es uno de los puntos más críticos del proceso para la utilización de las plantas con fines productivos. Por ello, constituye una de las fases más importantes del proceso de embriogénesis somática. Esta fase es la etapa final del proceso, de ahí que sea trascendental para la propagación comercial de plantas. El éxito dependerá en gran medida de la eficiencia total del proceso durante la propagación in vitro, esto garantiza la adaptación de las plantas propagadas a las condiciones ambientales, antes de ser llevadas a campo (Hazarika, 2003; Rodríguez et al., 2005).
Este trabajo se realizó con el objetivo de determinar la influencia de la altura de las plantas de cafeto obtenidas por embriogénesis somática en la supervivencia y adaptación ex vitro en vivero.
MATERIALES Y MÉTODOS
Material vegetal
Como material vegetal se utilizaron plantas de Coffea arabica L. cv. Caturra rojo J-884 obtenidas por embriogénesis somática (Barbón et al., 2003) y con las características morfológicas según describió Ortiz et al. (2017).
Caracterización morfofisiológica
Se conformaron tres tratamientos de acuerdo con la altura de las plantas: 1.5-2.0 cm; 2.1-3.0 cm y 3.1 - 4.0 cm con el objetivo de determinar la influencia del tamaño de las plantas de cafeto obtenidas por embriogénesis somática en la supervivencia y adaptación ex vitro en condiciones de vivero. Además, todas las plantas presentaban de dos a cuatro pares de hojas y desarrollo del sistema radical (Figura 1).
El ensayo se realizó en un vivero, ubicado en la zona del macizo de Guamuhaya (Villa Clara, Cuba). Se emplearon por tratamiento 80 plantas obtenidas por embriogénesis somática. Para la adaptación de las plantas se emplearon tubetes (Propileno atóxico con AntiUV) de un volumen total de 180 cm3. El sustrato empleado estaba conformado por suelo Fersialítico pardo (categoría 2) y humus de lombriz (1:1).

La temperatura promedio durante el día fue de 24.5±3.0 oC, 85% de humedad relativa y 224-457 μmol m-2 s-1 de intensidad luminosa (EXTECH Light meter). Durante los primeros 15 días de cultivo, se empleó una malla de color negro para obtener un 70% de sombreo y se retiró posteriormente para incrementar la luminosidad.
La frecuencia de riego por microaspersión fue de cuatro veces al día (9.00, 11.00, 14.00 y 16.00 horas) con una duración de dos minutos cada riego. A las plantas también se les realizaron tres aplicaciones de fertilizante (NPK) en una proporción (7:14:7) diluido al 12% y en cada tubete se añadieron 20 ml.
Se evaluaron las siguientes variables durante los 180 días de cultivo:
- Supervivencia (%): número de plantas vivas a los 15 días de cultivo expresado en porcentaje.
- Altura de las plantas (cm) desde la base del tallo hasta el ápice. Se realizó la medición con el empleo de una regla graduada.
- Diámetro del tallo de las plantas (cm). Se realizó la medición con el empleo de un Pie de Rey a 1 cm de altura de la base del tallo.
- Número de pares de hojas (u).
- Área foliar de las plantas (cm2) según el método propuesto por Soto (1980) para cultivares de C. arabica L. basada en la fórmula siguiente:
AF (cm2)=largo de hoja x ancho de la hoja x 0.64 (referido a área foliar de todas las hojas nuevas formadas durante la adaptación ex vitro).
- Masa fresca (g) y seca (g) de hojas, tallo, raíz y total.
- Índices fisiológicos:
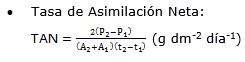
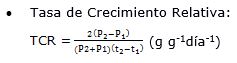


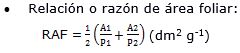
Donde en la fórmula: P1 es la masa seca total (g) al inicio del cultivo, P2 es la masa seca total (g) a los 180 días de cultivo (t2), A1 es el área foliar al inicio del ensayo, A2 es el área foliar a los 180 días de cultivo, t1= 0 días y t2= 180 días, AF es el área foliar total y A es el área ocupada por la planta.
Análisis estadísticos
La comparación de valores de las variables, se realizó mediante una prueba de Tukey o una prueba H de Kruskal Wallis, según los resultados de la comprobación previa de los supuestos de normalidad y homogeneidad de varianza con el empleo del paquete estadístico InfoStat versión 1.0 (2012).
RESULTADOS Y DISCUSIÓN
A los 15 días de cultivo, la altura de las plantas in vitro, obtenidas por ES, no influyó en su supervivencia durante la adaptación ex vitro en vivero. Se encontraron valores de 86.3% (altura 1.5 – 2.0 cm), 90.0% (altura 2.1 – 3.0 cm) y 91.1% (altura 3.1 – 4.0 cm) sin diferencias significativas entre los tratamientos.
Esta respuesta similar pudiera ser debido a que la calidad morfofisiológica adquirida de estas plantas durante las fases de germinación y conversión que permitió una alta supervivencia ex vitro.
La supervivencia de plantas de cafeto obtenidas por ES cuando se transfieren a condiciones ex vitro ha sido referida entre el 70 y 100%. En este sentido, Barbón et al. (2014) emplearon para la adaptación en casa de cultivo plantas de cafeto obtenidas por ES con una altura de 3.0 - 4.0 cm e informaron valores de supervivencia entre 89.3-100%. Mientras, Ortiz et al. (2014) en estudios realizados en condiciones de vivero con la utilización de plantas híbridas de cafeto obtenidas por ES y de 2.0 a 2.5 cm de altura alcanzaron una supervivencia de 85.0%. De igual forma, De Rezende et al. (2016) determinaron que al utilizar plantas de cafeto de 1.50 a 2.51cm de altura procedentes de la fase de germinación se alcanzó un 78% de supervivencia. Asimismo, Ortiz et al. (2017) en ensayos realizados en plantas de cafeto cultivar Caturra rojo J-884 de 2.0-3.0 cm obtuvieron un 100% de supervivencia.
Sin embargo, se encontraron diferencias significativas en cuanto a variables morfológicas relacionadas con el crecimiento y desarrollo entre los diferentes tratamientos de altura de las plantas al finalizar los 180 días de cultivo (Figura 2).

Las plantas con una altura inicial entre 3.1- 4.0 cm alcanzaron los mayores valores de altura y número de hojas a los 180 días de cultivo con diferencias significativas con las plantas que inicialmente tenían una altura de 1.5-2.0 cm y 2.1-3.0 cm (Tabla 1). En este tratamiento también se obtuvieron los mayores valores de grosor de tallo, área foliar, masa fresca y masa seca pero sin diferencias significativas con las plantas con una altura inicial de 2.1-3.0 cm.
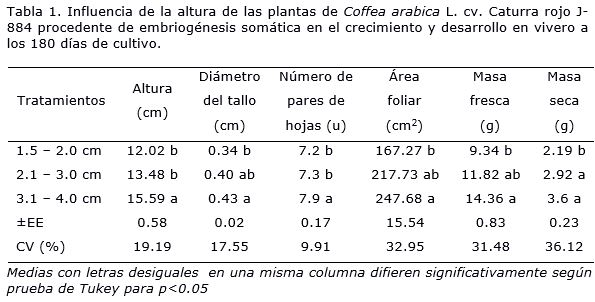
Las plantas con una altura inicial de 1.5 – 2.0 cm, mostraron a los 180 días de cultivo una respuesta similar con las plantas con una altura de 2.1-3.0 cm con respecto a las variables altura, diámetro de tallo, área foliar y masa fresca. Esto indica como las plantas de un rango de altura entre 1.5-2.0 cm durante su adaptación ex vitro alcanzan un desarrollo morfológico similar a las plantas con una altura inicial de 2.1-3.0 cm. Sin embargo, al realizarse el análisis de los índices fisiológicos se demostró que entre estas plantas no hubo el mismo desarrollo fisiológico (Tabla 2.)
Se determinó que hubo una influencia de la altura inicial de la planta en su respuesta morfológica y fisiológica. Las plantas que inicialmente tenían una mayor altura (3.1 - 4.0 cm y 2.1- 3.0 cm) fueron las que presentaron los mayores valores en los índices fisiológicos. Estas presentaron los mejores resultados de crecimiento relativo y absoluto con diferencias significativas con respecto a las plantas con una menor altura inicial (1.5 - 2.0 cm) (Tabla 2).

Las plantas con una altura inicial de 1.5–2.0 cm y 2.1–3.0 cm no presentaron diferencias significativas en las distintas variables morfológicas pero sí se encontraron diferencias en la masa seca. Esta variable es un buen indicador del desarrollo fisiológico de la plantas, es por ello que las plantas con una mayor altura y área foliar poseen una mayor tasa de crecimiento relativo y absoluto. La tasa de crecimiento relativo es un concepto central, que se define como el incremento de biomasa por unidad de tiempo (Hunt, 1978; Vilchez et al., 2015). Durante los primeros días de crecimiento y desarrollo de las plantas, el crecimiento suele tener una dinámica exponencial y suele reflejar diferencias significativas entre especies y condiciones de crecimiento (De Grazia et al., 2007). Por otra parte, en plantas con una mayor altura se logra una mayor tasa de asimilación neta, ya que el componente fisiológico de esta variable es el resultado de un balance neto entre la ganancia por la tasa de fotosíntesis y las pérdidas por las tasas de respiración de las hojas, tallos y raíces. No obstante, también intervienen otros factores como es la distribución de la biomasa a diferentes órganos, la composición química y la formación de área foliar en la planta (Vilchez et al., 2015).
Similar respuesta se observó en las plantas de una mayor altura en cuanto a la tasa de crecimiento absoluta. Este indicador fisiológico del crecimiento estuvo influenciado por un incremento de la masa seca debido a las características de una mayor calidad de la planta desde el punto de vista morfológico desde el inicio del cultivo (De Grazia et al., 2004). Es por ello que cuando existe un mayor incremento en masa seca, esto contribuye a que la razón de área foliar sea menor, lo cual se observó para las plantas de altura 2.1-3.0 cm y 3.1 - 4.0 cm.
Con respecto a la altura inicial de las plantas obtenidas por embriogénesis somática y la tasa de crecimiento absoluta, esta última no expresa la intensidad con que se produce el cambio de una forma correcta, pues su valor depende mucho de la proporción entre lo que se produce por unidad de tiempo y la masa total de la planta (Vázquez y Torres, 2006).
El mejor resultado de tasa de crecimiento relativa se obtuvo en las plantas con una altura 2.1– 3.0 cm y 3.1– 4.0 cm, con diferencias significativas con las planta más pequeñas (1.5- 2.0 cm). Según De Grazia et al. (2007) la tasa de crecimiento relativa en base a la masa seca debe ser más elevada para plantas con un mayor desarrollo morfológico al momento de ser plantadas en condiciones ex vitro y esto es un indicador que las plantas in vitro se han adaptado a las condiciones de vivero. Este resultado corrobora lo planteado por Chandra et al. (2010) de que las plantas están adaptadas a las condiciones ex vitro cuando se desarrollan nuevas hojas e incrementan la masa seca durante el proceso de crecimiento y desarrollo.
Las plantas con 2.1-3.0 cm y 3.1 – 4.0 cm de altura presentaron una mayor área foliar y esto juega un importante papel en el desarrollo de las plantas en la interfase in vitro – ex vitro. Hazarika (2003) refirió que es conocido que las hojas producidas en condiciones in vitro son empleadas como almacén de sustancias carbonadas, las cuales son utilizadas en el crecimiento y desarrollo de las plántulas. Cuando son transferidas a las condiciones ex vitro mantienen esta función hasta tanto no exista una nueva emisión foliar. El primer par de hojas emitidas en condiciones ex vitro son de características autotróficas y acumulan temporalmente fotosintatos; donde una parte de estos, es retenida por la hoja para su crecimiento y metabolismo y la otra parte es exportada fuera de la hoja hacia tejidos y órganos no fotosintéticos. Los fotoasimilados producidos tienen dos funciones la producción de energía y la síntesis de nuevos compuestos como la coenzima del complejo B, que son esenciales para el desarrollo del sistema radical y el metabolismo respiratorio. La formación de un sistema radical desarrollado permitirá la absorción de nutrientes del suelo y agua para el mantenimiento de la planta (Hopkins y Hüner, 2004).
Las plantas con una altura de 2.1-3.0 cm y 3.1 -4.0 cm mostraron los mayores índices de área foliar, la cual es la proporción de área de las hojas que está cubriendo la unidad de área del suelo que ocupa la planta. Por ello, la determinación del área foliar de las plantas tiene gran importancia en los estudios relacionados con su crecimiento y desarrollo, dado que en las hojas se sintetizan los carbohidratos que van a repartirse entre los diferentes órganos. La capacidad de fotosíntesis de las plantas está directamente relacionada con la superficie foliar expresada como índice de área foliar (Kozlowski et al., 1991). Los resultados coinciden con los obtenidos por De Grazia et al. (2007), quienes determinaron que la calidad morfológica de la planta y las condiciones de cultivo aumentan los valores del índice de área foliar.
En otras especies como Juglans regia L. se ha demostrado que con el incremento del índice foliar hay un mayor desarrollo fisiológico de la plantas debido a que se elevan los niveles de fotosíntesis (Campbell et al., 2001; Rodríguez et al., 2001).
Los resultados de este trabajo demuestran que es necesario que las plantas in vitro que son transferidas a condiciones ex vitro tengan una adecuada calidad expresada en indicadores como la altura de la planta para obtener resultados óptimos en su crecimiento y desarrollo. Esto corrobora lo planteado por Jiménez et al. (2012) quienes señalaron que la procedencia y calidad morfológica de las plantas in vitro beneficia su supervivencia y adaptación ex vitro. Además, Pérez et al. (2016) describieron la importancia de adecuada altura y buena calidad de las plantas in vitro para su desarrollo durante la adaptación ex vitro, porque de esto depende la supervivencia, velocidad de crecimiento y productividad final durante la fase de campo.
CONCLUSIONES
La altura inicial de plantas in vitro de cafeto obtenidas por ES influye en su crecimiento y desarrollo durante su adaptación ex vitro en vivero. Las plantas con una altura inicial de 2.1- 3.0 cm y 3.1- 4.0 cm presentan mejores características morfológicas y fisiológicas a los 180 días durante su adaptación ex vitro en vivero.
Conflicto de intereses
Los autores no declaran conflictos de intereses.
REFERENCIAS
Barbón R, Nguyen H, Capote A, de Feria M, Pérez A, Rivero L, Leiva M, O Hurtado (2014) Efecto de mezclas de sustratos en la fase de conversión de plantas de Coffea arabica L. cv. ‘Caturra rojo’ obtenidas por embriogénesis somática. Biotecnología Vegetal 14(4): 205 – 213
Barbón R, Jiménez E, Capote A (2003) Influencia del genotipo y la densidad de inoculación sobre la diferenciación de embriones somáticos de Coffea arabica L. cv. Caturra rojo y Coffea canephora cv Robusta. Biotecnología Vegetal 3(3): 131-135
Campbell CS, Heilman JL, Mcinnes KJ, Wilson LT, Medley JC, Wu G, Cobos DR (2001) Seasonal variation in radiation use efficiency of irrigated rice. Agricultural and Forest Meteorology 110: 45-54; doi:10.1016/S0168-1923(02)00210-1
Chandra S, Bandopadhyay R, Kumar V, Chandra R (2010) Acclimatization of tissue cultured plantlets: from laboratory to land. Biotechnol Lett 32: 1199–1205; doi:10.1007/s10529-010-0290-0
De Grazia J, Tittonell PA, Chiesa A (2007) Efecto de sustratos con compost y fertilización nitrogenada sobre la fotosíntesis, precocidad y rendimiento de pimiento (Capsicum annuum). Cien Inv Agr 34(3): 195-204; doi:10.4067/S0718-16202007000300003
De Grazia J, Tittonell PA, Chiesa Y, A (2004) Eficiencia en el uso de agua en la producción de plantines de pimiento (Capsicum annuum L.) cultivados en sustratos adicionados con polímeros superabsorbentes. Horticultura Argentina 23: 22-28
De Rezende AL, Almendagna F, Pasqual M, Siqueira CE (2016) Acclimatization of coffee (Coffea racemosa x Coffea arabica) somaclones obtained from temporary immersion bioreactor system (RITA®). AJCS 10(2): 169-175
Hazarika B (2003) Acclimatization of tissue culture plants. Current Science (Bangalore) 85(12): 1704 – 1712; doi:10.1007/s10529-010-0290-0
Hopkins W, Hüner NPA (2004) Introduction to Plant Physiology. Editorial John Wiley and Sons, USA; ISBN: 978-0-470-24766-2
Hunt R (1978) Plant growth analysis. Edward Arnold Publishers, London
Jiménez F, Agramonte D, Ramírez M, Pérez M, La O M, Pons M, Collado R (2012) Uso de humus de lombriz en la formulación de sustratos para la aclimatización de cultivos tropicales. Centro Agrícola 39(3): 37-44
Kozlowski T, Kramer P, Pallarady S (1991) The Physiological Ecology of Woody Plants. Editorial Academic Press, New York; doi:10.1016/C2009-0-02706-8
Ortiz N, Barbón R, Capote A, Pérez A, Robaina M (2017) Caracterización morfológica en vivero de plantas de Coffea arabica L. cv Caturra rojo J-884 obtenidas por embriogénesis somática. Biotecnología Vegetal 17(4): 251 – 257
Ortiz N, Turiño M, Ferras Y, Meneses I (2014) Efectos de diferentes sustratos en el desarrollo de vitroplantas de Coffea arabica L. en fase de aclimatización. Café Cacao 13(1): 66-69
Pérez N, Capote A, Pérez A, Gómez L, Chong B (2016) Efecto del sustrato en la aclimatización de plantas in vitro de Aloe vera L.. Biotecnología Vegetal 16(3): 161 – 169
Rodríguez D, Ewert F, Goudriaan J, Manderscheid R, Burkart S, Weigel HJ (2001) Modeling the response of wheat canopy assimilation to atmospheric C02 concentrations. New Phytologist 150: 337-346; doi:10.1046/j.1469-8137.2001.00106.x
Rodríguez A, Rodríguez AA, Nodals B, Álvarez D, Estrada J, García X, Pompa C, Hernández A, Somonte R, Sánchez A (2005) Biotecnologías hechas a la medida para el desarrollo endógeno de la agricultura urbana en tres municipios de Cuba. Revista Agrotecnia de Cuba 4(1): 370-385
Vázquez EB, Torres SG (2006) Fisiología Vegetal. Editorial Félix Varela, La Habana; ISBN: 959-258-211-4
Vilchez J, Martinez L, Albany N (2015) Comparison of growth in nursery between seedlings and vitroplants of guava cultivar red dwarf cuban EEA-1840. Interciencia 40(4): 270-274
Recibido: 13-12-2017
Aceptado: 16-02-2018
Copyright (c) 2018 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
