Artículo original
Biotecnología Vegetal Vol. 18, No. 3: 181 - 188, julio - septiembre, 2018
Instituto de Biotecnología de las Plantas. UCLV. MES
eISSN 2074-8647, RNPS: 2154
Evaluación de la fitotoxicidad de un extracto acuoso del alga Padina gymnospora (Kützing) sobre semillas de Lactuca sativa L.
Phytotoxicity evaluation of an aqueous extract of Padina gymnospora seaweed on Lactuca sativa L. seeds
Zenia González-Giro1, Pedro Luis Batista-Corbal2, Yuleidis González-Pérez2, Elizabeth Rodríguez-Leblanch2, Eber Marcos-Albear2
1Departamento de Morfofisiología, Facultad de Ciencias Agropecuarias, Universidad de Camagüey. Circunvalación Norte km 5 ½. Camagüey. Camaguey. Cuba. CP 74 650. e-mail: zenia.gonzalez@reduc.edu.cu; gzenia18@gmail.com
2Centro de Toxicología y Biomedicina (TOXIMED). Carretera Autopista Nacional km 1 ½. Santiago de Cuba. Santiago de Cuba. Cuba. CP 90400.
RESUMEN
Padina gymnospora (Kützing), es una alga con potencialidades farmacológicas y bioestimulantes. El objetivo de esta investigación fue evaluar la fitotoxicidad de un extracto acuoso de P. gymnospora mediante un bioensayo con semillas de Lactuca sativa L. La biomasa de P. gymnospora se colectó en la zona Este del litoral de Santiago de Cuba, Cuba. Se realizó tamizaje fitoquímico del extracto y se determinaron las principales familias de metabolitos secundarios presentes en él. Se cuantificaron los polifenoles por el método de Folin-Ciocalteu. El bioensayo de fitotoxicidad se realizó in vitro, con una duración de 120 horas. Se analizaron dos concentraciones del extracto: extracto puro (P-100) y una dilución al 50% (P-50). El control negativo fue agua destilada. Se evaluó la influencia de ambas concentraciones sobre el porcentaje de germinación relativo (PGR), el porcentaje de crecimiento de radícula relativo (CRR) y con estos dos parámetros se calculó el índice de germinación (IG). Además, se midió la longitud del hipocótilo. Se identificaron un total de seis familias de metabolitos secundarios. Los más abundantes fueron los compuestos fenólicos y/o taninos y los carbohidratos. La concentración de polifenoles fue estimada en 0.384 mg g-1 en equivalentes de ácido tánico. Las dos concentraciones del extracto produjeron más del 95% de germinación de las semillas. Los valores de CRR fueron de 45.77% para P-100 y 47.15% para P-50 lo que indicó inhibición de la longitud radicular. El IG fue de 46.57% y 45.49% para P-100 y P-50, respectivamente. La longitud del hipocótilo en ambos tratamientos superó al control. El extracto se clasificó de como levemente tóxico para el biomodelo empleado.
Palabras clave: análisis fitoquímico, metabolitos secundarios, fitotoxicidad, algas marinas
ABSTRACT
Padina gymnospora (Kützing) is an algae with pharmacological and biostimulant potentials. The objective of this investigation was to evaluate the phytotoxicity of an aqueous extract of P. gymnospora by means of a bioassay with seeds of Lactuca sativa L. The biomass of P. gymnospora was collected in the eastern zone of the coast of Santiago de Cuba, Cuba. Phytochemical screening of the extract was carried out and the main families of secondary metabolites present in it were determined. The polyphenols were quantified by the Folin-Ciocalteu method. The phytotoxicity bioassay was carried out in vitro, with a duration of 120 hours. Two concentrations of the extract were analyzed: pure extract (P-100) and a 50% dilution (P-50). The negative control was distilled water. The influence of both concentrations on the percentage of relative germination (PGR), the percentage of relative radicle growth (CRR) was evaluated and with these two parameters the germination index (GI) was calculated. In addition, the length of the hypocotyl was measured. A total of six families of secondary metabolites were identified. The most abundant were phenolic compounds and / or tannins and carbohydrates. The concentration of polyphenols was estimated at 0.384 mg g-1 in tannic acid equivalents. The two concentrations of the extract produced more than 95% germination of the seeds. The CRR values were 45.77% for P-100 and 47.15% for P-50, which indicated inhibition of root length. The IG was 46.57% and 45.49% for P-100 and P-50, respectively. The length of the hypocotyl in both treatments exceeded the control. The extract was classified as slightly toxic for the biomodel used.
Keywords: phytochemical screening, phytotoxicity, seaweed, secondary metabolites
INTRODUCCIÓN
El uso de las algas marinas como bioestimulantes, es un sector en crecimiento en varias partes del mundo, especialmente en Europa, Asia y varios países de Latinoamérica (Canales, 2001). A pesar de ser una actividad bastante antigua, fundamentalmente en países asiáticos, esta práctica ha alcanzado un lugar de mérito entre las estrategias agroecológicas que posibilitan cosechas productivamente superiores (Sharma et al., 2014).
Las ventajas que proporciona el uso de algas marinas en la agricultura son varias, entre las que se destaca el acondicionamiento de suelos, la fertilización y estimulación de los cultivos, así como la protección frente a determinadas plagas y enfermedades (Shanmughapriya et al., 2008; Wajahatullah et al., 2009). El empleo de extractos líquidos de algas para estos fines, ha experimentado un incremento notable al igual que las formulaciones sólidas. Se reconocen más de 20 productos con marca registrada, elaborados con algas marinas y con excelentes resultados en la promoción del crecimiento vegetal (Wajahatullah et al., 2009; Shekhar et al., 2012).
Una de las razones que hacen a las algas marinas buenas candidatas para la producción de bioestimulantes vegetales, es la presencia de una extensa gama de sustancias bioactivas que pueden favorecer el crecimiento vegetal, entre ellas fitohormonas, macro y micronutrientes, citoquinas, aminoácidos y vitaminas (Wajahatullah et al., 2009). Además de estos compuestos, las algas poseen otros metabolitos únicos como los polisacáridos sulfatados y algunos polifenoles que, según otras investigaciones mejoran la resistencia al estrés (Rioux et al., 2007; González et al., 2013).
Padina gymnospora, es una macroalga parda de la familia Dictyotaceae. Estudios recientes demuestran sus potencialidades antifúngicas en plantas, en la disminución del porciento de infección por hongos patógenos, además de su actividad estimulante del crecimiento en plántulas, mostrando notables evidencias para su uso en el desarrollo de bioestimulantes efectivos que contribuyan a mejorar cosechas (Ibraheem et al., 2017; Hernández et al., 2016). Esta especie, crece abundantemente en todo el litoral rocoso de la provincia de Santiago de Cuba.
En Cuba, las investigaciones respecto a P. gymnospora son escasas, no existen informes sobre sus potencialidades como bioestimulante del crecimiento vegetal, lo que a su vez constituye un nuevo enfoque, dirigido a un mejor aprovechamiento de los recursos marinos en función de una agricultura sostenible y mayor producción de alimentos.
De forma general, una gran parte de los compuestos activos presentes en las algas favorecen el crecimiento y desarrollo de los cultivos. No obstante, sus extractos al ser mezclas complejas de muchos compuestos, no siempre resultan del todo beneficiosos. En ocasiones la presencia y concentración de ciertos metabolitos, provocan efectos alelopáticos negativos que pueden manifestarse en cualquiera de la etapas de desarrollo de la planta (Igartuburu, 2000; Rodríguez et al., 2002). De ahí que sea necesario, siempre que se trabaje con extractos totales de algas marinas, evaluar a nivel in vitro, posibles efectos que pudieran presentarse antes de su aplicación en el campo.
Una herramienta muy útil, a la hora de evaluar el riesgo y predecir los posibles efectos que sobre las plantas ejercen las sustancias químicas contenidas en las formulaciones, es el ensayo de fitotoxicidad en semillas de lechuga (Lactuca sativa L.). Este ensayo ecotoxicológico, es una prueba que puede evaluar los efectos fitotóxicos de compuestos puros o de mezclas complejas en el proceso de germinación de las semillas y en el desarrollo de las plántulas (Lallana et al., 2013). Esta prueba ha ganado aceptación porque suministra resultados confiables, económicos, simples y rápidos (Navarro et al., 2006; Águila et al., 2013).
El objetivo de esta investigación fue evaluar la fitotoxicidad de un extracto acuoso de la macroalga P. gymnospora mediante el bioensayo con semillas de lechuga.
MATERIALES Y MÉTODOS
Origen de la muestra
La colecta del alga P. gymnospora se realizó en el mes de febrero, correspondiente a la temporada seca. La biomasa húmeda del alga se obtuvo a través del buceo, a 12 m de profundidad, en los camellones de corales del litoral rocoso de Playas del Este en la provincia de Santiago de Cuba, Cuba. La identificación taxonómica se realizó según Littler y Littler (2000) en el Centro Oriental de Ecosistemas y Biodiversidad (BIOECO) de la misma provincia. La muestra fue depositada en la colección ficológica de dicho centro.
Procesamiento de la muestra
La biomasa húmeda del alga P. gymnospora se limpió manualmente en el laboratorio, para eliminar restos de epífitos y flora acompañante. Se lavó abundantemente con agua corriente y agua destilada. Luego de escurrirlas se secaron en una estufa a 40°C hasta obtener un peso constante. La muestra se molió en un molino (BOSCH) y se tamizó hasta obtener partículas inferiores a cuatro milímetros.
Obtención de los extractos
Se pesaron 20 g del alga molida y tamizada. La muestra se colocó en un Erlenmeyer y se humectó con 100 ml de agua destilada por 30 min. Luego se le adicionó agua destilada hasta completar un volumen de 200 ml y pasado este tiempo se transfirió a una lavadora ultrasónica (SAKURA US-5E). La extracción se realizó por 1h a 40°C con una frecuencia de 28 Hz. El extracto acuoso fue filtrado al vacío y almacenado en refrigeración a 4 0C hasta su utilización.
Detección fitoquímica de los metabolitos en el extracto
Al extracto se le midió el pH antes de realizar la evaluación fitoquímica. Las técnicas cualitativas empleadas para este análisis, fueron tomadas de la Guía Metodológica para la Investigación Fitoquímica de Plantas Medicinales del Ministerio de Salud Pública de Cuba (MINSAP, 1997).
La cuantificación de fenoles totales en el extracto fue determinada en un espectrofotómetro (PG INS-TRUMENTS, modelo T60-U) a 675 nm, utilizando el reactivo de Folin-Ciocalteu. Para la construcción de la curva de calibración se empleó una solución estándar de ácido tánico (0.1 mg ml-1). El resultado fue expresado en mg g-1 de extracto como equivalentes de ácido tánico.
Bioensayo de fitotoxicidad
Se siguió la metodología descrita por Hernández et al. (2016) con modificaciones. Se colocaron 20 semillas por placa de Petri, cubiertas con un papel de filtro Whatman 42. Se le adicionaron 3 ml de extracto y se incubaron a una temperatura mantenida de 22 ± 2°C en la oscuridad durante 120 horas. Se dejó suficiente espacio entre ellas para su adecuado crecimiento. Se probaron un control (agua destilada) y dos concentraciones del extracto: puro (100%, P-100) y diluido al 50% (P-50) y con tres réplicas cada uno. Se cuantificó el número de semillas germinadas y se midió la longitud de la radícula (mm). Con estos valores se calculó el porcentaje de germinación relativo (PGR), el porcentaje de crecimiento de radícula relativo (CRR), y con estos los Índices de Germinación (IG) para cada tratamiento, mediante las siguientes ecuaciones (Tiquia, 2000):
PGR (%) = N° de semillas germinadas en el extracto x100
N° de semillas germinadas en el control
CRR (%) = Elongación de radícula en el extracto x100
Elongación de radícula en el control
IG (%) = PGR x CRR
100
Análisis estadístico
Se aplicó un diseño completamente a azar. Se comprobó la hipótesis de la normalidad de las distribuciones mediante la prueba de Kolmogorov-Smirnov. Los resultados fueron procesados estadísticamente a través de un ANOVA de clasificación simple, a un nivel de confianza del 95%, usando el paquete Statgraphics Plus versión 5.1. La comparación de las medias se hizo por la prueba de Contraste Múltiple de Rango para p<0.05.
RESULTADOS Y DISCUSIÓN
Detección fitoquímica de los metabolitos en el extracto
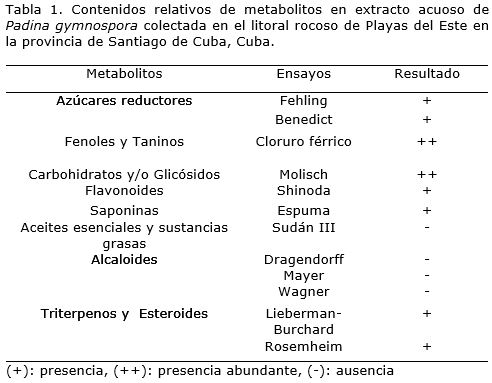
El proceso de extracción acuosa de la biomasa de P. gymnospora empleando ondas ultrasónicas, posibilitó la extracción de varias familias de metabolitos secundarios de interés biológico. Los más representativos en cuanto a su abundancia fueron los fenoles y/o taninos y los carbohidratos y/o glicósidos (Tabla 1). Este método según otros autores, resulta muy favorable en comparación con otros por la cantidad de compuestos extraídos en un tiempo relativamente menor (Zhang et al., 2011; González et al., 2014).
La síntesis estos metabolitos, generalmente está asociada en las algas marinas, con la producción de sustancias de reserva y protección química frente a diversos factores bióticos y abióticos que provocan estrés (Rioux et al., 2007; Mascheck y Baker, 2008; González et al., 2013). Algunos compuestos de naturaleza fenólica (ácidos fenólicos, florotaninos, y flavonoides) son fácilmente extraíbles en solventes acuosos, de ahí su presencia en el extracto de P. gymnospora. La concentración de polifenoles en el extracto fue de 0.384 mg g-1 en equivalentes de ácido tánico. Estos resultados fueron similares a los obtenidos por Echaverría et al. (2009) quienes refirieron en otros géneros de algas pardas valores de 0.8 hasta 0.3 mg g-1 de fenoles totales. Cabe destacar que la síntesis de estos compuestos en las algas está directamente relacionada con la protección frente a radicales libres y otros agentes oxidantes presentes en el medio (Rodríguez et al., 2013; Abdala et al., 2014).
La presencia abundante de carbohidratos, también es justificable por el hecho de que en las algas existe una gran diversidad de polisacáridos, algunos de ellos exclusivos de este heterogéneo grupo. Tal es el caso de los fucoidanos, alginatos, carragenanos, entre otros (Vera et al., 2011). Su función por lo general es estructural. Sin embargo, se ha señalado que algunos de estos compuestos tienen actividad sinérgica, principalmente en unión a proteínas, regulación de coenzimas, osmoregulación, barrido de radicales libres, que favorece el crecimiento y la resistencia a enfermedades en las plantas. Esto último es atribuido a que los carbohidratos sirven como fuente principal de carbono y energía, además de que potencia la resistencia total de la planta ante infecciones bacterianas, fúngicas y virales (Stirk et al., 2004; Wang et al., 2004; Liu et al., 2005; Wajahatullah et al., 2009; González et al., 2013).
Bioensayo de fitotoxicidad
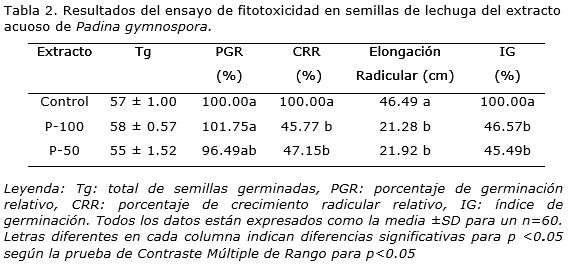
Las dos concentraciones probadas produjeron más del 95% de germinación de las semillas. Los valores promedios del porcentaje de germinación relativo (PGR) que se obtuvieron, fueron superiores al 90% (Tabla 2). Según Poi de Neiff y Ramos (2001), las muestras que producen porcentajes de germinación superiores al 90% se clasifican como no tóxicas para este parámetro, por lo que en este caso se puede afirmar que el extracto de P. gymnospora no produjo un efecto negativo en la germinación de las semillas de lechuga, en ambas concentraciones. Resultados similares han sido observados con la aplicación de extractos líquidos de esta y otras especies de algas pardas como Sargassum liebmannii J.Agardh y Sargassum johnstonii Setchell & Gardner (Kumari et al., 2011; Hernández et al., 2014).
En la elongación radicular, parámetro considerado subletal, se evidenció un acortamiento de las radículas en las semillas tratadas (Figura 1). Los valores de crecimiento radicular relativo (CRR) al cabo de las 120 h, mostraron diferencias significativas (p<0.05) en comparación con el control (Tabla 2). Estos resultados sugieren un efecto inhibitorio del crecimiento de la radícula, que en este caso fue superior al 50% para P-100 (54%) y P-50 (52%). Los valores del índice de germinación (IG) estuvieron por debajo del 50%, en ambos tratamientos (Tabla 2), lo cual sugiere un efecto fitotóxico post-germinativo leve. Al respecto, Zucconi et al. (1981) consideraron que las muestras con índices germinativos inferiores al 60% tienen algún grado de toxicidad.
Si bien es conocido que los extractos de algas marinas son en sentido general estimuladores del crecimiento vegetal, otra cuestión importante es que no todas las algas son iguales, ni tampoco los procedimientos para elaborar extractos a partir de ellas. Cuando se trata de extractos de algas marinas, hay que tener en cuenta que son mezclas complejas de varios compuestos, muchos de ellos con efectos beneficiosos para el desarrollo de las plantas en determinadas concentraciones y otros que por el contrario retardan o inhiben ciertos procesos en ellas (Oliveros et al., 2009). En el extracto de P. gymnospora pudieron identificarse tres de estos grupos de metabolitos con efectos alelopáticos: flavonoides, ácidos fenólicos y/o taninos y saponinas. Al respecto algunos estudios han demostrado cómo los extractos acuosos de plantas terrestres medicinales y otras como la cebada (Hordeum vulgare L.), arroz (Oryza sativa L.) y trigo (Triticum spp.) ejercen un efecto inhibidor sobre el crecimiento de las raíces de distintas especies vegetales. Esta inhibición según varios autores, se ha visto asociada a la presencia de compuestos como los terpenoides, flavonoides, ácidos fenólicos y saponinas (Rodríguez et al., 2002; Dakora, 2003; Tejeda y Rodríguez, 2008; Oliveros et al., 2009).

Pese a que estos resultados confirman que las concentraciones empleadas resultan fitotóxicas para el desarrollo radicular del biomodelo empleado, no aseguran que el posterior desarrollo de las plántulas se vea comprometido, pues pudo observarse que los hipocótilos de las semillas tratadas, tuvieron un desarrollo superior al control. La longitud del hipocótilo en ambos tratamientos superó al control en 23.6 y 32.6%, respectivamente (Figura 2).

CONCLUSIONES
El extracto acuoso de Padina gymnospora (al 50 y 100%) se considera levemente fitotóxico a partir de los resultados del bioensayo in vitro sobre semillas de lechuga.
REFERENCIAS
Abdala RT, Cabello A, M E, Lopez F (2014) Variación intratalo de compuestos fenólicos, actividad antioxidante y actividad de la fenolsulfatasa en Cystoseira tamariscifolia (Phaeophyceae) del sur de España. Cienc Mar 40(1): 01-09
Águila EJ, Marrero OCh, Cárdenas YE, Bernal NP (2013) Evaluación ecotoxicológica de extractos acuosos de plantas en semillas de rábano, lechuga y tomate. Centro Agrícola 40(1):83-87
Canales B (2001) Uso de Derivados de Algas Marinas en la Producción de Tomate, Papa, Chile y Tomatillo: Resultados de Investigación. Palau Bioquím SA, Coahuila
Dakora FD (2003) Defining new roles for plant and rhizobial molecules in sole and mixed plant cultures involving symbiotic legumes. New Phytologist 158: 39–49
Echaverría B, Franco A, Martínez A (2009) Evaluación de la actividad antioxidante y determinación del contenido de compuestos fenólicos en extractos de macroalgas del Caribe Colombiano. Vitae 16(1): 126-131
González A, Castro J, Vera J, Moenne A (2013) Seaweed oligosaccharides stimulate plant growth by enhancing carbon and nitrogen assimilation, basal metabolism, and cell division. J Plant Growth Regul 32:443–448
González MR, Knoerzer K, Sabarez H, Simal S, Rosselló C, Femenia A (2014) Effect of acoustic frequency and power density on the aqueous ultrasonic-assisted extraction of grape pomace (Vitis vinifera L.) - a response surface approach. Ultrasonics Sonochemistry 21(6): 2176-2184
Hernández RM, Santacruz F, Ruiz MA, Norrie J, Hernández G (2014) Effect of liquid seaweed extracts on growth of tomato seedlings (Solanum lycopersicum L.). J Appl Phycol 26: 619–628
Hernández RM, Santacruz F, Ruiz MA, Hernández G (2016) Activity of seaweed extracts and polysaccharide-enriched extracts from Ulva lactuca and Padina gymnospora as growth promoters of tomato and mung bean plants. J Appl Phycol 28: 2549–2560
Ibraheem BM, Hamed SM, Abd AA, Farag FM, Abdel-Raouf N (2017) Antimicrobial activities of some brown macroalgae against some soil borne plant pathogens and in vivo management of Solanum melongena root diseases. Aust J Basic Appl Sci 11: 157–168
Igartuburu JM (2000) Alelopatía en agroecosistema, Metodologías, aplicaciones y perspectivas. En: INCA (ed) XII Seminario Científico y IV Simposio de Agricultura Sostenible, La Habana, 14-17/11/2000, pp. 63-63. Ediciones INCA, La Habana
Kumari R, Kaur I, Bhatnagar AK (2011) Effect of aqueous extract of Sargassum johnstonii Setchell & Gardner on growth, yield and quality of Lycopersicon esculentum Mill. J Appl Phycol 23: 623–633
Lallana MC, Foti MN, Lallana VH, Elizalde JHI, Billard CE (2013) Determinación de reducción del crecimiento radical (CE50) por una formulación de glifosato utilizando lechuga y trigo como especies bioindicadoras. Fac Cienc Agrar Univ Nac Cuyo 45(1): 00-00
Littler DS, Littler MM (2000) Caribbean Reef Plants. Off Shore Graphics Inc, Washington
Liu ZY, Xie LY, Wu ZJ, Lin QY, Xie LH (2005) Purification and characterization of anti-TMV protein from a marine algae Ulva pertusa. Acta Phytopathol Sin 35: 256–261
Mascheck JA, Baker BJ (2008) The Chemistry of Algal Secondary Metabolism. En: Amsler CD (ed). Algal Chemical Ecology, pp.1-24. Springer, Berlin; doi:10.1007/978-3-540-74181-7_1
MINSAP (1997) Guía metodológica para la investigación en plantas medicinales. Editorial Pueblo y Educación, La Habana
Navarro AR, Arrueta RG, Maldonado MC (2006) Determinación de efecto de diferentes compuestos a través de ensayos de fitotoxicidad usando semillas de lechuga, escarola y achicoria. Toxicol 23: 125-129
Oliveros AJ, Macías FA, Carrera C, Marín D, Molinillo JM (2009) Exudados de la raíz y su relevancia actual en las interacciones alelopáticas. Quím Nova 32(1): 198-213
Poi de Neiff A, Ramos A (2001) Utilización de bioensayos para el estudio ecotoxicológico de los ríos Salado y Negro (Chaco. Argentina). Disponible en: http://www.unne.edu.ar/unnevieja/Web/cyt/cyt/2001/6-Biologicas/B-019.pdf. Consultado 06/02/2018
Rioux LE, Turgeon SL, Beaulieu M (2007) Characterization of polysaccharides extracted from brown seaweeds. Carbohydrate Polym 69: 530–537
Rodríguez AP, Carpizo E, Cupul A (2013) Oxidative damage associated with thermal stress in Pocillopora verrucosa from the Mexican Pacific. Cienc Mar 39: 113–118; doi:10.7773/cm.v39i1.2168
Rodríguez H, Mederos D, Hechevarría I (2002) Efectos alelopáticos de restos de diferentes especies de plantas medicinales sobre la albahaca (Ocimum basilicum L.) en condiciones de laboratorio. Rev Cubana Plant Med 2002(2): 00-00
Shanmughapriya S, Manilal A, Sujith S, Selvin J, Seghal G, Natarajaseenivasan K (2008) Antimicrobial activity of seaweeds extracts against multiresistant pathogens. Annals of Microbiology 58(3): 535-541
Sharma HS, Fleming C, Selby C (2014) Plant biostimulants: a review on the processing of macroalgae and use of extracts for crop management to reduce abiotic and biotic stresses. J Appl Phycol 26: 465–490
Shekhar SHS, Lyons G, McRoberts C (2012) Brown seaweed species from Strangford Lough: compositional analyses of seaweed species and biostimulant formulations by rapid instrumental methods. J Appl Phycol 24: 1141–1157
Stirk WA, Arthur GD, Lourens AF, Novak O, Strnad M, van Staden J (2004) Changes in cytokinin and auxin concentrations in seaweed concentrates when stored at an elevated temperature. J Appl Phycol 16: 31–39
Tejeda O, Rodríguez MT (2008) Inhibidores de germinación y crecimiento de maleza y hortalizas, en residuos de amaranto (Amaranthus hypochondriacus L.). Agrociencia 42(4): 415
Tiquia SM (2000) Evaluating phytotoxicity of pig manure from the pig on litter system. En: Warman PR, Taylor BR (Eds). Proceedings of the International Composting Symposium, pp. 625-647. CBA Press Inc, Truro
Vera J, Castro J, González A, Moenne A (2011) Seaweed polysaccharides and derived oligosaccharides stimulate defense responses and protection against pathogens in plants. Mar Drugs 9: 2514–2525
Wang S, Zhong FD, Zhang YJ, Wu ZJ, Lin QY, Xie LH (2004) Molecular characterization of a new lectin from the marine algae Ulva pertusa. Acta Biochim Biophys Sin 36: 111–117
Wajahatullah K, Rayirath U, Subramanian SP, Jithesh MN, Rayorath P, Hodges DM, Critchley AT, Craigie JS, Norrie J, Prithiviraj B (2009) Seaweed Extracts as Biostimulants of Plant Growth and Development. J Plant Growth Regul 28: 386–399
Zhang H, Yang X, Wang Y (2011) Microwave assisted extraction of secondary metabolites from plants : Current status and future directions. Trends in Food Science & Technology 22(12): 672–688; doi: 10.1016/j.tifs.2011.07.003
Zucconi F, Peram A, Forte M, De Bertolidi M (1981) Evaluating toxicity of inmature compost. Byocycle 22(4): 54-57
Recibido: 22-02-2018
Aceptado: 08-05-2018
Copyright (c) 2019 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
