ARTÍCULO ORIGINAL
Biotecnología
Vegetal Vol. 15, No. 1: 27 - 34, enero - marzo, 2015
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
Instituto de Biotecnología de las Plantas. UCLV. MES.
Formación de embriones somáticos en cinco cultivares de Theobroma
cacao L. cultivados en Venezuela
Somatic embryos formation in five Theobroma cacao L. cultivars
grown in Venezuela
Andy A. Díaz-López1*, Dinora Sánchez2, Javier Valera-Leal3, Ariadne L. Vegas García4 *Autor para correspondencia
1Instituto Nacional de
Investigaciones Agrícolas. Escuela Socialista de Agricultura Tropical
(INIA-ESAT). Maracay. Venezuela. e-mail: andiaz26@gmail.com
2Unidad de Biodiversidad-Instituto Venezolano de Investigaciones
Científicas (IVIC). Venezuela
3Centro Nacional de Conservación de los Recursos
Genéticos. Ministerio del Poder Popular para el Ambiente Venezuela
4Unidad de Biotecnología Agrícola Vegetal INIA.
CENIAP. Venezuela
RESUMEN
Uno de los principales problemas del cultivo de cacao (Theobroma cacao L.) es la variabilidad observada en las plantaciones obtenidas por semilla que afecta el rendimiento y la calidad del grano. Esto ha llevado a considerar la propagación asexual (estacas e injertos) como una vía para mantener la uniformidad de los materiales vegetales. No obstante, estos métodos no han sido eficientes debido al dimorfismo vegetativo de la planta. La embriogénesis somática pareciera ser la vía más idónea para obtener plantas de cacao. Sin embargo, la formación de embriones somáticos no ha sido posible en muchos cultivares. El objetivo de este trabajo fue formar embriones somáticos con dos tipos de explante inicial (pétalos y estaminodios) en cinco cultivares de cacao con diferentes tiempos de subcultivo (14, 28 y 42 días). El uso del índice de formación de callo (IC) permitió evaluar el proceso de formación de callos con estructuras embriogénicas así como la variabilidad en la respuesta según el cultivar y el tipo de explante. El mayor número total de embriones somáticos, se formó en los estaminodios de `SCA-6' (58 embriones) cuando fueron subcultivados cada 28 días. La mayor frecuencia embriogénica (46.6%) se observó a los 14 días de subcultivo en los pétalos con un total de 47 embriones. Los resultados evidenciaron influencia del cultivar y el tipo de explante sobre la respuesta embriogénica. La frecuencia embriogénica, así como el número de embriones somáticos disminuyó a medida que se prolongó el tiempo de subcultivo.
Palabras clave: cacao, embriogénesis somática, estaminodios, índice de formación de callo, pétalos, tiempo de subcultivo
ABSTRACT
One of the main problems of cocoa (Theobroma cacao
L.) is the observed variability in plantation from seeds that affecting the
yield and quality of grain. This has led to considered asexual propagation
(cuttings and grafts) as a way to maintain uniformity of materials. However,
these methods have not been effective due to vegetative plant dimorphism.
Somatic embryogenesis appears to be the most appropriate way to obtain cocoa
plants, but, the somatic embryos formation has not been possible in many
cultivars. The aim of this work was to form somatic embryos in five cacao
cultivars with two types of initial explant (petals and staminodes) using
different subculture times (14, 28 and 42 days). The use of callus formation
index (IC) allowed to evaluate the process of callus induction and development;
as well as variability in the response depending on the cultivar and the type
of explant. The best response on the total number of somatic embryos occurred
in staminodes `SCA-6' (58 embryos) when it were subcultured every 28 days.
Higher embryogenic frequency (46.6%) was observed after 14 days of subculture
on the petals with a total of 47 embryos, showing a strong influence on the
response of the cultivar and the type of explant. The embryogenic frequency and
the number of somatic embryos decreased as subculture time was increased.
Key words: cocoa, index
of callus formation, petals somatic embryogenesis, staminodes, subculture time
INTRODUCCIÓN
El cacao (Theobroma cacao L.) es una especie originaria de las regiones tropicales del norte de Sur América y que ha sido cultivada en Venezuela desde la época de la colonia. Se estima que fue en 1525 cuando se inició el desarrollo del cultivo (Motamayor et al., 2002). En cuanto a la producción nacional de cacao en grano, durante el año 2009 ésta alcanzó un total de 20 000 t, y se incrementó en 2010 a 21 300 t con una superficie cosechada de 48 400 hectáreas. Asimismo, la producción mundial de este rubro se ubicó en el año 2010 en 4 230 790 t (FAOSTAT, 2012).
Uno de los principales problemas que presenta este cultivo es la alta variabilidad observada en las plantaciones obtenidas por semillas como consecuencia de un sistema de autoincompatibilidad que afecta algunos aspectos relacionados con el rendimiento y la calidad del grano. Esto ha llevado a considerar la propagación asexual (estacas e injertos) como una vía para mantener la uniformidad de los materiales vegetales. No obstante, estos métodos no han resultado ser los más eficientes debido al dimorfismo vegetativo presente en la planta Li et al., 1998).
El cultivo de tejidos pudiera representar una alternativa ante esta problemática. La embriogénesis somática se ha utilizado en la propagación de plantas de cacao pero se ha logrado la formación de embriones somáticos sólo para algunos genotipos a partir de diferentes tipos de explantes como son: pétalos, estaminodios y cotiledones (Maximova et al., 2002).
Considerando lo anterior, el uso de la embriogénesis somática como vía de propagación pudiera ser una herramienta para los investigadores de Venezuela que buscan el desarrollo de cultivares de mejor calidad y mayor resistencia a condiciones ambientales adversas. También representaría una respuesta a la necesidad de los productores que poseen plantaciones con alto número de árboles de avanzada edad y baja producción. Por tanto, el presente trabajo tuvo como objetivo formar embriones somáticos en cinco cultivares de cacao que se cultivan en Venezuela.
MATERIALES Y MÉTODOS
La investigación se realizó en la Unidad de Biotecnología Agrícola Vegetal, ubicada en el Campo Experimental del Centro Nacional de Investigaciones Agropecuarias (CENIAP) del Instituto Nacional de Investigaciones Agrícolas (INIA) Maracay-Edo. Aragua.
Material vegetal
Se utilizaron botones florales de 3-5 mm de longitud colectados en horas de la mañana de cuatro cultivares de cacao tipo criollo perteneciente a la Colección 45: `Ocumare 61' (`OC-61'), `Ocumare-77' (`OC-77') y `Choroní-41' (CHO-41'). Asimismo, se seleccionaron dos cultivares que no pertenecen a esta colección pero que tienen importancia por su resistencia a la enfermedad Escoba de Bruja: 'PORCELANA' (`PORC') (Criollo) y `Scabina-6' (`SCA-6') (Amazónico).
Desinfección y extracción del explante
Los botones florales de los cultivares seleccionados, fueron colocados en frascos de vidrio con agua destilada estéril (ADE) fría y posteriormente fueron transportados al laboratorio en una cava pequeña. Una vez en el laboratorio y luego del tratamiento a 5ºC, se desinfectaron con una solución de etanol al 70% por 5 minutos, seguido de una solución de hipoclorito de sodio al 1% i.a. por 10 minutos con agitación constante. El hipoclorito fue eliminado con tres (3) lavados con agua destilada estéril cada 5 minutos.
Formación de callos con estructuras embriogénicas
Se utilizó el procedimiento desarrollado por Li et al. (1998) para embriogénesis somática en cacao, el cual se encuentra descrito en el protocolo de cultivo de tejidos de cacao publicado por The Pennsylvania State University (2003). Como parte del estudio se evaluaron el efecto del tipo de explante y el tiempo de subcultivo.
En una primera etapa, los estaminodios y pétalos extraídos de los botones florales fueron establecidos en el medio de cultivo PCG-DKW (Driver y Kuniyuki, 1984) para la formación de callos, con 5 x 10-3 mg l-1 de Thidiazuron (TDZ) y 2 mg l-1de ácido 2,4-diclorofenoxiacético (2,4-D). También se adicionaron al medio de cultivo 20 g l-1 de glucosa, 250 mg l-1 de glutamina, 100 mg l-1 de mio-inositol, 2 mg l-1 de tiamina-HCl, 1 mg l-1 de ácido nicotínico, 2 mg l-1 de glicina y 2 g l-1 de Phytagel. Finalmente, el pH del medio de cultivo se ajustó a 5.8 con una solución de NaOH 1N. El medio de cultivo se distribuyó en placas de Petri a razón de 20 ml. Se colocaron 10 explantes por placa de Petri y se mantuvieron en cámara de crecimiento a 25ºC en condiciones de oscuridad.
Los callos formados fueron transferidos al medio de cultivo SCG-1, compuesto por las sales de McCown, con la misma concentración de 2,4-D, 0.05 mg l-1 de 6-Bencilaminopurina (6-BAP) y 2.2 g l-1 de Phytagel. El pH se ajustó a 5.7 con una solución de NaOH 1N y las condiciones de cultivo fueron las mismas mencionadas anteriormente.
Se estableció un Diseño Completamente Aleatorizado con arreglo factorial, el cual constó de 30 tratamientos y tres repeticiones, donde los tratamientos están dados por los factores siguientes: cinco cultivares (`OC-61', `OC-77', `CHO-41', `PORC' y `SCA-6'), dos tipos de explante (pétalos y estaminodios) y tres tiempos de subcultivo (cada 14, 28 y 42 días). Se colocaron en una misma cápsula de Petri los dos tipos de explantes provenientes de un botón floral. Los cinco pétalos (submuestras) en la cápsula de Petri se correspondieron con una unidad experimental. Asimismo, los cinco estaminodios (subunidades) conformaron una unidad experimental.
Al final de cada subcultivo, mediante la metodología propuesta por Chatanásig (2004), se describieron las características de los callos (consistencia y coloración) y se calculó el Índice de Desarrollo de Callo (IC) mediante siguiente expresión:
IC = Ó (Estado x Nº de explantes en ese estado)
Según Chatanásig (2004), el estado es el resultado de las observaciones visuales realizadas durante la investigación lo cual permitió la determinación de ocho estados de desarrollo del callo sobre los explantes. Es así, como los primeros cuatro estados fueron determinados por la cantidad de callo que cubría el explante y se asignaron valores que van del 0 al 3 por lo que el IC puede tener valores comprendidos entre 0 y 15 cuando los explantes se encuentran en el medio de cultivo PCG-DKW. A continuación se muestran los diferentes estados:
E1: Ausencia
de callo (0)
E2: Inicio de pequeñas formaciones de callo (1)
E3: El callo cubre casi totalmente el explante (2)
E4: El callo cubre completamente el explante (3)
Para el crecimiento del callo en el medio de cultivo SCG-2, Chatanásig (2004), también estableció cuatro estados con valores que van del 4 al 7, por lo que el IC puede tener valores comprendidos entre 20 y 35 considerando un número de cinco explantes por cápsula.
E4a: callos
< 2 mm (4)
E4b: callos de 2-4 mm (5)
E4c: callos de 4-6 mm (6)
E4d: callos >6 mm (7)
Formación de embriones somáticos
Las masas proembriogénicas se transfirieron a un medio de cultivo constituido por las sales de DKW (Driver y Kuniyuki, 1984) más 30 g l-1 de sacarosa, 1 g l-1 de glucosa, 100 mg l-1 de mio-inositol, 2 mg l-1 de tiamina-HCl, 1 mg l-1 de ácido nicotínico, 2 mg l-1 de glicina y 2 g l-1 de Phytagel. Los subcultivos se realizaron en este mismo medio de cultivo considerando los tiempos de subcultivo mencionados anteriormente (cada 14, 28 y 42 días) hasta la aparición de embriones somáticos.
Al final de cada subcultivo se cuantificó el número de embriones somáticos por explante y se calculó la frecuencia de embriones somáticos por cultivar a través de la siguiente expresión:

Análisis estadístico
Luego de la comprobación de los supuestos de normalidad y homogeneidad de varianza, se realizó un análisis de la varianza factorial 5x2 con tres repeticiones para evaluar el efecto de los factores involucrados (cultivar y tipo de explante) sobre el índice de formación de callo (IC). El análisis de varianza fue aplicado en tres tiempos de muestreo. En el caso de los ANAVAR donde se observó un efecto de los factores, se realizaron pruebas de medias a posteriori de Tuckey (p = 0.05) para comparar las medias de IC que fueron estadísticamente significativas. Asimismo, se realizó una prueba de Ji-Cuadrado para la frecuencia embriogénica y el número de embriones somáticos debido a que no se cumplieron los supuestos de normalidad y homogeneidad de la varianza. Para ambos análisis se utilizó el software estadístico InfoStat versión 2014.
RESULTADOS Y DISCUSIÓN
Formación de callos con estructuras embriogénicas
Durante los primeros 14 días, en el medio de cultivo PCG-DKW, se observó un incremento en el tamaño y volumen de los estaminodios y los pétalos en todos los cultivares, lo cual dio lugar a la formación de callos. Sin embargo, en algunos casos se observó necrosis de los explantes y no se formaron.
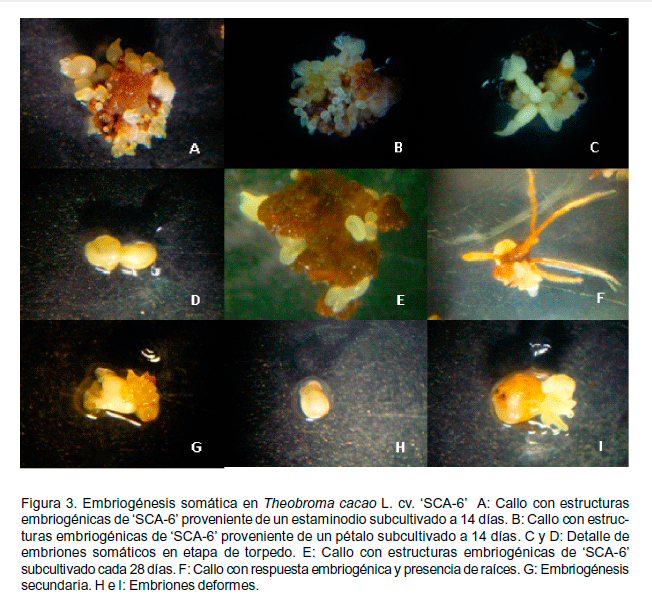
En los estaminodios provenientes de los diferentes cultivares, los callos formados se caracterizaron por presentar una coloración amarillo crema y consistencia compacta. Por otra parte, en los pétalos, se observó la presencia de callos de apariencia y consistencia más friable y con la misma coloración amarillo crema (Figura 1).
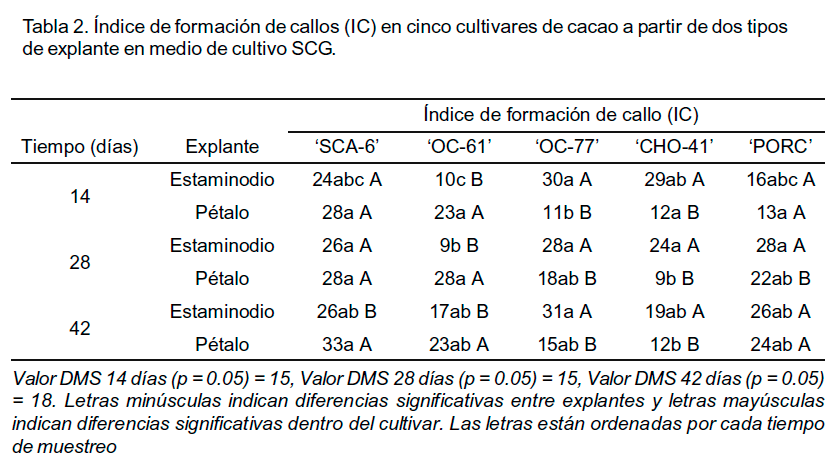
En la evaluación realizada a los 14 días de cultivo, se observaron diferencias significativas (p<0.05) en el IC entre los dos tipos de explantes. Estas se deben a que el estaminodio mostró una tendencia a formar mayor cantidad de callo que el pétalo, lo cual se vio reflejado en el IC de este explante con los diferentes tiempos de subcultivo (Tabla 1). Dicho resultado coincide con lo informado por Chanatásig (2004), quien también observó a los 14 días de cultivo un mayor IC en los estaminodios en comparación con los pétalos en tres cultivares de cacao (`SCA-6', `PA-169' y `UF-273') provenientes del programa de mejoramiento genético del CATIE.
Asimismo, la interacción entre el cultivar y el tipo de explante mostró diferencias significativas (p<0.05) a los 14, 28 y 42 días de cultivo. Los mayores IC se observaron en los estaminodios de los cultivares `SCA-6', `OC-77' y `PORC' a los 28 y 42 días, con valores comprendidos entre 10 y 8. No obstante, el mayor IC de callo en los estaminodios se observó a los 14 días de cultivo en el cultivar `OC-77'.
Es importante destacar, que el cultivar es el factor que explicó la mayor variabilidad observada en los valores del IC para cada uno de los tiempos de subcultivo y tipos de explante inicial. Sin embargo, en `OC-77' se observó una influencia del tipo de explante en la respuesta callogénica y, por ende, en el IC.

Lo anterior lleva a afirmar que un aspecto importante en la embriogénesis somática en el cultivo de cacao es la respuesta de los explantes florales a la callogénesis en la cual se pueden observar resultados diferentes de acuerdo con la concentración de reguladores de crecimiento, el tipo de explante y el cultivar que se esté evaluando. Así lo mencionan Li et al. (1998) y Buah (2010), quienes evaluaron el efecto de diferentes concentraciones de TDZ sobre el incremento de la masa fresca y el porcentaje de respuesta de los estaminodios en el medio de cultivo para la inducción de callos.
Cuando los explantes fueron transferidos al medio de cultivo SCG, se observó crecimiento en el callo que los cubrió totalmente, por ello el IC se calculó considerando el tamaño del callo. Durante la permanencia de los explantes en este medio de cultivo se observó la presencia de estructuras similares a embriones somáticos en etapa globular en la superficie del callo; aunque no llegaron a desarrollarse como tal. Lo anterior fue mencionado también por Li et al. (1998), quienes observaron estas estructuras al final del período de subcultivo en el medio de cultivo SCG (Figura 2).
Asimismo, en la tabla 2 se muestran los IC para cada uno de los tratamientos y en el que también se observaron diferencias significativas (P<0.05) entre los cultivares. Este fue el principal factor que explicó la variabilidad en los valores de IC para el crecimiento.
Se
destacaron también las diferencias significativas entre los dos tipos de
explante con un mayor IC en los estaminodios en comparación con los
pétalos en los cultivares `OC-77' y `CHO-
41'. Sin embargo, en `SCA-6', `OC-61' y `PORC' se observaron valores altos de
IC a los 14, 28 y 42 días de cultivo en los pétalos. El mayor IC
se observó en los pétalos de `SCA-6' a los 42 días de
cultivo (IC = 32.67). Es importante señalar, que no se constataron diferencias
significativas entre los tipos de explantes en el cultivar `SCA-6' a los 14 y
28 días de cultivo lo cual, puede deberse a que al final del subcultivo
los callos detenían su crecimiento y comenzaban a necrosarse. A partir
de la respuesta de este cultivar durante esta fase del cultivo, pudiera
recomendarse el uso de cualquiera de los dos explantes para la formación
de callos.
Tal como se ha mencionado anteriormente, durante el proceso de callogénesis en el cultivo de cacao el cultivar fue el factor que determinó la respuesta del explante a las condiciones de cultivo, lo cual ha sido documentado por Buah (2010) quien hace referencia al efecto del cultivar sobre la masa fresca y la frecuencia de formación callo cuando el explante fue sometido a diferentes concentraciones de TDZ.
Formación de embriones somáticos
Cuando los explantes con callo fueron transferidos al medio de cultivo para la formación de embriones, se observó en el cultivar `SCA-6' una necrosis no sincronizada que se mantuvo durante todo el subcultivo. En el caso de los estaminodios, éstos no experimentaron esta necrosis y, por el contrario, continuaron su crecimiento y conservaron su coloración amarillo crema. Lo anterior ocurrió con el resto de los cultivares; pero sin la formación de embriones somáticos.
Cuando se realizó el segundo subcultivo de los explantes en el medio de cultivo para la formación de embriones, se observó la presencia de éstos en los pétalos y estaminodios del cultivar `SCA-6' en diferentes etapas de desarrollo: globular, corazón y torpedo (Figura 3A, 3B, 3C y 3D). Esta respuesta se vio disminuida, en cuanto al número total de embriones, a medida que se incrementó el tiempo de subcultivo (Figura 3E y Tabla 3). Además de la respuesta embriogénica por parte de los explantes, también se observó en algunos callos la presencia de raíces; así como embriones cuyas partes radical y apical no se desarrollaron normalmente y embriones fusionados (Figuras 3F, 3G, 3H, y 3I). Se destaca la ocurrencia de embriogénesis secundaria en uno de los embriones somáticos primarios, la cual pudiera ser utilizada para su multiplicación (Figura 3G).
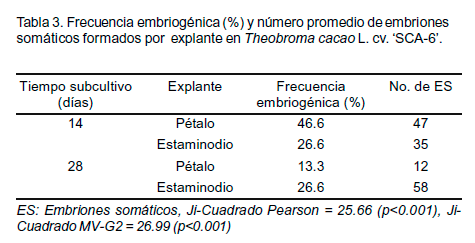
La frecuencia embriogénica y el número total de embriones somáticos en el cultivar `SCA-6' a los 14 y 28 días de cultivo mostraron diferencias significativas (P<0.05) entre los tipos de explante (Tabla 3). Se puede apreciar cómo la frecuencia fue disminuyendo a medida que se incrementaron los días de subcultivo lo cual, puede deberse a una pérdida de la capacidad embriogénica del explante. La mayor frecuencia embriogénica se observó en el pétalo cuando fue subcultivado cada 14 días y el número total de embriones somáticos fue de 47. No obstante, a los 28 días de cultivo se apreció un mayor número de embriones somáticos en los estaminodios (58) con una menor frecuencia (26.6%).
Asimismo, la frecuencia embriogénica para el pétalo fue menor cuando estos fueron subcultivados cada 28 días en los diferentes medios de cultivo (13.3%) con un número total de embriones de 12. Para el tiempo de subcultivo de 42 días, no se observó respuesta embriogénica ni organogénica, pues los callos obtenidos de los dos tipos de explantes mostraron una necrosis generalizada.
CONCLUSIONES
El
índice de callo (IC) permitió determinar niveles de respuesta
durante el proceso de callogénesis in vitro en los diferentes
cultivares y tipos de explante inicial. Todos los cultivares mostraron
respuesta a las condiciones de cultivo pero fue variable de acuerdo con cada
uno de los tratamientos.
Asimismo, la frecuencia embriogénica para el pétalo fue menor
cuando estos fueron subcultivados cada 28 días en los diferentes medios
de cultivo (13.3%) con un número total de embriones de 12. Para el
tiempo de subcultivo de 42 días, no se observó respuesta embriogénica
ni organogénica, pues los callos obtenidos de los dos tipos de explantes
mostraron una necrosis generalizada.
Ello evidenció que el proceso de formación de callo está influenciado por el cultivar y el tipo de explante.
Se logró formar embriones somáticos de cacao a partir de pétalos y estaminodios en el cultivar `SCA-6'. La embriogénesis somática en este cultivar fue de alta frecuencia con embriones en diferentes etapas de desarrollo. La frecuencia embriogénica y el número promedio de embriones somáticos fue menor a medida que se prolongó el tiempo de subcultivo.
AGRADECIMIENTOS
Los autores agradecen al Ing. Carlos Marin del INIA-CENIAP por la revisión de los datos y los análisis estadísticos.
REFERENCIAS
Buah J (2010) Callus induction and somatic embryogenesis in five cacao (Theobroma cacao L.) genotypes in Ghana. Biotechnology 9(3): 355-361
Chatanásig
C (2004) Inducción de la embriogénesis somática en clones
superiores de cacao (Theobroma cacao L.) con resistencia a enfermedades
fungosas. Tesis de Maestría de la Escuela de Postgrado del Programa de
Educación para el Desarrollo y la Conservación del CATIE. 86p.
Driver, J, Kuniyuki A (1984) In vitro propagation Paradox walnut rootstock. HortScience 19(5): 507-509
FAOSTAT (2012) Theobroma cacao L. Cacao (Cocoa).[En línea] En: http://www.fao.org/ag/AGA/AGAP/FRG/afris/es/Data/521.HTM. Consultado el 24 de febrero de 2012
Li Z, Traore A, Maximova S, Guiltinan M (1998) Somatic
embryogenesis and plant regeneration from floral explants of cacao (Theobroma
cacao L.) using Thidiazuron. In Vitro Cell. Dev. Biol. Plant 34:
293-299
Maximova S, Alemanno L, Young A, Ferriere N, Traore A,
Guiltinan M (2002) Efficiency, genotypic variability, and cellular origin of
primary secondary somatic embryogenesis of Theobroma cacao L. In
Vitro Cell. Dev. Biol. Plant 38: 252-259
Motamayor J, Risterucci A, López P,
Ortíz C, Moreno A, Lanaud C (2002) Cacao domestication I: The origin of
the cacao cultivated by the Mayas. Heredity 89: 380-386
The Pennsilvania state University (2003) Cacao tisue
cultura protocol book (version 1.4). USDA. Harrisburg
Traore A, (2006) Effects of carbon source and explant
type on somatic embryogenesis of four cacao (Theobroma cacao L.)
genotypes. HortScience 41 (3): 753-7
Recibido: 16-1-2014
Aceptado: 13-10-2014 [/article]
Copyright (c) 2016 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.