Artículo original
Biotecnología Vegetal Vol. 19, No. 1: 43 - 51, enero - marzo, 2019
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Conservación in vitro de cultivares de Ipomoea batatas (L.) Lam por crecimiento mínimo con el uso de manitol
In vitro conservation of Ipomoea batatas (L.) Lam cultivars by minimum growth with the use of mannitol
Aymé Rayas Cabrera*, Jorge López Torres, Víctor R Medero Vega, Milagros Basail Pérez, Arletys Santos Pino, Yenisey Gutiérrez Sánchez
Instituto de Investigaciones de Viandas Tropicales. Apdo 6. Santo Domingo. Villa Clara. Cuba. CP 53 000.
*Autor para correspondencia e-mail: conserv.biotec@inivit.cu
RESUMEN
La conservación in vitro de Ipomoea batatas (L.) Lam permite el intercambio de germoplasma y su disponibilidad para programas de mejoramiento genético. El objetivo de este trabajo fue determinar el efecto de manitol y ácido abscísico en la conservación mediante crecimiento mínimo de cultivares de I. batatas del Banco de Germoplasma del INIVIT. Los tratamientos incluyeron ácido abscísico (ABA)(5 y 10 mg l-1) y manitol (1.0, 1.5 y 2.0%) en un medio de cultivo MS basal, la combinación de ABA (10 mg l-1) y manitol (1.0, 1.5 y 2.0%). Como controles se emplearon el medio de cultivo MS basal y MS con sorbitol (1.0%) y glucosa (1.0%). En los cultivares ‘Cautillo’ e ‘INIVIT BS 16-2006’ se obtuvieron los mejores resultados de supervivencia, disminución del crecimiento y hojas verdes pero pequeñas en los tratamientos que contenían el medio de cultivo basal con manitol (10, 15 y 20%). En los medios de cultivo con ácido abscísico no se logró crecimiento de los explantes. El medio de cultivo MS con 2 mg l-1 de tiamina, 100 mg l-1 de mio-inositol y 1.0% de manitol, posibilita la conservación in vitro de cultivares de boniato entre seis y ocho meses
Palabras clave: agente osmótico, boniato, germoplasma, medio de cultivo
ABSTRACT
In vitro conservation of Ipomoea batatas (L.) Lam allows the exchange of germplasm and its availability for breeding programs. The objective of this work was to determine the effect of mannitol and abscisic acid in the conservation through minimum growth of I. batatas cultivars from INIVIT Germplasm Bank. Treatments included abscisic acid (ABA) (5 and 10 mg l-1) and mannitol (1.0, 1.5 and 2.0%) in a basal MS culture medium, the combination of ABA (10 mg l-1) and mannitol (1.0 , 1.5 and 2.0%). As controls were used the MS basal culture medium and MS with sorbitol (1.0%) and glucose (1.0%). In the cultivars 'Cautillo' and 'INIVIT BS 16-2006' the best results of survival, growth decrease and green but small leaves were obtained in the treatments that contained the basal culture medium with mannitol (10, 15 and 20%) . Growth of the explants was not achieved in culture media with abscisic acid. The MS culture medium with 2 mg l-1 of thiamine, 100 mg l-1 of myo-inositol and 1.0% of mannitol, allows the in vitro conservation of sweet potato cultivars between six and eight months.
Keywords: osmotic agent, sweet potato, germplasm, culture medium
INTRODUCCIÓN
Ipomoea batatas (L.) Lam (boniato) es una planta dicotiledónea que pertenece a la familia Convolvulaceae. Se propaga principalmente de forma vegetativa por esquejes o brotes enraizados (Dugassa y Feyissa, 2011).
Ha sido tradicionalmente visto como un "cultivo de personas pobres" o "cultivo huérfano", y ha atraído una atención limitada en comparación con otros cultivos básicos. Sin embargo, durante la última década, esta percepción ha cambiado, por su alto valor nutricional, rica en carbohidratos, almidón, minerales y vitaminas (Dinu y Soare, 2015) y es ampliamente reconocido que tiene un gran potencial para contribuir al alivio de la desnutrición y el hambre en el mundo en desarrollo (Mwanga et al., 2017). Según FAOSTAT (2016), es el séptimo cultivo en términos de producción a nivel mundial y el cuarto lugar entre los cultivos alimentarios.
En lo referente a las condiciones agroecológicas, I. batatas como especie cultivada y silvestre posee una amplia variabilidad genética que se expresa en la adaptación a condiciones ambientales diversas. Adicionalmente, su manejo agronómico resulta más económico que el de otros cultivos, en términos de menores requerimientos de fertilizantes y plaguicidas (Tique et al., 2009).
Debido al enorme interés comercial en I. batatas, se necesita la conservación del germoplasma de esta especie. La diversidad contenida en un germoplasma debe estar protegida contra las pérdidas. La base de todo mejoramiento genético radica en la diversidad genética, que se refleja en la creación de plantas con resistencia / tolerancia a diversos factores bióticos y abióticos, para asegurar una mayor productividad (Arrigoni-Blank et al., 2014).
Varios autores han establecido métodos para la propagación in vitro de I. batatas y es posible obtener plantas libres de patógenos a partir del cultivo de meristemos y luego multiplicar masivamente estas plantas mediante las técnicas de micropropagación (Salinas, 1990; González et al., 2003; Silva et al., 2003) y la conservación del material vegetal (Jarret et al., 1991; Sigueñas, 1997; Rayas et al., 2016). Estudios realizados han demostrado que las sales minerales y la sacarosa son componentes esenciales para el crecimiento y la supervivencia de plantas de I. batatas in vitro y no deben ser suprimidas en el medio de cultivo de crecimiento (Vettorazzi et al., 2017). Atendiendo a esto, los métodos de conservación deben preservar dichos componentes en el medio de cultivo.
La conservación de los recursos fitogenéticos garantiza su posible utilización como fuente de variación genética potencialmente útil, a la vez que evita la pérdida de diversidad genética en la agricultura, con la consiguiente reducción del material vegetal disponible para el uso de las generaciones presentes y futuras. En el cultivo de I. batatas se desarrollan varios programas que posibilitan la obtención de nuevos cultivares con el objetivo de mejorar la calidad nutricional de esta raíz tuberosa (Morales-Tejón et al., 2016). Así, mediante la vía del policruzamiento de variedades conservadas en el Banco de Germoplasma del INIVIT, Morales-Tejón et al. (2017) obtuvieron las progenies que, en un periodo de seis años de evaluación y selección, dieron origen al primer cultivar cubano de boniato de masa totalmente morada y características agronómicas deseables denominado ‘INIVIT BM-90’, con alto contenido de antocianinas.
El incremento en el número de entradas mantenidas en los bancos de germoplasma impulsa la implementación de técnicas más eficientes para la conservación a mediano y largo plazo. De esta forma, se asegura la disponibilidad de variabilidad genética de las especies y la preservación de la biodiversidad vegetal (Rivero, 2007; Parrado et al., 2013; Monteros-Altamirano et al., 2018). En este proceso se abre el camino a las posibilidades para el desarrollo y evolución de diversas especies. La conservación in vitro se ha perfilado como una alternativa valiosa para la combinación de técnicas de almacenamiento en lugar de depender de una sola.
La conservación in vitro libera las plantas de los riesgos que se producen en el campo, reduce los costos, asegura el mantenimiento de la fidelidad genética y facilita el intercambio de germoplasma. El objetivo de esta práctica es maximizar el período de subcultivo o extenderlo indefinidamente. Para lograrlo, se realizan cambios en el entorno de cultivo (Roca et al., 1994; Arrigoni-Blank et al., 2014).
I. batatas es susceptible a un gran número de enfermedades causadas por hongos, virus y nematodos. También es vulnerable a plagas como insectos y ácaros; por lo tanto, el banco de germoplasma activo en el campo es sensible a la pérdida y, por ende, requiere de conservación in vitro (Arrigoni-Blank et al., 2014).
En el cultivo de I. batatas se han realizado investigaciones para la conservación in vitro del germoplasma (Pennycooke y Towill, 2000; Espinosa et al., 2002; Espinosa et al., 2003; Rayas et al., 2016). Sin embargo, no siempre se consigue disminuir el crecimiento, se obtienen resultados variables unido a que varios autores han referido que la respuesta a la conservación depende del genotipo (Silva et al., 2002; Dugassa y Feyissa, 2011; Arrigoni-Blank et al., 2014). Por ello el objetivo del presente trabajo fue determinar el efecto de manitol y ácido abscísico en la conservación mediante crecimiento mínimo a mediano plazo de cultivares del Banco de germoplasma de I. batatas en el INIVIT.
MATERIALES Y MÉTODOS
La presente investigación se desarrolló en el Laboratorio de Biotecnología Vegetal del Instituto de Investigaciones en Viandas Tropicales (INIVIT), durante el período comprendido de abril de 2016 a marzo del 2017.
Para desarrollar el trabajo se utilizaron los cultivares de boniato ‘Cautillo’ (que se caracteriza por lento crecimiento in vitro) e ‘INIVIT BS – 16 – 2006’ (Cultivar de rápido crecimiento in vitro).
Para el establecimiento in vitro se utilizaron como explantes, meristemos de uno o dos primordios foliares (0.2 – 0.3 mm), procedentes de tubérculos previamente diagnosticados por la técnica de Inmunoensayo Ligado a Enzima a partir del kit Antigen Coated Plate ELISA para el prupo de potivirus (Virus del moteado del boniato, Virus latente del boniato y Virus de moteado suave del boniato), según el procedimiento descrito por Rayas et al. (2016). Se empleó un medio de cultivo que contenía las sales MS (Murashige y Skoog, 1962), tiamina (2.0 mg l-1), 6-bencil aminopurina (6-BAP) (0.3 mg l-1), ácido naftalenacético (ANA) (0.03 mg l-1) y 50.0 g l-1 de sacarosa.
Los explantes fueron incubados a 27 °C y régimen de 16 horas de luz (DFFF de 62-68 µmol m-2s-1) y ocho de oscuridad, durante 35 días.
Posteriormente, se multiplicaron in vitro los cultivares objeto de estudio según metodología descrita por Love et al. (1989), hasta disponer de la cantidad de material vegetal necesario para utilizar como explantes segmentos nodales de plantas in vitro de aproximadamente 2.0 cm de longitud.
Para seleccionar el medio de cultivo de crecimiento mínimo que permitiera la conservación in vitro de I. batatas, se utilizó como medio de cultivo basal (MB) las sales propuestas por Murashige y Skoog (1962) (MS), 100 mg l-1 de mio-inositol, 1 mg l-1 de tiamina y 30 g l-1 de sacarosa. El medio de cultivo basal se combinó con ácido abscísico (ABA) y manitol y se conformaron los siguientes tratamientos:
M0. MB.
M1. MB + ácido abscísico (5 mg l-1)
M2. MB + ácido abscísico (10 mg l-1)
M3. MB + manitol (1.0%)
M4. MB + manitol (1.5%)
M5. MB + manitol (2.0%)
M6. MB + ácido abscísico (10 mg l-1) + manitol (1.0%)
M7. MB + ácido abscísico (10 mg l-1) + manitol (1.5%)
M8. MB + ácido Abscísico (10 mg l-1) + manitol (2.0%)
M9. MB + sorbitol (1.0%) + glucosa (1.0%). (Control)
Todos los medios de cultivo se solidificaron con 4.7 g l-1 de agar E (Biocen) y el pH se ajustó a 5.7 antes de la esterilización en autoclave.
Se utilizaron como controles el tratamiento M0 que contenía solo el medio de cultivo basal y el tratamiento M9, medio de cultivo recomendado por Rayas et al. (2016) por los resultados obtenidos en el cv. ‘Cautillo’.
Se emplearon 30 tubos de ensayo (150 x 25 mm) con 10 ml de medio de cultivo y un explante por tubo y se evaluaron 20 explantes al azar.
Se evaluó a los seis y ocho meses mediante observación visual la supervivencia de los explantes (cálculo de porcentaje a partir del número de explantes vivos), se midió la altura de la plántula (cm), con la ayuda de una regla graduada y se cuantificó el número de hojas activas (hojas verdes).
Una vez seleccionado el medio de cultivo con mejores resultados en la conservación, este se determinó su efecto en 12 cultivares cubanos de boniato, procedentes de la colección de germoplasma de boniato del INIVIT. A los seis meses se evaluó la supervivencia (%), se midió la altura de la planta (cm) y se cuantificó el número de hojas activas y el número de brotes por planta.
Análisis estadístico
Para el procesamiento de los datos se empleó el paquete estadístico SPSS ver. 15.0 para Windows. Puesto que se encontró normalidad y homogeneidad de varianzas, con un nivel de significación de p<0.05, los datos se procesaron mediante análisis de varianza de clasificación simple (completamente al azar) y la comparación múltiple de medias se realizó según la prueba de Tukey.
Para evaluar la influencia del medio de cultivo de crecimiento mínimo en diferentes cultivares se realizó la comparación de medias mediante la prueba de Bonferroni por tener diferentes números de réplicas por cultivar.
RESULTADOS Y DISCUSIÓN
En la conservación in vitro se apreció que en el cv. ‘INIVIT BS – 16 – 2006’ después de seis meses de conservación el mayor porcentaje de supervivencia se observó en los medios de cultivo que contenían manitol (M3, M4, M5). Estos fueron los únicos que a los ocho meses mostraban supervivencia de los explantes superior al 80%. En el cv. ‘Cautillo’ también a los seis meses la supervivencia fue superior en los medios de cultivo con manitol (Tabla 1) (Figura 1).
Se comprobó que el ABA afectó la supervivencia de los explantes. En los medios de cultivo donde se adicionó solo (M2 y M3) se observaron bajos porcentajes de supervivencia de los explantes, los que no lograron superar el 54% a los seis meses y murieron antes de los ocho meses en ambos cultivares. De igual forma, cuando se combinó con manitol no se obtuvieron buenos resultados.

Tabla 1. Supervivencia de explantes de I. batatas cv. ‘INIVIT BS – 16 – 2006’ y ‘Cautillo’ a los seis y ocho meses de conservación in vitro en medios de cultivo de crecimiento mínimo.

Figura 1. Plantas de Ipomoea batatas cv. ‘Cautillo’ (A) e ‘INIVIT BS – 16 – 2006’ (B) a los ocho meses de conservadas in vitro en medios de cultivo de crecimiento mínimo. M0. Medio de cultivo basal, M3. Medio de cultivo con 1.0% de manitol, M4. Medio de cultivo con 1.5% de manitol, M5. Medio de cultivo con 2.0% de manitol.
Contrario a los resultados en esta investigación, Espinosa et al. (2003) conservaron cuatro cultivares de boniato durante un año en medio de cultivo con 10.0 mg l-1 de ABA con altos porcentajes de supervivencia (≥ 85.5%) y recuperación (≥ 97.5%), entre los que se encontraba el cv. ‘Cautillo’. Sin embargo, Arrigoni-Blank et al. (2014), quienes estudiaron el efecto de concentraciones de ABA en varios cultivares de boniato concluyeron que podrían conservarse durante 180 días con 2.0 mg l-1 de ABA, con una mediana supervivencia (78%). Estos autores sugirieron que este regulador afectaba negativamente la supervivencia de los explantes, lo cual coincide con los resultados de este trabajo donde se emplearon concentraciones superiores. Además, apuntaron que las diferentes respuestas morfogénicas durante la conservación in vitro del boniato podían estar relacionadas con el genotipo debido a que usaron varios cultivares en sus ensayos. Además, las características del material vegetal con se trabaje, el tamaño del explante inicial y las condiciones ambientales de conservación también pueden influir lo cual explicaría las diferencias entre los porcentajes de supervivencia del cultivar ‘Cautillo’ de este trabajo con respecto a los informados por Espinosa et al. (2003) y Rayas et al. (2016).
En cuanto al efecto del manitol se conoce que la limitación del crecimiento por efecto de la concentración del agente osmótico se debe a la reducción de la adsorción de agua y nutrientes del medio de cultivo (García-Águila et al., 2007). Sin embargo, las concentraciones empleadas en este trabajo aunque redujeron el crecimiento no afectaron la supervivencia de las plantas de los dos cultivares aun a los ocho meses de conservadas. Resultados contrarios obtuvieron Díaz et al. (2015) en la conservación in vitro de Dioscorea spp. por crecimiento mínimo con este agente osmótico.
En ambos cultivares se observó que en los medios de cultivo con ABA las plantas no crecieron (0.6 cm) y a los ocho meses ya habían muerto, mientras que, en los medios de cultivo con manitol, sin ABA (M3, M4 y M5) aunque se apreció una reducción en la altura de la planta se mantenían vivas aun después de los ocho meses (Tabla 2).
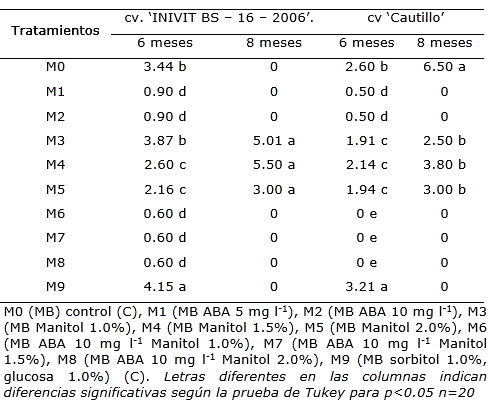
Tabla 2. Efecto del medio de cultivo sobre la altura (cm) de los explantes en medios de cultivo de crecimiento mínimo a los seis y ocho meses en los cv. ‘INIVIT BS – 16 – 2006’ y ‘Cautillo’.
Los resultados coinciden con informes de otros autores que han referido el uso de manitol para la conservación in vitro de plantas. Al respecto, Fortes y Scherwinski-Pereira (2001) observaron que este agente osmótico produjo una reducción del crecimiento y número de los brotes en papa (Solanum tuberosum, L.) en comparación con la sacarosa. Sin embargo, Borgeset al. (2009) al estudiar el efecto del manitol en el crecimiento mínimo del ñame (Dioscorea alata L.) concluyeron que al utilizar concentraciones superiores a 1.5% se afectaba de manera significativa la supervivencia del material vegetal. Por otra parte, Lata et al. (2010) informaron que de 2 a 4% de manitol no es adecuado para la conservación in vitro de la planta medicinal Podophyllum peltatum L.
Otro de los efectos negativos de ABA se relacionó con la no formación de hojas en las plantas crecidas en los medios de cultivo que lo contenían. Sin embargo, en presencia de manitol se formaron hojas pequeñas que se mantuvieron verdes por tiempos prolongados (Tabla 3).
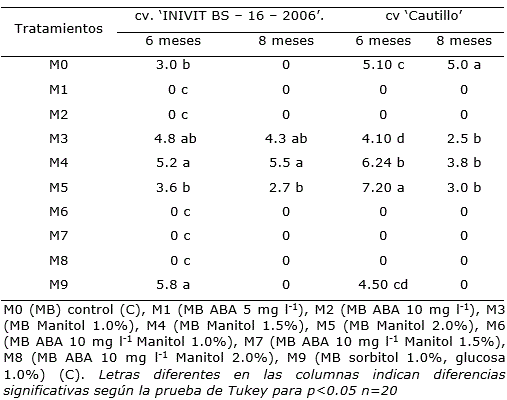
Tabla 3. Efecto del medio de cultivo sobre el número de hojas de explantes de Ipomoea batatas cv. ‘INIVIT BS – 16 – 2006’ y ‘Cautillo’ conservados durante seis y ocho meses en medios de cultivo de crecimiento mínimo.
Atendiendo a los resultados se seleccionó el medio de cultivo basal que contenía las sales MS, 2 mg l-1 de tiamina, 100 mg l-1 de mio-inositol y además 1.0% de manitol (Tratamiento M3), para la conservación in vitro de 12 cultivares de la colección de germoplasma. Entre estos se observaron diferencias significativas en cuanto a la altura de la planta obtenida in vitro, el número de hojas y el número de brotes formados después de conservados durante seis meses. Los valores de supervivencia fueron superiores al 80%, sin diferencias significativas entre ellos (Tabla 4, Figura 2). Este resultado evidenció el efecto del genotipo y sugiere la necesidad de clasificar los cultivares para formar grupos según sus hábitos de crecimiento, lo que simplificaría las labores al no subcultivar toda la colección in vitro con la misma frecuencia.
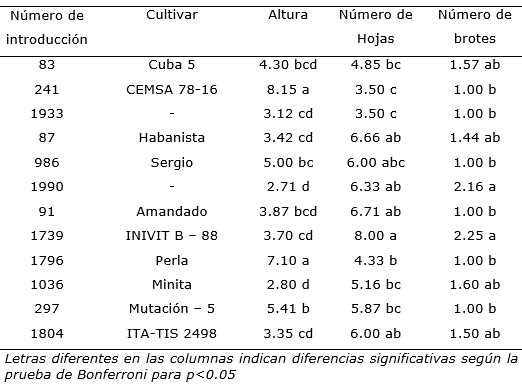
Tabla 4. Respuesta de cultivares de Ipomoea batatas a los seis meses de conservados en el medio de cultivo que contenía 1.0% de manitol.

Figura 2. Aspecto de 12 cultivares de boniato conservados en medio de cultivo para el crecimiento mínimo que contiene 1.0% de manitol.
CONCLUSIONES
El medio de cultivo MS con 2 mg l-1 de tiamina, 100 mg l-1 de mio-inositol y 1.0% de manitol, posibilita la conservación in vitro de cultivares de boniato, entre seis y ocho meses.
Conflicto de interés
Los autores no declaran conflicto de intereses.
REFERENCIAS
Arrigoni-Blank MDF, Tavares FF, Blank AF, Santos MCD, Menezes TSA, Santana ADD (2014) In vitro Conservation of Sweet Potato Genotypes. The Scientific World Journal 2014: 1–7; doi:10.1155/2014/208506
Borges M, Alarcón Y, Malaurie B, Hernández Y, Silva JJ (2009) Conservación in vitro de Dioscorea alata L. clon caraqueño (Dioscoreaceae). Rev Perú Biol 16(2): 203- 208
Díaz LC, Carmona O, Beltrán JD (2015) Optimización de la conservación in vitro de germoplasma de Dioscorea spp. por crecimiento mínimo. Rev colomb biotecnol 17 (1): 32-39; doi:10.15446/rev.colomb.biote.v17n1.50842
Dinu M, Soare R (2015) Researches on the sweet potato (Ipomoea batatas L.) behavior under the soil and climatic conditions of the South-West of Romania. Journal of Horticulture, Forestry and Biotechnology 19(1): 79- 84
Dugassa G, Feyissa T (2011) In vitro production of virus-free sweet potato Ipomoea batatas (L.) Lam by meristem culture and thermotherapy. Ethiop J Sci 34(1): 17–28
Espinosa A, Salas L, González O, Silva JJ (2002) Empleo del ácido abscísico, manitol y la disminución de las sales del medio de cultivo en la conservación in vitro de Ipomoea batatas. Biotecnología Vegetal 2(1): 49-42
Espinosa A, González O, Silva JJ (2003) Conservación in vitro de clones de boniato en condiciones de crecimiento mínimo. Biotecnología Vegetal 3(1): 37-41
FAOSTAT (2016) Statistical database (online) of Food and Agriculture Organization of the United Nations. Available in: http://faostat.fao.org/site/567/default.aspx. Accessed 06/06/2018
Fortes GR, Scherwinski-Pereira JE (2001) Preservação in vitro de batata com ácido acetilsalicílico e duas fontes de carboidrato. Pesquisa Agropecuária Brasileira 36: 1261-1264
García-Águila L, de Feria M, Acosta K (2007) Aspectos básicos de la conservación in vitro de germoplasma vegetal. Biotecnología Vegetal 7(2): 67-79
González OS, Hernández M, Silva JJ, Montes S, López M, Sigarroa A (2003) Establecimiento in vitro de yemas de Ipomoea batatas. Biotecnología vegetal 3(2): 67-75
Jarret R, Salazar S, Fernandez Z (1991) Somatic embriogenesys in Sweet potato. HortScience 19(3): 397-398
Lata H, Moraes RM, Bertoni B, Pereira AMS (2010) In vitro germplasm conservation of Podophyllum peltatum L. under slow growth conditions. In vitro Cellular and Developmental Biology-Plant 46: 22-27; doi: 10.1007/s11627-009-9243-5
Love SL, Rhodes BB, Moyer JW (1989) Meristem-tip culture and virus indexing of sweet potatoes (second edition). International Board for Plant Genetic Resources, Rome
Monteros-Altamirano A, Tacán M, Peña G, Tapia C, Paredes N, Lima L (2018) Guía para el manejo de los recursos fitogenéticos en Ecuador. Protocolos. Publicación miscelánea No. 432. INIAP, Estación Experimental Santa Catalina. Departamento Nacional de Recursos Fitogenéticos, Mejía, Ecuador.
Morales-Tejón A, Morales-Rodríguez A, Rodríguez-del-Sol D (2016) Efectos de la consanguinidad en caracteres de boniato (Ipomoea batatas (L.) Lam.) Rev. Agricultura Tropical 2(1):18-28
Morales-Tejón AL, Rodríguez-de Sol D, Morales-Rodríguez A, Rodríguez-Morales SJ, Masa-Estrada NJ, Lima-Díaz MA (2017) INIVIT BM-90, nuevo cultivar de boniato (Ipomoea batatas (L.) Lam.) con alto contenido de antocianina. Cultivos Tropicales 38(2): pp 80
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum 15:473-497
Mwanga ROM, Andrade MI, Carey EE, Low JW, Yencho GC, Grüneberg WJ (2017) Sweetpotato (Ipomoea batatas L.). En: Campos H, Caligari PDS (eds). Genetic Improvement of Tropical Crops, pp. 181-218. Springer International Publishing, Dordrech; doi: 10.1007/978-3-319-59819-2_6
Parrado OL, Caballero R, Pérez RA (2013) Recursos genéticos del boniato (Ipomoea batatas (L.) Lam.) en Cuba Especies silvestres. Revista Agrisost 19(1): 1-35
Pennycooke JC, Towill LE (2000) Cryopreservation of shoot tips from in vitro plants of sweet potato (Ipomoea batatas (L) Lam.) by vitrification. Plant Cell Reports 19:733–737
Rayas A, Arce D, Santos A, Basail M, López J, Medero V, Bauta M (2016) Conservación in vitro de boniato (Ipomoea batatas (L) Lam.) cv. ‘Cautillo’. Rev Agricultura Tropical 2(1): 41-51
Rivero MV (2007) Crioconservación de germoplasma de batata (Ipomoea batatas (L) Lam.). Tesis para optar por el título de Licenciado en Biología, Instituto de Nutrición y Tecnología de los Alimentos (INTA), Castelar, Argentina
Roca WM, Escobar R, Mafla G (1994) Conservación de germoplasma de yuca in vitro. Principios y técnicas. CIAT, Cali
Salinas R (1990) Cultivo in vitro de embriones de Camote (Ipomoea batatas Lam.). Tesis de Ingeniero Agrónomo, Universidad Nacional Agraria, Lima, Perú
Sigueñas C (1997) Propagación y Conservación in vitro de dos cultivares de Camote (Ipomoea batatas Lam.). Tesis para optar por el título de Biólogo, Universidad Nacional Agraria de la Molina, Lima, Perú
Silva JJ, Hernández M, López M, Montes S, González OS (2003) Micropropagación in vitro del boniato (Ipomoea batatas (L) Lam.) alternativa para la disponibilidad de material con vista a la producción de alimentos. Alimentaria 343: 83-86
Tique J, Chaves B, Zurita JH (2009) Evaluación agronómica de diez clones promisorios CIP y dos materiales nativos de Ipomoea batatas L.. Agronomía Colombiana 27(2): 151-158
Vettorazzi RG, Silva V, Pombo C, Rodrigues R (2017) Developing an in vitro optimized protocol to sweet potato landraces conservation. Acta Scientiarum. Agronomy Maringá 39(3): 359-367; doi: 10.4025/actasciagron.v39i3.32700
Recibido: 05-09-2018
Aceptado:18-12-2018
Copyright (c) 2019 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
