Artículo original
Biotecnología Vegetal Vol. 19, No. 1: 53 - 63, enero - marzo, 2019
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Micropropagación de plantas de Stevia rebaudiana Bertoni a partir de explantes ex vitro
Micropropagation of Stevia rebaudiana Bertoni plants from ex vitro explants
Dionys González-Hernández1*, Elizabeth Kairuz Hernández-Díaz1,2, Alina Capote1, Anabel Pérez1, Leonardo Rivero1, Borys Chong-Pérez3, Naivy Pérez-Alonso4
1Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54 830.
2Departamento de Biología, Facultad de Ciencias Agropecuarias, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54 830.
3Sociedad de Investigación y Servicios BioTECNOS Ltda. Camino a Pangal km 2,5. San Javier. Linares. Chile. CP 3660000.
4Botanical Solutions SpA. Ave Quilin 3550. Macul. Santiago de Chile. Chile. CP 7810000.
*Autor para correspondencia e-mail: dionys@ibp.co.cu
RESUMEN
Stevia rebaudiana Bertoni es una especie reconocida a nivel mundial por sus propiedades medicinales. El objetivo de este trabajo fue micropropagar plantas de Stevia a partir de explantes ex vitro. Se seleccionaron brotes de plantas de esta especie crecidas en casa de cultivo. En el establecimiento in vitro, se evaluó el efecto del tiempo de desinfección y la concentración de hipoclorito de sodio sobre la supervivencia del explante. Los explantes establecidos se transfirieron a medio de cultivo de multiplicación, donde se determinó el efecto de los reguladores de crecimiento (6-bencilaminopurina y ácido indolacético) y el número de subcultivos, sobre el coeficiente de multiplicación. Luego, se evaluó la respuesta de las plantas en la fase de aclimatización, en comparación con plantas propagadas mediante corte de esquejes. El hipoclorito de sodio al 1% permitió la desinfección de los explantes con una supervivencia de 94.5%, independientemente del tiempo. Los reguladores de crecimiento no modificaron el coeficiente de multiplicación con subcultivos cada 15 días. Es posible emplear diferentes combinaciones de sustrato a base de zeolita y compost durante la aclimatización de las plantas micropropagadas. Estas desarrollaron mayor número de hojas y altura, que las propagadas mediante corte de esquejes.
Palabras clave: aclimatización, esteviósidos, multiplicación, rebaudiósidos, reguladores de crecimiento
ABSTRACT
Stevia rebaudiana Bertoni is a species recognized worldwide for its medicinal properties. The objective of this work was to micropropagate Stevia plants from ex vitro explants. Shoots of plants of this specie growing at greenhouse were selected. In the in vitro establishment, the effect of disinfection time and the concentration of sodium hypochlorite on the survival of the explant were evaluated. The established explants were transferred to the multiplication culture medium, where the effect of the growth regulators (6-benzylaminopurine and indoleacetic acid) and the number of subcultures on the multiplication coefficient were determined. Then, the response of the plants in the acclimatization phase was evaluated, in comparison with plants propagated by cutting. Sodium hypochlorite at 1% allowed the disinfection of the explants with a survival of 94.5%, regardless of the time. The growth regulators did not modify the multiplication coefficient with subcultures every 15 days. It is possible to use different combinations of substrate based on zeolite and compost during the acclimatization of micropropagated plants. These developed a greater number of leaves and height than those propagated by cutting.
Keywords: acclimatization, growth regulators, multiplication procedure, rebaudiosides, steviosides
INTRODUCCIÓN
Stevia rebaudiana es una especie de la familia Asteraceae, nativa de la región tropical de Sudamérica. Su cultivo y consumo se han incrementado, por el alto contenido de edulcorantes naturales no calóricos (esteviósidos y rebaudiósidos) que presenta como metabolitos secundarios. Estos compuestos (glucósidos de esteviol), son de 200-300 veces más dulces que la sacarosa y se consideran la mejor fuente alternativa de azúcar, principalmente para pacientes diabéticos y personas con obesidad (Gantait et al., 2017). Varios autores han enfocado sus estudios en el cultivo in vitro, como método para la propagación masiva de esta especie, debido, principalmente, a que la germinación de las semillas es generalmente pobre y a que su floración está condicionada por un gran descenso en la temperatura media (Shahid-Akba et al., 2014).
Dentro de las técnicas clásicas de cultivo in vitro empleadas en Stevia, se encuentran: la propagación clonal in vitro por cultivo de hojas, de segmentos internodales, de ápices, de callos y el cultivo de anteras. Los protocolos más eficientes y a la vez más extendidos son aquellos que utilizan explantes vegetativos (Gantait et al., 2014). Sin embargo, se refieren algunos problemas que aún no se han podido resolver del todo. Entre estos se mencionan la formación de estructuras callosas en las plántulas micropropagadas y los períodos de subcultivos superiores a tres semanas con bajos coeficientes de multiplicación (Vives et al., 2017). Por ello es necesario continuar desarrollando u optimizando los protocolos de propagación in vitro de esta especie. El presente estudio se realizó con el objetivo de obtener plantas in vitro de Stevia rebaudiana a partir de la micropropagación de ápices de plantas cultivadas ex vitro.
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon brotes de plantas madre de S. rebaudiana, provenientes del Banco de Germoplasma del IBP, cultivadas en condiciones de campo. Estas tenían tres meses de cultivo y se mostraban sanas y vigorosas. A dichas plantas se les realizaba manejo cultural basado en limpieza de malezas y uso de fungicidas (Pande y Gupta, 2013).
Desinfección y establecimiento in vitro de explantes de Stevia rebaudiana
Para el establecimiento in vitro de S. rebaudiana, se seleccionaron plantas con buenas condiciones fisiológicas, coloración y sanidad, con abundantes hojas, entre dos y cuatro tallos y con una altura superior a 30 cm. Luego se cortaron segmentos tallo con una longitud de 5.0 a 7.0 cm medida a partir de los ápices caulinares y se mantuvieron las hojas. Inmediatamente, fueron llevados al laboratorio, para realizar la desinfección.
Para ello, se tuvo en cuenta el protocolo propuesto por Alvarenga (2005) con modificaciones. Primero se lavaron los segmentos de tallo tres veces con agua corriente alternando con la acción de detergentes y enjuagues. Posteriormente, se sumergieron en una solución del fungicida Benomil (3.0 g l-1) durante 20 minutos y se enjuagaron tres veces con agua destilada. Luego se realizó una desinfección con etanol al 70% durante 5 segundos, seguida por tratamiento con Hipoclorito de Sodio.
Se realizó un primer ensayo para seleccionar el tiempo de exposición al desinfectante (10, 15 y 20 min) y luego con ese tiempo se probaron cuatro concentraciones (0.5, 1.0, 1.5 y 2.0%) (v/v). Por último, se efectuaron tres enjuagues con agua destilada estéril.
El material vegetal fue fragmentado hasta obtener ápices caulinares de 2-3 cm de longitud y se colocaron individualmente y de forma vertical en tubos de ensayo (100 x 125 mm) que contenían 15 ml del medio de cultivo de establecimiento.
Se utilizó el medio de cultivo MS con tiamina (0.10 g l-1), mio-inositol (100 mg l-1), sacarosa (30 g l-1), Gelrite (2.6 g l-1) y 1.0 g l-1 de 6-Bencilaminopurina (6-BAP). El pH se ajustó a 5.7 previo a la esterilización en autoclave. Finalmente, los explantes se colocaron en cámara de crecimiento con luz solar a 27±2°C con un período luminoso de aproximadamente 13/11h de luz/oscuridad con un rango de densidad flujo de fotones fotosintéticos (DFFF) entre 48.0 y 62.5 µmol m-2 s-1.
Se utilizaron 30 explantes en cada uno de los tratamientos. A los 21 días de cultivo, se cuantificó el número de explantes contaminados, necrosados y explantes viables sin necrosis o libres de contaminación microbiana visible. Además se calculó el porcentaje de supervivencia.
Multiplicación in vitro
Efecto de reguladores del crecimiento en la multiplicación de brotes in vitro
Los explantes establecidos fueron colocados en frascos de vidrio (cinco explantes por frasco, 50 explantes por tratamiento) con capacidad de 250 ml con 30 ml del medio de cultivo de multiplicación de igual composición que el medio de cultivo de establecimiento, excepto las concentraciones de reguladores de crecimiento (Tabla 1). A los 15 días, se realizó el subcultivo, fragmentando cada explante en segmentos/brotes viables, de al menos una yema y se calculó el coeficiente de multiplicación (CM=segmentos totales/segmentos iniciales).
Tabla 1. Combinaciones de concentraciones de reguladores de crecimiento 6 bencilaminopurina (6-BAP) y ácido indoleacético (AIA) añadidas al medio de cultivo de multiplicación de Stevia rebaudiana.

Efecto del n�mero de subcultivos en el coeficiente de multiplicaci�n
Una vez determinada la concentración de reguladores de crecimiento a emplear en el medio de cultivo para la multiplicación de los brotes, se realizaron cinco subcultivos cada 15 días. En cada uno se calculó el coeficiente de multiplicación.
Fase de aclimatización
Las plántulas regeneradas, con una altura entre 7-10 cm, presencia de varias raíces y al menos cuatro pares de hojas, fueron transferidas a bandejas de polipropileno de 28 alveolos con sustrato compuesto por diferentes porcentajes de zeolita y compost de cachaza (25:75, 75:25, 50:50, 0:100, 100:0). Las bandejas se ubicaron casa de cultivo (temperatura promedio durante el día de 30 ± 2°C, humedad relativa 70%, intensidad luminosa entre 224 y 457 μmol m-2 s-1, frecuencia de riego de tres minutos de duración dos veces al día) para su aclimatización, donde permanecieron por 15 días.
Luego, según su crecimiento y presencia de un sistema radical bien desarrollado, fueron transferidas a bolsas de cultivo y mantenidas bajo las mismas condiciones. A los 15 días, se cuantificó el número de plantas que sobrevivieron y se calculó el porcentaje de supervivencia.
Evaluación de variables morfométricas de las plantas en aclimatización
Paralelamente a la transferencia de las plantas micropropagadas a bolsas con el sustrato seleccionado se realizó el corte de esquejes a plantas cultivadas ex vitro a una altura de 15-20 cm, según las técnicas tradicionales. En ambos casos se eligieron plantas con alturas similares (30 plantas por tratamiento) y se mantuvieron en las condiciones de cultivo previamente descritas. Luego de transcurridos 60 días se evaluaron las variables: altura de la planta (cm), número de hojas y número de tallos por planta.
Análisis estadísticos
Para el análisis estadístico y la elaboración de los gráficos se empleó el software Statistica versión 10.0 para Windows. Para contrastar la normalidad del conjunto de datos obtenidos para cada variable, se utilizaron las pruebas de Kolmogorov-Smirnov y Shapiro Wilk con la corrección de Lilliefors. Para la comparación entre las medias se aplicó la prueba H de Kruskal-Wallis y de ser necesario se realizó la comparación de medias a posteriori, la prueba de U de Mann Whitney o Tablas de Contingencia 2x2. Además, se realizó un análisis de correlación de Spearman entre las variables tiempo de desinfección al desinfectante, concentración del desinfectante y número de explantes necrosados y contaminados. En cada análisis se especifica el valor al cual se establecieron las diferencias.
RESULTADOS Y DISCUSIÓN
Desinfección y establecimiento in vitro de explantes de Stevia rebaudiana
De los 360 explantes establecidos, el 56.9% se desarrollaron hasta una altura entre 10-15 cm y formaron brotes (Figura 1). No se encontraron diferencias significativas al comparar el efecto del tiempo de desinfección sobre el número de explantes necrosados y contaminados. No existió una correlación entre el número de explantes necrosados o contaminados y el tiempo de desinfección. Por ello, se consideró que es posible realizar la desinfección con hipoclorito de sodio entre 10 y 20 minutos, sin afectar la viabilidad de los explantes. Por esta razón seleccionó el tiempo de 15 minutos para continuar con los ensayos.

Figura 1. Explantes de Stevia rebaudiana en medio de cultivo para el establecimiento in vitro, luego del proceso de desinfección (A) y 21 días después del establecimiento in vitro (B).
En contraste, la concentración de hipoclorito de sodio provocó diferencias significativas sobre el número de explantes necrosados y contaminados (Figura 2). Existió una correlación positiva entre el número de explantes necrosados y la concentración de hipoclorito de sodio (R de Spearman 0.927, p<0.01). Al aumentar la concentración del desinfectante, aumentó el daño producido al tejido.
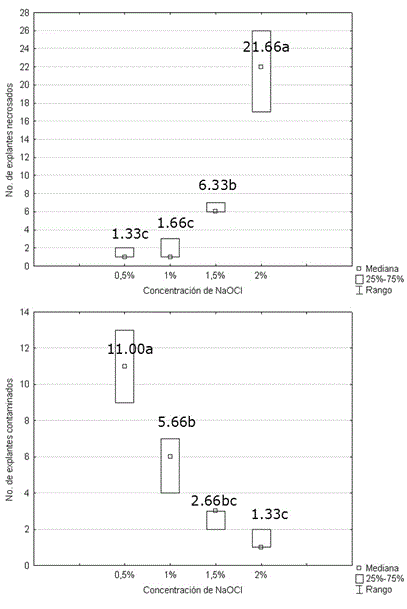
Figura 2. Efecto de la concentración de hipoclorito de sodio sobre el número de explantes necrosados y contaminados en el establecimiento in vitro de Stevia rebaudiana. Medias con letras desiguales difieren según Tablas de contingencia 2x2, p<0.05. n=30.
La mayor concentración a la cual se produjo menor mortalidad sobre los explantes fue la de 1.0% (v/v) de hipoclorito. Este efecto se invirtió al analizar el número de explantes contaminados, donde al incrementar las concentraciones de hipoclorito de sodio, se minimizó significativamente la contaminación microbiana (R de Spearman -0.9659, p<0.01). De acuerdo con los resultados de porcentaje de supervivencia (94.5%) y de desinfección (81.1%), se seleccionó el tratamiento con hipoclorito de sodio al 1.0% para la desinfección.
En la literatura científica referente a esta especie, se ha descrito el uso de NaOCl al 1.0% como agente de desinfección a diferentes tiempos de exposición en varios trabajos (Shatnawi et al., 2011; Namdari et al., 2015; Martínez-Rivillas et al., 2016), en contraposición al uso de bicloruro de mercurio (HgCl2) (Modi et al., 2012; Singh et al., 2014). Estos últimos han referido haber alcanzado muy bajos índices de contaminación microbiana, pero es necesario mencionar que el HgCl2 es un producto altamente tóxico y difícil de eliminar de los explantes. Específicamente Martínez-Rivillas et al. (2016), obtuvieron con igual concentración de NaOCl, pero menos tiempo de desinfección (5 min), una supervivencia de 83.33% y una desinfección del 66.67%, utilizando como explantes brotes jóvenes de Stevia. Los resultados del presente trabajo en este aspecto fueron numéricamente superiores.
Multiplicación in vitro
Efecto de reguladores del crecimiento en la multiplicación de plantas in vitro
No se encontraron diferencias significativas entre los coeficientes de multiplicación por tratamiento (Figura 3). El empleo de las combinaciones de reguladores de crecimiento evaluadas, no modificó el coeficiente de multiplicación.
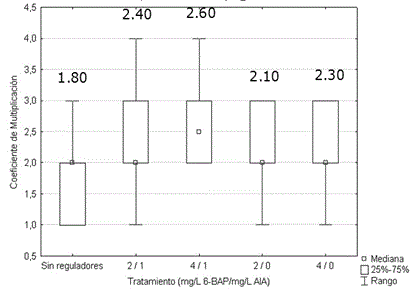
Figura 3. Efecto de la concentración de 6-bencilaminopurina y ácido indolacético sobre el coeficiente de multiplicación de brotes de Stevia rebaudiana, luego de 15 días en medio de cultivo de multiplicación. Los valores medios por tratamiento no fueron significativamente diferentes, de acuerdo con la prueba H de Kruskal Wallis, p>0.05. n=50
Se observó una tendencia en los explantes a aumentar su longitud (7-10 cm) en lugar de formar nuevos brotes. Esto posiblemente esté relacionado, según Tamura et al. (1984), con el tamaño relativo del explante. En esa investigación se observó que en los ápices menores a 1.5 cm se indujeron con mayor frecuencia brotes múltiples, que en aquellos de mayor longitud. Este aspecto debe corroborarse en investigaciones posteriores.
Durante el segundo subcultivo de los explantes, los segmentos en medio de cultivo de multiplicación con reguladores de crecimiento (Tratamientos del 2-5), se tornaron delgados, hiperhídricos y en algunos casos despigmentados. En el tratamiento control sin reguladores del crecimiento (tratamiento 1), no se produjo afectación en el desarrollo de los brotes. Se decidió, por lo tanto, no emplear reguladores de crecimiento en la composición del medio de cultivo para la multiplicación en los siguientes subcultivos. En el estudio efectuado por Modi et al. (2012), también se empleó efectivamente un medio de cultivo MS modificado con sacarosa, agar y sin reguladores de crecimiento para la multiplicación, y se observó la aparición de raíces y la inducción de hiperhidricidad y otras deformaciones en los explantes después de algunos subcultivos, debido a la presencia de los reguladores de crecimiento.
Asimismo, la investigación de Condori-Laurente (2013) mostró que la adición de reguladores de crecimiento no influyó significativamente en la supervivencia, ritmo de crecimiento ni en el número de hojas por planta. A su vez, Martínez-Rivillas et al. (2016) expusieron que se produjo una disminución del tamaño foliar y un acortamiento de los tallos de explantes tras el tercer subcultivo en medio de cultivo con reguladores de crecimiento. Características que desaparecían tras subcultivar los explantes en uno libre de estos. Dichos resultados apoyan la posibilidad de no emplear reguladores del crecimiento para el proceso de multiplicación in vitro.
Efecto del número de subcultivos en el coeficiente de multiplicación
El número de segmentos viables obtenidos de cada brote, no fue significativamente diferente durante los subcultivos 1, 2, 4 y 5 (Figura 4). No obstante, en el tercer subcultivo se produjo un incremento significativo de este coeficiente. Luego del quinto subcultivo se apreciaron daños en el estado fisiológico del material vegetal con brotes delgados, marchitez en las hojas y en los brotes nuevos. Sin embargo, no se apreció la formación de estructuras callosas en la base de los explantes que ha sido una de las problemáticas descritas que limita la micropropagación de la especie (Tamura et al., 1984; Preethi et al., 2011).
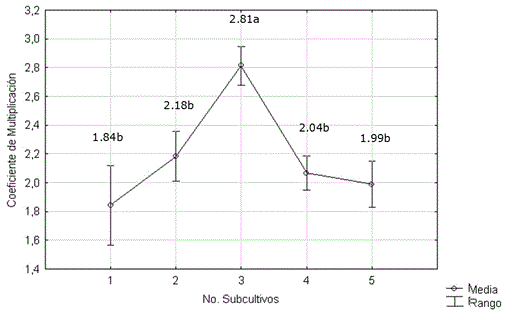
Figura 4. Efecto del número de subcultivos sobre el coeficiente de multiplicación de Stevia rebaudiana. Medias con letras desiguales difieren según las pruebas H de Kruskal-Wallis y comparación de medias a posteriori, p<0.05.
Atendiendo a estos resultados no se continuaron los subcultivos en la fase de multiplicación después del quinto. En Stevia se ha estudiado poco el efecto del número máximo de subcultivos sobre la multiplicación. Se ha prestado más atención, sin embargo, al período en que estos se realizan que es principalmente de 28 días (Modi et al., 2012), 30 días (Preethi et al., 2011) y de 30-45 días (Jiménez, 2011). Cabe destacar que estos autores utilizan medios de cultivo con reguladores de crecimiento y que logran la inducción de brotes múltiples, en contraste con los resultados de esta investigación. El tiempo de subcultivo cada 15 días utilizado coincide con lo informado por Laribi et al. (2012) y Martínez-Rivillas et al. (2016).
Se destaca que las plantas obtenidas luego del quinto subcultivo, presentaban raíces lo cual permitió prescindir de la fase de enraizamiento y transferir a la fase de aclimatización aquellas plantas con altura entre 7 y 10 cm, presencia de varias raíces y más de cuatro pares de hojas.
Fase de aclimatización
Las condiciones de manejo agronómico de las plantas y los sustratos utilizados en este trabajo, permitieron alcanzar entre 80 y 85% de supervivencia en las combinaciones de sustratos, y 90% en los sustratos puros, sin diferencias significativas entre los tratamientos. Atendiendo a ello la supervivencia de las plantas no fue dependiente de la composición del sustrato. Luego, es posible emplear todas las combinaciones valoradas en este trabajo, durante la fase de aclimatización.
Según Aguirre-Dávila (2008), Stevia ha sido cultivada en una amplia gama de suelos, con diferentes características fisicoquímicas (tanto arenosos como orgánicos) con porcentajes de supervivencia variables. En este sentido, Cifuentes-Hidalgo (2003) alcanzó un promedio de 13% de supervivencia con un sustrato de 25% Promix y 75% Arena, mientras Aguirre-Dávila (2008) utilizó un sustrato compuesto por humus de lombriz, pomina y fibra de coco con una relación de 2:1:1, y la supervivencia alcanzó 96%. Por otra parte, Khan et al. (2014) evaluaron varias combinaciones de tierra, Soilrite y vermiculita y la mejor proporción 2:1:1 alcanzó una supervivencia de 75%. Sin embargo, en el presente trabajo, los valores de supervivencia se mantuvieron por encima de 80% en todos los tratamientos.
Es una ventaja que la especie en cuestión cuente con plasticidad para crecer en diferentes sustratos y mantenga, según los resultados alcanzados, altas tasas de supervivencia en medios diferentes. Esto permite transferir a las plantas hacia la fase de aclimatización, con independencia del sustrato. Es posible utilizar el sustrato más económico, o de mayor disponibilidad, indistintamente sin afectar la supervivencia y de acuerdo con las condiciones del lugar donde se ejecute.
Evaluación de variables morfométricas de las plantas en aclimatización
La altura (Figura 5) y el número de hojas (Figura 6) de las plantas micropropagadas, fueron significativamente superiores a los observados en las plantas propagadas por corte de esquejes. No se encontraron diferencias significativas entre ambos grupos de plantas para el número de tallos. Los valores alcanzados por esta variable oscilaron entre 5.30 y 4.54. Generalmente, el desarrollo de protocolos de propagación in vitro solo comprende, hasta la evaluación de la supervivencia en la transferencia a fase de aclimatización. Sin embargo ya se ha establecido que las plantas cultivadas in vitro muestran superioridad a las plantas propagadas por métodos tradicionales (Figura 7) debido al rejuvenecimiento y al saneamiento (Jiménez, 1998).
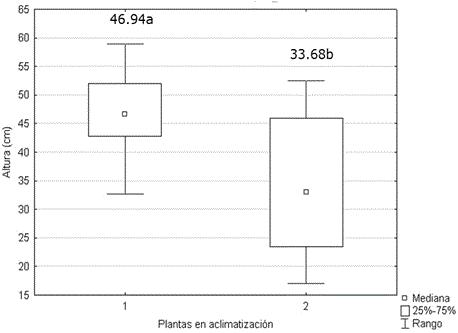
Figura 5. Altura de plantas de Stevia rebaudiana micropropagadas (1) y propagadas por cortes de esquejes (2) a los 60 días en casa de cultivo. Medias con letras desiguales difieren según prueba U de Mann Whitney, p<0.05. n=30.
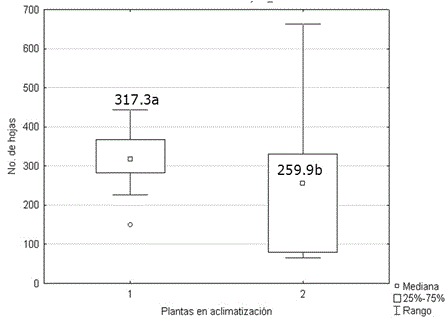
Figura 6. Número de hojas de plantas de Stevia rebaudiana micropropagadas (1) y propagadas por cortes de esquejes (2) a los 60 días en casa de cultivo. Medias con letras desiguales difieren según prueba U de Mann Whitney, p<0.05. n=30.

Figura 7. Plantas de Stevia rebaudiana a los 60 días en casa de cultivo. Micropropagadas (A y B) y propagadas por cortes de esquejes (C y D).
A partir de los ensayos realizados se estableció la micropropagación de S. rebaudiana mediante organogénesis con ápices de plantas cultivadas ex vitro como explante inicial, desinfección con NaClO al 1% durante 15 minutos (más de 90% de supervivencia), multiplicación in vitro de las plantas en medio de cultivo semisólido sin reguladores del crecimiento, durante cinco subcultivos (coeficiente de multiplicación 2.0-2.8 y presencia de raíces), sin necesidad de fase de enraizamiento y aclimatización en combinaciones de sustratos con zeolita y compost de cachaza. Se destaca la ausencia de callo basal en las plantas in vitro y supervivencia por encima de 80% en la fase de aclimatización.
CONCLUSIONES
Con las condiciones experimentales empleadas en este trabajo se obtienen plantas in vitro de Stevia rebaudiana micropropagadas a partir de ápices de plantas cultivadas ex vitro.
Conflicto de inter�s
Los autores no declaran conflicto de interés.
REFERENCIAS
Aguirre-Dávila XD (2008) Evaluación de un sistema de producción in vitro y en invernadero de plantas de Stevia rebaudiana Bertoni. Tesis de Licenciatura, Escuela Politécnica del Ejército, Sangolquí, Ecuador
Alvarenga S (2005) Optimización del cultivo y procesamiento de Stevia rebaudiana para la obtención de un edulcorante natural. CONICIT, San José, Costa Rica
Cifuentes-Hidalgo EM (2003) Enraizamiento in vitro y aclimatación de Stevia rebaudiana B.. Tesis de Licenciatura, Zamorano, Zamorano, Honduras
Condori-Laurente K (2013) Efecto de dosis de Bencilaminopurina (BAP) y el Ácido naftalemacético (ANA) en la producción in vitro de estevia (Stevia rebaudiana B.) en Acobamba. Tesis de Ingeniería, Universidad Nacional de Huancavelica, Acobamba, Huancavelica, Perú
Gantait S, Das A, Mandal N (2014) Stevia: A Comprehensive Review on Ethnopharmacological Properties and in vitro Regeneration. Sugar Tech 17(2): 95-106; doi:10.1007/s12355-014-0316-3
Gantait S, Das A, Banerjee J (2017) Geographical Distribution, Botanical Description and Self-Incompatibility Mechanism of Genus Stevia . Sugar Tech 20(1): 1-10; doi:10.1007/s12355-017-0563-1
Jiménez E (1998) Cultivo de ápices y meristemos. En: Pérez Ponce JN (eds). Propagación y mejora genética de plantas por biotecnología, pp. 45-46. Instituto de Biotecnología de las Plantas, Villa Clara
Jiménez KM (2011) Evaluación del desarrollo in vitro de Stevia rebaudiana Bertoni con el empleo de sistemas de micropropagación semisólido, inmersión temporal RITA y biorreactor de burbujeo. Tesis de Ingeniería, Escuela de Biología Instituto Tecnológico de Costa Rica, San José, Costa Rica
Khan MK, Misra P, Sharma T, Shukla PK, Ramteke PW (2014) Effect of adenine sulphate on in vitro mass propagation of Stevia rebaudiana Bertoni. Journal of Medicinal Plant Research 8(13): 543-549; doi:10.5897/JMPR2013.5217
Laribi B, Rouatbi N, Kouki K, Bettaieb T (2012) In vitro propagation of Stevia rebaudiana (Bert.)- A non caloric sweetener and antidiabetic medicinal plant. Int J Med Arom Plants 2(2): 333-339
Martínez-Rivillas D, Urrea A, Jiménez E, Atehortua L (2016) Estrategia para la propagación in vitro de Stevia rebaudiana Bertoni. Biotecnología Vegetal 16(3): 131 – 142
Modi AR, Patil G, Kumar N, Singh AS, Subhash N (2012) A simple and efficient in vitro mass multiplication procedure for Stevia rebaudiana Bertoni and analysis of genetic fidelity of in vitro raised plants through RAPD. Sugar Tech 14(4): 391-397; doi:10.1007/s12355-012-0169-6
Namdari N, Shooshtari L, Qaderi A (2015) In vitro micropropagation of Stevia rebaudiana Bertoni. Biological Forum 7 (1): 1750-1754
Pande SS, Gupta P (2013) Plant tissue culture of Stevia rebaudiana (Bertoni): A review. Journal of Pharmacognosy and Phytotherapy 5 (1): 26-33; doi:10.5897/JPP13.0258
Preethi D, Sridhar T, Naidu C (2011) Direct Shoot Organogenesis from Leaf Explants of Stevia rebaudiana. Journal of Phytology 3 (5): 69-73
Shahid-Akba K, Roshan Z, Nisar A (2014) Selection of suitable propagation method for consistent plantlets production in Stevia rebaudiana (Bertoni). Saudi Journal of Biological Sciences 21(6): 566-573; doi:10.1016/j.sjbs.2014.02.005
Shatnawi MA, Shibli RA, Abu-Romman SM, Al-Mazraawi MS, Al Ajlouni ZI, Shatanawi WA, Odeh WH (2011) Clonal propagation and cryogenic storage of the medicinal plant Stevia rebaudiana. Spanish Journal of Agricultural Research 9(1): 213-220
Singh P, Dwivedi P, Atri N (2014) In vitro shoot multiplication of Stevia and assessment of stevioside content and genetic fidelity of the regenerants. Sugar Tech 16(4): 430-439; doi:10.1007/s12355-013-0292-z
Tamura Y, Nakamura S, Fukui H, Tabata M (1984) Clonal propagation of Stevia rebaudiana Bertoni by stem-tip culture. Plant Cell Reports Japan 3: 183-185; doi:10.1007/BF00270195
Vives K, Andújar I, Lorenzo JC, Concepción O, Hernández M, Escalona M (2017) Comparison of different in vitro micropropagation methods of Stevia rebaudiana B. including temporary immersion bioreactor (BIT). Plant Cell Tissue Organ Cult 131(1): 195-199; doi:10.1007/s11240-017-1258-8
Recibido: 20-11-2018
Aceptado: 28-01-2019
Copyright (c) 2019 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
