Artículo original
Biotecnología Vegetal Vol. 19, No. 3: 215 - 223, julio - septiembre, 2019
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Efecto del tratamiento térmico a altas temperaturas sobre la germinación in vitro de semillas de Phaseolus vulgaris cv. ‘ICA Pijao’
Effect of heat treatment at high temperature on in vitro seeds germination of Phaseolus vulgaris cv. ‘ICA Pijao’
Damaris Torres1*, Lourdes R García1, Novisel Veitía1, Amanda Martirena-Ramírez1, Raúl Collado1, Leonardo Rivero1, Sinesio Torres2, Mayra Acosta-Suárez1
1 Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54 830.
2 Departamento de Agronomía, Facultad de Ciencias Agropecuarias, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54 830.
*Autora para correspondencia e-mail: damaris@ibp.co.cu
RESUMEN
La producción de frijol común (Phaseolus vulgaris L.) se limita por factores bióticos y abióticos. Entre ellos, el estrés hídrico, salino o por altas temperaturas. Para dar solución a esta problemática, los programas de mejoramiento genético se encaminan a la búsqueda de cultivares tolerantes. El objetivo de este trabajo fue determinar el efecto del tratamiento térmico a altas temperaturas sobre la germinación in vitro de P. vulgaris cv. ‘ICA Pijao’. Para ello, se utilizaron semillas de 1-4 meses de cosechadas. Estas fueron tratadas a 35±2 °C en incubadora o sumergidas en agua en baño térmico. Como control se emplearon semillas a temperatura ambiente (28±2 °C). Los resultados mostraron que la germinación in vitro no fue inferior al 90%, sin embargo las dos condiciones de tratamiento térmico afectaron la longitud y el grosor de la radícula y la longitud de la plúmula. Considerando los resultados, la facilidad de aplicación y la no afectación de la germinación se recomienda utilizar el tratamiento térmico a 35±2 °C en incubadora. Este podría emplearse para inducir estrés por altas temperaturas en el cultivar de frijol común ‘ICA Pijao’ en un protocolo de selección in vitro .
Palabras clave: frijol común, selección in vitro , tolerancia a altas temperaturas
ABSTRACT
The common bean (Phaseolus vulgaris L.) production is limited by biotic and abiotic factors. Among them, water stress, saline or high temperatures. To solve this problem, genetic improvement programs are aimed at the search for tolerant cultivars. The objective of this work was to determine the effect of heat treatment at high temperatures on the in vitro germination of P. vulgaris cv. ‘ICA Pijao’. For this, seeds of 1-4 months of harvest were used. It were treated at 35 ± 2 °C in an incubator or immersed in water in a thermal bath. As a control, seeds at room temperature (28 ± 2 °C) were used. The results showed that in vitro germination was not less than 90%, however the two heat treatment conditions affected the length and thickness of the radicle and the length of the plumule. Considering the results, the ease of application and the non-affectation of germination, it is recommended to use the heat treatment at 35 ± 2 °C in an incubator. This could be used to induce high temperature stress in the common beans cv. ‘ICA Pijao’ in an in vitro selection protocol.
Keywords: common bean, in vitro selection, tolerance to high temperatures
INTRODUCCIÓN
Dentro del género Phaseolus , el frijol común (Phaseolus vulgaris L.) es la especie más ampliamente cultivada en el mundo (Hnatuszko-Konka et al., 2019). En Cuba es un cultivo de gran importancia. Constituye un componente esencial de la canasta básica familiar y de la dieta alimenticia diaria para la mayoría de la población cubana. Esta planta presenta un promedio de 22% de proteínas (Miranda-Lorigados et al., 2006) y contiene además, abundante fibra dietética, diferentes tipos de carbohidratos, vitaminas y minerales (FAO, 2017).
Sin embargo, la producción nacional de P. vulgaris no suple la demanda de este cultivo en Cuba, por lo que el país tiene que destinar gran cantidad de divisas en la importación (Lamz et al., 2016).
En Cuba, como en la mayoría de los países del mundo, existe preocupación por el cambio climático y sus posibles impactos en el sector productivo. La producción de frijol común se ha visto afectada por varios factores bióticos y abióticos. Los estreses ambientales, como el hídrico, salinidad, temperaturas extremas, entre otros, influyen en el crecimiento y productividad de las plantas (Müller y Munné-Brosch, 2015; Driedonks et al., 2018). Especialmente, las etapas de desarrollo que comprende la fase reproductiva en frijol común, son sensibles a las altas temperaturas lo que trae consigo una reducción en el número de legumbres y de semillas debido a la mayor abscisión de flores y legumbres (Omae et al., 2012).
En frijol común las investigaciones relacionadas con la tolerancia al estrés por calor se han centrado fundamentalmente en evaluaciones ex vitro de la respuesta aérea de las plantas. En este sentido, la selección de indicadores que permitan caracterizar la respuesta de las plantas en tales condiciones de estrés ha sido objeto de varias investigaciones. Se menciona por ejemplo el contenido de agua de las hojas (Omae et al., 2012) así como la pérdida de electrólitos y la liberación de fosfato inorgánico en tejido foliar (Collado et al., 2016b).
Por otra parte, las técnicas de mejoramiento genético in vitro pueden facilitar la obtención de cultivares resistentes frente a condiciones adversas como las altas temperaturas (Collado et al ., 2016b) pero es indispensable, como premisa, contar con un protocolo de regeneración de plantas.
A pesar de las dificultades en la regeneración de plantas in vitro en frijol común, se ha obtenido plantas vía organogénesis (Arellano et al., 2009; Quintero-Jiménez et al., 2010; Collado et al., 2013; Castillo et al., 2015; Collado et al., 2016a; Hnatuszko-Konka et al., 2019) y embriogénesis somática (Kwapata et al., 2010; Nafie et al., 2013; Cabrera-Ponce et al., 2014). Para ello se han utilizado como explantes plántulas intactas, ejes embrionarios, cotiledones, nudos cotiledonales, peciolos, entrenudos, brotes axilares, hipocotilos y hojas (Veltcheva y Svetleva, 2005; Dang y Wei, 2009; Gatica et al., 2010).
En el Instituto de Biotecnología de las Plantas se desarrolló un protocolo de regeneración de brotes de P. vulgaris cv. ‘ICA Pijao’, vía organogénesis indirecta (Collado et al., 2013) que podría ser utilizado en los experimentos de transformación genética y en la regeneración in vitro de líneas obtenidas en los programas de mejoramiento genético en la búsqueda de cultivares tolerantes a altas temperaturas. Además, se ha realizado la selección de variables fisiológicas, para determinar la respuesta ante estrés térmico inducido de cultivares de frijol común crecidos en casa de cultivo (Collado et al., 2016b). Sin embargo, el desarrollo de protocolos de selección in vitro a altas temperaturas en este cultivar permitiría elevar la eficiencia de la selección al trabajar in vitro con volúmenes mayores de plantas antes de transferirlas a casas de cultivo o campo. En ese contexto, los indicadores para determinar la respuesta de las plantas deben ajustarse a dichas condiciones. Por lo antes expuesto, el presente trabajo se realizó con el objetivo de determinar el efecto del tratamiento térmico a altas temperaturas sobre la germinación in vitro de P. vulgaris L. cv. ‘ICA Pijao’.
MATERIALES Y MÉTODOS
Material vegetal y tratamiento térmico
Se emplearon semillas maduras de 1-4 meses de cosechadas del cultivar ‘ICA Pijao’ obtenidas en casa de cultivo bajo condiciones semicontroladas. Dicho cultivar está incluido en los programas de mejoramiento genético que se desarrollan en el país, ya que es uno de los más atractivos para los pequeños productores, presenta un rendimiento elevado y posee hábito de crecimiento erecto lo que permite la cosecha mecanizada. Este cultivar es originario de Colombia y produce semillas pequeñas de color negro (código hex: #000000).
Se estudiaron dos condiciones de tratamiento de calor, este procedimiento se realizó antes del proceso de desinfección de las semillas. Se emplearon 100 semillas por tratamiento, las cuales fueron expuestas al tratamiento térmico durante dos horas (Morales et al., 2006).
Los tratamientos realizados se describen a continuación:
Tratamiento 1: Las semillas fueron expuestas a temperatura ambiente (28±2 °C) (Control). Para ello, se colocaron en placas de Petri de 9.0 cm de diámetro y se sellaron con Parafilm.
Tratamiento 2: Las semillas fueron expuestas a 35±2 °C en una incubadora IF-3B (SAKURA-JAPÓN). Para la realización del tratamiento, las semillas se colocaron en placas de Petri de 9.0 cm de diámetro, se sellaron con Parafilm y se expusieron al tratamiento térmico.
Tratamiento 3: Las semillas se sumergieron en agua a 35±2 °C en un baño térmico (LAUDA E 100). Para la realización del tratamiento las semillas se colocaron en bolsas de polipropileno confeccionadas con malla para sombreo de color negro con porcentaje de sombra de 50%.
El experimento se repitió dos veces en el tiempo.
Germinación in vitro
Posterior al tratamiento térmico las semillas se desinfectaron y para ello se siguió el protocolo descrito por García et al. (2008). Una vez desinfectadas, se colocaron 10 semillas por frasco para un total de 100 semillas por tratamiento, en un medio de cultivo de germinación compuesto por Sales MS (Murashige y Skoog, 1962), 1.0 mg l-1 de tiamina, 1.13 mg l-1 de 6- bencilaminopurina (6-BAP), 30 g l-1 de sacarosa, 7.0 g l-1 de agar (BIOCEM). Los medios de cultivo en estado semisólido se distribuyeron en frascos de vidrio con capacidad total de 250 ml, a los que se les adicionaron 30 ml de medio de cultivo. Los frascos fueron colocados en cámara de crecimiento a oscuridad constante y temperatura de 28±2 °C.
A los tres días de cultivo, se cuantificó el número de semillas germinadas por frasco de cultivo y se calculó el porcentaje de germinación por frasco (PG) de acuerdo con la siguiente ecuación: PG = (SG/NTS) x 100. Siendo SG es el número de semillas que emitió radícula a las 72 horas y NTS es el número total de semillas. Además, en 60 semillas por tratamiento seleccionadas al azar, se evaluaron las variables asociadas a la germinación de las semillas: longitud y grosor de la radícula (cm) y longitud de la plúmula (cm). Para ello, se empleó una regla graduada (cm) y un pie de rey.
Análisis estadístico
Para el análisis de los valores de porcentaje de germinación, longitud y grosor de la raíz y largo de la plúmula se emplearon las pruebas H de Kruskall Wallis y U de Mann Whitney (p≤0.05) previa comprobación de los supuestos de normalidad y homogeneidad de varianza. El paquete estadístico empleado fue Statistic Packaged for Social Science (SPSS) versión 21.0 sobre Windows.
RESULTADOS Y DISCUSIÓN
El tratamiento térmico a 35±2 °C (incubadora o inmersión en agua en baño térmico) no redujo la germinación in vitro de semillas de P. vulgaris cv. ‘ICA Pijao’ por debajo del 90% (Figura 1). El tratamiento 3 (inmersión en agua a 35±2 °C en baño térmico) mostró el menor valor con diferencias significativas con respecto a los otros tratamientos.
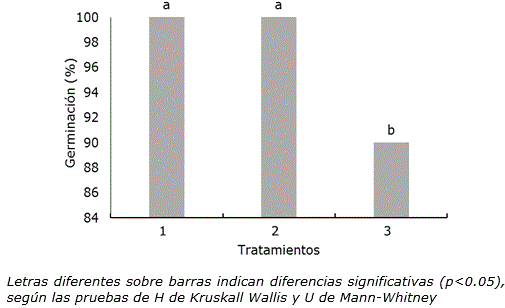
Figura 1. Influencia de las condiciones de tratamiento térmico en la germinación in vitro de semillas de Phaseolus vulgaris L. cultivar ‘ICA Pijao’ a los tres días de cultivo. n=100. 1: Control, semillas a temperatura ambiente (28±2 °C), 2: semillas a 35±2 °C en una incubadora durante 2 h, 3: Semillas sumergidas en agua a 35±2 °C en un baño térmico durante 2 h.
En la respuesta observada en el tratamiento 2 (semillas a 35±2 °C en una incubadora durante 2 h) sin diferencias significativas con el control, pudieron influir las condiciones ambientales a las que se encontraban expuestas las semillas para su germinación in vitro. Posterior al tratamiento térmico las semillas se colocaron dentro de un frasco y sobre medio de cultivo que proporciona la humedad necesaria. En este sentido, Grey et al. (2011) indicaron que para cierto rango de temperaturas elevadas, la velocidad de absorción de agua y de las reacciones químicas es mayor y las semillas germinan sin dificultad.
La germinación de semillas comprenden tres etapas sucesivas que se superponen parcialmente: la absorción de agua por imbibición, el inicio de la actividad enzimática y del metabolismo respiratorio y el crecimiento y división celular. En las primeras horas se produce una intensa absorción de agua por los tejidos de la semilla; dicho incremento va acompañado de un aumento proporcional en la actividad respiratoria (Doria, 2010). La disminución en la germinación de las semillas tratadas por inmersión en agua a 35±2 °C durante 2 h (tratamiento 3) podría estar relacionada con afectaciones producidas por el agua caliente en la semilla (Alexander y Sánchez, 2002). Aunque es necesaria el agua para la rehidratación de las semillas, un exceso de ella actuaría desfavorablemente para la germinación, pues dificultaría la llegada de oxígeno al embrión y el consumo se incrementa considerablemente cuando comienza la imbibición de la semilla (Matilla, 2008).
Este resultado podría responder también a las características propias de la semilla ya que con frecuencia la inmersión en agua caliente se emplea en otras especies para favorecer la germinación. Por ejemplo, Ramos (2015) mediante la aplicación de tratamientos pregerminativos a semillas de Irapay (Lepidocaryum tenue Mart.), obtuvieron 100% de germinación después de sumergirlas en agua caliente (50 °C) durante tres minutos.
Adicionalmente, los resultados evidenciaron que la longitud de la radícula se afectó en las semillas sometidas a los tratamientos térmicos sin diferencias significativas entre ellos (Figura 2).
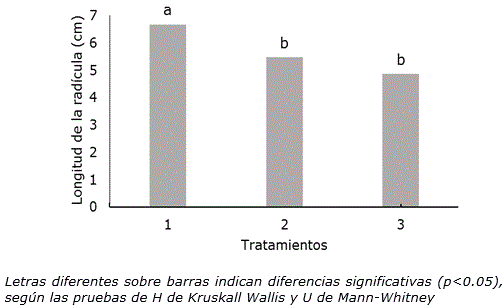
Figura 2. Longitud de la radícula de Phaseolus vulgaris L. cultivar ‘ICA Pijao’ en las dos condiciones de tratamiento térmico ensayados a los tres días de cultivo. n=60. 1: Control, semillas a temperatura ambiente (28±2 °C), 2: semillas a 35±2 °C en una incubadora durante 2 h, 3: Semillas sumergidas en agua a 35±2 °C en un baño térmico durante 2 h.
La temperatura de 35 °C aplicada a las semillas, durante dos horas, pudo haber influido en una disminución de los niveles endógenos de reguladores del crecimiento como citoquininas y auxinas, que propiciaron una disminución del crecimiento y por consiguiente una reducción en la longitud de la radícula. Según Vásquez y Torres (2006) las altas temperaturas influyen en el incremento del contenido de ácido abscísico (ABA) que es un inhibidor y se activan los sistemas oxidativos, los cuales reducen el nivel de auxina libre y provocan una disminución de la elongación de las células. El crecimiento es un proceso asociado, tanto con el incremento del número de células (división celular), como en su tamaño (alargamiento celular). La disminución de la longitud de la radícula se pudiera interpretar como una inhibición en el alargamiento celular, ya que este es más sensible a condiciones de estrés que la división celular (Hsiao y Xu, 2000).
En el caso del tratamiento 2 (semillas a 35±2 °C en una incubadora durante 2 h), el efecto pudo deberse, además, a la deshidratación de los tejidos del embrión que provocan los tratamientos térmicos a la semilla (Chaves-Barrantes y Gutiérrez-Soto, 2017) que se debe entre otros fenómenos a que las altas temperaturas afectan considerablemente la permeabilidad de las membranas celulares en las radículas (Kurepin et al., 2015). Contrario a estos resultados, Moo-Muñoz et al. (2016) indicaron que el secado en horno con temperatura constante de 35 °C en semillas de Capsicum chinense Jacq., promueve una mayor longitud de la radícula. Los resultados obtenidos en la presente investigación cuando las semillas fueron tratadas en la incubadora a 35±2 °C se produjo una disminución de 1.2 cm de la radícula en relación con el tratamiento control (tratamiento 1).
Los resultados demostraron, igualmente, que con el tratamiento térmico se afectó el grosor de la radícula. Esta variable fue significativamente menor en el tratamiento por inmersión en agua a 35±2 °C (Figura 3). Este resultado podría estar relacionado con las afectaciones sufridas por el embrión cuando las semillas estuvieron expuestas en agua a 35±2 °C durante dos horas, lo que podría propiciar dificultades para la estimulación del crecimiento secundario en la radícula (Vásquez y Torres, 2006; Matilla y Rodríguez-Gacio, 2013).
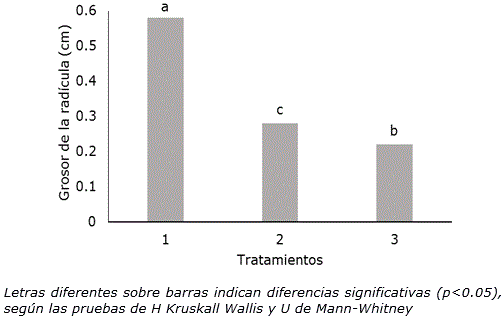
Figura 3. Grosor de la radícula de P. vulgaris L. cultivar ‘ICA Pijao’ en las dos condiciones de tratamiento ensayadas a los tres días de cultivo. n=60. 1: Control, semillas a temperatura ambiente (28±2 °C), 2: semillas a 35±2 °C en una incubadora durante 2 h, 3: Semillas sumergidas en agua a 35±2 °C en un baño térmico durante 2 h.
Al igual que en las variables anteriores, la longitud de la plúmula se redujo significativamente (p≤0.05), bajo las dos condiciones de tratamiento térmico a 35±2 °C (Figura 4). Al estar las semillas tratadas durante dos horas a 35±2 °C posiblemente se generó una disminución en el metabolismo de los carbohidratos lo que influyó negativamente en el crecimiento de la plúmula (Vázquez y Torres, 2006).
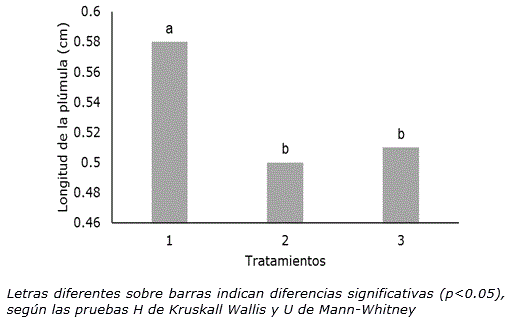
Figura 4. Longitud de la plúmula de Phaseolus vulgaris L. cultivar ‘ICA Pijao’ en las dos condiciones de tratamiento ensayadas a los tres días de cultivo. n=60. 1: Control, semillas a temperatura ambiente (28±2 °C), 2: semillas a 35±2 °C en una incubadora durante 2 h, 3: Semillas sumergidas en agua a 35±2 °C en un baño térmico durante 2 h.
De acuerdo con el criterio de Chaves-Barrantes y Gutiérrez-Soto (2017), las plantas en general sufren estrés por temperaturas bajas o altas con respecto al umbral que se ha establecido para cada especie. En este sentido, indicaron, a partir de referencias de la literatura científica, que el frijol común tiene un umbral máximo de 34 °C. En este trabajo las semillas se sometieron a tratamiento térmico durante 2 h a 35±2 °C y aunque la germinación no se redujo por debajo del 90% sí se observó un efecto negativo en la longitud y grosor de la radícula y en la longitud de la plúmula.
Las estudios sobre el efecto de condiciones de estrés por calor en la zona radicular de las plantas son más escasos que los que se han dedicado al área aérea debido posiblemente a las dificultades en la observación de las raíces en el campo (Huang y Gao, 2000). No obstante, Polanía et al. (2009), analizaron en invernadero el desarrollo y la distribución de raíces de 16 cultivares de fríjol común bajo estrés. Estos autores identificaron y caracterizaron los mecanismos radicales asociados a la tolerancia e igualmente algunos de respuesta en la parte aérea de la planta. Este método resultó apropiado para determinar diferencias fenotípicas en longitud total y específica de raíces así como distribución de raíces a diferentes profundidades. En correspondencia con lo anterior, la identificación en este trabajo de variables que se afectan durante la germinación in vitro de semillas del cultivar ‘ICA Pijao’ pretratadas a 35±2 °C, podría enriquecer la caracterización de líneas de plantas obtenidas por métodos de mejoramiento genético y ser tomadas como indicadoras para la selección in vitro de tolerancia al estrés inducido por altas temperaturas.
Finalmente, considerando los resultados, la facilidad de aplicación y la no afectación de la germinación, lo cual garantiza que se trabaje con el máximo de semillas disponibles, se recomienda utilizar el tratamiento térmico a 35±2 °C en incubadora.
CONCLUSIONES
El tratamiento térmico a semillas de P. vulgaris cv. ‘ICA Pijao’ a 35±2 °C durante 2 h reduce la longitud de la plúmula así como la longitud y el grosor de la radícula de semillas germinadas in vitro . Atendiendo a lo anterior este tratamiento podría emplearse para inducir estrés por altas temperaturas en dicho cultivar en un protocolo de selección in vitro .
Conflicto de interés
Los autores no declaran conflictos de intereses.
REFERENCIAS
Alexander J, Sánchez G (2002) Efecto del tratamiento con agua caliente e imbibición sobre la germinación de semillas de L. leucocephala. Revista Científica XII-Suplemento 2: 581-583
Arellano J, Fuentes SI, Castillo-España P, Hernández G (2009) Regeneration of diferent cultivars of common bean (Phaseolus vulgaris L.) via indirect organogenesis. Plant Cell Tissue Organ Culture 96: 1-11
Cabrera-Ponce JL, López L, León-Ramírez CG, Jofre-Garfas AE, Verver-Y-Vargas A (2014) Stress induced acquisition of somatic embryogenesis in common bean (Phaseolus vulgaris L.). Protoplasma 252(2): 559-570; doi:10.1007/s00709-014-0702-4
Castillo BM, de la O RJL, Gallardo JOM, Iturriaga G (2015) In vitro plants of common bean (Phaseolus vulgaris) obtained by direct organogenesis. J Agric Sci 7(11): 169-179
Chaves-Barrantes NF, Gutiérrez-Soto MV (2017) Respuestas al estrés por calor en los cultivos. I Aspectos moleculares, bioquímicos y fisiológicos. Agronomía Mesoamericana 28(1): 237-253; doi:10.15517/am.v28i1.21903
Collado R, Bermúdez-Caraballoso I, García LR, Veitía N, Torres D, Romero C, Angenon G (2016a) Epicotyl sections as targets for plant regeneration and transient transformation of common bean using Agrobacterium tumefaciens. In vitro Cellular and Developmental Biology-Plant 52(5): 500-511
Collado R, Carabeo A, Poveda MI, Rojas L, Leiva-Mora M, García LR, Veitía N, Martirena A, Torres D, Rivero L (2016b) Respuesta de cultivares de Phaseolus vulgaris L. en condiciones inducidas de estrés térmico. Biotecnología Vegetal 16(1): 45-51
Collado R, Veitía N, Bermúdez-Caraballoso I, García LR, Torres D, Romero C, Rodríguez-Lorenzo JL, Angenon G (2013) Efficient in vitro plant regeneration via indirect organogenesis for different common bean cultivars. Sci Hortic 153: 109-116
Dang W, Wei ZM (2009) High frequency plant regeneration from the cotyledonary node of common bean. Biol Plant 53: 312-316
Doria J (2010) Generalidades sobre las semillas: su producción, conservación y almacenamiento. Cultivos Tropicales 31(1): 74-85
Driedonks N, Wolters-Arts M, Huber H, Boer GJ, Vriezen W, Mariani C, Rieu I (2018) Exploring the natural variation for reproductive thermotolerance in wild tomato species. Euphytica 214: 67; doi:10.1007/s10681-018-2150-2
FAO (2017) Organización de las Naciones Unidas para la Alimentación y la Agricultura. Disponible en: http://faostat.fao.org/site/408/default.aspx. Consultado: 05/11/2018
García LR, Collado R, Bermúdez-Caraballoso I, Veitía N, Torres D, Romero C (2008) Regeneración de plantas vía organogénesis directa en Phaseolus vulgaris L.. Biotecnología Vegetal 8(2): 109-114
Gatica AM, Muñoz J, Ramírez P, Valdez M (2010) In vitro plant regeneration system for common bean (Phaseolus vulgaris ): effect of N 6-benzylaminopurine and adenine sulphate. Electronic Journal of Biotechnology 13(1): 1-8
Grey TL, Beasley JP, Webster TM, Chen CY (2011) Peanut seed vigor evaluation using a thermal gradient. International Journal Agronomy 2011: 1-7
Hnatuszko-Konka K, Kowalczyk T, Gerszberg A, Glińska S, Grzegorczyk-Karolak I (2019) Regeneration of Phaseolus vulgaris from epicotyls and hypocotyls via direct organogenesis. Scientific Reports 9: 6248; doi:10.1038/s41598-019-42723-8
Huang B, Gao H (2000) Root physiological characteristics associated with drought resistance in tall fescue cultivars. Crop Science 40: 196-203
Hsiao TC, Xu LK (2000) Sensitivity of growth of roots versus leaves to water stress: biophysical analysis and relation to water transport. Journal of Experimental Botany 51(350): 1595-1616; doi:10.1093/jexbot/51.350.1595
Kurepin LV, Ivanov AG, Zaman M, Pharis RP, Allakhverdiev SI, Suleyman RP, Hurry V, Hüner N (2015) Stress-related hormones and glycinebetaine interplay in protection of photosynthesis under abiotic stress conditions. Photosynth Res 126: 221-235; doi:10.1007/s11120-015-0125-x
Kwapata K, Sabzikar R, Sticklen M, Kelly JD (2010) In vitro regeneration and morphogenesis studies in common bean. Plant Cell Tissue and Organ Culture 100: 97-105
Lamz A, Cárdenas R, Ortiz R, Montero V, Martínez B, de la Fé CF (2016) Evaluación del comportamiento agro-morfológico a partir de la caracterización de la variabilidad en líneas de frijol común (Phaseolus vulgaris L.) sembradas en época tardía. Cultivos Tropicales 37(2): 108-114
Matilla AJ (2008) Desarrollo y germinación de las semillas. En: Azcon-Bieto J, Talón M. McGraw-Hill (eds). Fundamentos de Fisiología Vegetal, pp. 537-558. McGraw-Hill Interamericana, Madrid España; ISBN: 978-84-481-9293-8
Matilla AJ, Rodríguez-Gacio MC (2013) Non-symbiotic hemoglobins in the life of sedes. Phytochemistry 87: 7-15; doi:10.10 16/j.phytochem.2012.11.016
Miranda-Lorigados S, Rosas-Sotomayor JC, Luwbia Aranda-Rocha LL, Ortiz-Pérez R, Ponce-Brito M, Ríos-Labrada H (2006) Análisis molecular de la diversidad genética de frijol común manejada por campesinos en Cuba. Agronomía Mesoamericana 17(3): 369-382
Morales D, Rodríguez P, Dell’Amico JA, Torrecillas A, Sánchez-Blanco MJ (2006) Efecto de altas temperaturas en algunas variables del crecimiento y el intercambio gaseoso en plantas de tomate (Lycopersicon esculentum Mill. cv. Amalia). Cultivos Tropicales 27(1): 45-48
Moo-Muñoz AJ, Ayala-Garay OJ, Latournerie-Moreno L, Tzec-May YA, Pinzón-López LL (2016) Efecto de la madurez y secado de semilla de Capsicum chinense Jacq. en la germinación y calidad fisiológica de plántula. Agroproductividad 9(1): 63-67
Müller M, Munné-Brosch S (2015) Ethylene response factors (ERFs): a key regulatory hub in hormone and stress signalin. Plant Physiology 169(1): 32-41; doi:10.1104/pp.15.00677
Murashige T, Skoog FA (1962) Revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant 15: 473-497
Nafie EM, Taha HS, Mansur RM (2013) Impact of 24-epibrassinolide on callogenesis and regeneration via somatic embryogenesis in Phaseolus vulgaris L. cv. Brunca. World Appl Science Journal 24(2): 188-200
Omae H, Kumar A, Shono M (2012) Adaptation to high temperature and water deficit in the common bean (Phaseolus vulgaris L.) during the reproductive period. Journal of Botany 2012: 1-6; doi:10.1155/2012/803413
Polanía JA, Idupulapati M, Beebe RS, García R (2009) Desarrollo y distribución de raíces bajo estrés por sequía en fríjol común (Phaseolus vulgaris L.) en un sistema de tubos con suelo. Agronomía Colombiana 27(1): 25-32
Quintero-Jiménez A, Espinosa-Huerta E, Acosta-Gallegos JA, Guzmán-Maldonado HS, Mora-Avilés MA (2010) Enhanced shoot organogenesis and regeneration in the common bean (Phaseolus vulgaris L.). Plant Cell Tissue Organ Culture 102: 381-386
Ramos AE (2015) Efecto de los tratamientos pregerminativos en semillas de Irapay (Lepidocaryum tenue Mart.). Xilema 28: 79-85
Vásquez E, Torres S (2006) Fisiología Vegetal II tomo. Editorial Félix Varela, Ciudad de La Habana
Veltcheva M, Svetleva D (2005) In vitro regeneration of Phaseolus vulgaris L. via organogenesis from petiole explants. J Cent Eur Agric 6: 53-58
Recibido: 14-04-2019
Aceptado: 06-06-2019
Copyright (c) 2019 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
