Artículo original
Biotecnología Vegetal Vol. 19, No. 4: 265 - 275, octubre - diciembre, 2019
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Multiplicación in vitro de Macleania rupestris (Kunth) A.C. Sm. (Ericaceae)
In vitro multiplication of Macleania rupestris (Kunth) A.C. Sm. (Ericaceae)
Antonietta Ornella Gutiérrez Rosati1*, Yngrid De la Cruz Chacón1
1Centro de Investigación en Recursos Genéticos, Biotecnología y Bioseguridad- CIRGEBB, Facultad de Ciencias, Universidad Nacional Agraria La Molina. Av La Molina S/N. La Molina. Lima. Perú. 666.
*Autora para correspondencia e-mail: antonietta@lamolina.edu.pe
RESUMEN
Macleania rupestris (Kunth) A.C. Smith (Ericaceae) es una planta originaria de los Andes, que produce frutos comestibles con gran potencial alimenticio y comercial. Se han establecido in vitro plantas de M. rupestris a partir de semillas de frutos maduros y para incrementar su número se requiere definir las condiciones de su multiplicación. El objetivo de la investigación fue determinar el efecto de zeatina y kinetina para multiplicar in vitro plantas de M. rupestris. Como medio de cultivo basal se utilizó Woody Plant (WP). Los tratamientos incluyeron el medio de cultivo CIRGEBB (WP+zeatina 0.5 mg l-1), A (WP+kinetina 0.5 mg l-1), B (WP+kinetina 1.0 mg l-1) y WP como control. Las variables evaluadas fueron altura del explante (cm), número de brotes y número de hojas, a los 60 y 120 días de cultivo. Tanto el uso de zeatina como kinetina en el medio de cultivo WP permiten la multiplicación in vitro de M. rupestris. Sin embargo, la adición de zeatina favorece el desarrollo de las plantas con características fenotípicas adecuadas para la micropropagación. Atendiendo a los resultados se propone utilizar el medio de cultivo A (WP+kinetina 0.5 mg l-1).
Palabras clave: alicón, citoquininas, crecimiento, kinetina, zeatina
ABSTRACT
Macleania rupestris (Kunth) A.C. Smith (Ericaceae) is a plant native to the Andes, which produces edible fruits with great food and commercial potential. M. rupestris plants have been in vitro established from seeds of ripe fruits and to increase their number it is necessary to define the conditions of their multiplication. The objective of the investigation was to determine the effect of zeatin and kinetin to in vitro multiply M. rupestris plants. As a basal culture medium, Woody Plant (WP) was used. Treatments included the CIRGEBB culture medium (WP + 0.5 mg l-1 zeatin), A (WP + 0.5 mg l-1 kinetin), B (WP + 1.0 mg l-1 kinetin) and WP as control. The variables evaluated were explant height (cm), number of shoots and number of leaves, at 60 and 120 days of culture. The use of zeatin and kinetin in the WP culture medium allow in vitro multiplication of M. rupestris. However, the addition of zeatin favors the development of plants with phenotypic characteristics suitable for micropropagation. Based on the results, it is proposed to use the culture medium A (WP + 0.5 mg l-1 kinetin).
Keywords: alicon, cytokinins, growth, kinetin, zeatin
INTRODUCCIÓN
El consumo de frutos de plantas silvestres es una costumbre ancestral en los habitantes de la región andina, por lo que está muy arraigada culturalmente, debido a que contribuye a la subsistencia de muchas comunidades en la región (Leiva et al., 2013). Asimismo, el consumo de frutas provenientes de plantas silvestres puede estar influenciada por aspectos socio-culturales propios de cada comunidad.
La familia Ericaceae es considerada una de las más importantes en la flora de los bosques altoandinos o de páramo, principalmente de neblina donde juega un rol ecológico importante como especies pioneras (Huamantupa y Cuba, 2011). Dentro de la gran diversidad de especies vegetales, las ericáceas están constituidas por un número importante de géneros y especies que cuenta con aproximadamente 125 géneros y 4 500 especies identificadas en todo el planeta y se encuentran en todos los continentes a excepción de la Antártida (Salinas y Betancur, 2005; Luteyn y Pedraza, 2006). Esta familia está distribuida a nivel mundial forma parte de la vegetación predominante en brezales del hemisferio norte y en la zona de páramos en los neotrópicos. Se distribuye en cuatro centros de alta biodiversidad que se ubican en Australia, Himalaya, Sur de África y los Neotrópicos (Luteyn y Pedraza, 2006).
Macleania rupestris Kunth A.C. Sm., conocida como uva camarona o Alicón pertenece a la familia Ericaceae y es originaria de las regiones altoandinas. Se encuentra distribuida en la vertiente occidental de la Cordillera Oriental, a ambos lados de la Cordillera Occidental de los Andes, entre 2 200 a 3 500 m. s. n. m. (Van den Eynden et al., 2003; Durán-Casas et al., 2013) y se distribuye a lo largo de países como Nicaragua, Costa Rica, Panamá, Venezuela, Colombia, Ecuador y Perú. Es un arbusto de 1 a 5 metros de altura, ramificado, con ramas largas hasta 2.5 metros y tallos subterráneos de reserva; hojas grandes ovadas a elípticas con nervadura acródoma (Abril, 2010; Fernández, 2012), inflorescencia racimosa con flores tubulares rojas con el borde blancuzco (Lozano y Valencia, 1992). El fruto carnoso es una baya morado-trasparente a negro de 0.8 a 1.5 cm de diámetro y 1.5 a 3.5 gramos por fruto, con abundante semilla pequeña; la pulpa tiene un color claro con sabor dulce y agradable (Valencia y Carrillo, 1991).
M. rupestris produce frutos comestibles con gran potencial alimenticio y comercial, los cuales han sido utilizados por los pobladores, de manera artesanal, en las zonas donde se produce, se consumen en forma fresca o como ingrediente en la elaboración de dulces y mermeladas. Los frutos de las plantas de la familia Ericaceae también han sido estudiados por sus propiedades medicinales, sobre todo por su capacidad antioxidante (Pennington y Fisher, 2009; Dastmalchi et al., 2011).
A pesar de lo anterior y siendo los Andes considerados como una de las ocho zonas principales de domesticación de especies vegetales en el mundo (Tapia, 2000; Morales et al., 2006) aún no se ha tomado en cuenta a las plantas de la familia Ericaceae como potenciales frutales para producción, por lo que la propagación con fines comerciales de M. rupestris ha sido poco estudiada.
Investigaciones como la realizada por Lagos-Burbano et al. (2010) describieron los frutales nativos de la familia Ericaceae, en la zona altoandina de Colombia, y concluyeron, que los pobladores tienen escasos conocimientos sobre el manejo de las especies y que pueden usarse para recuperación ecológica de la zona, por poseer una alta capacidad de adaptación a diferentes condiciones climáticas y de suelos. Sin embargo, no se analiza su potencial comercial. Durán-Casas et al. (2013) estudiaron la propagación por acodos aéreos de M. rupestris como alternativa para la introducción de esta planta en el cultivo comercial y su uso para la recuperación de los ecosistemas de páramo y subpáramo. Igualmente Veloza et al. (2014) estudiaron la propagación de M. rupestris por esquejes, también como alternativa a la reproducción de la planta con fines comerciales. Córdoba et al. (2010) describieron los métodos de propagación de M. rupestris y destacaron su potencial para ser propagada in vitro a partir de yemas laterales y semillas. Por su parte, Ortiz e Iñamagua (2019) propagaron M. rupestris a partir de meristemas apicales colocados en un medio de cultivo Murashige y Skoog enriquecido con ácido giberélico y concluyeron que este medio de cultivo podría ser considerado como base para la estructuración de un protocolo de propagación para la especie.
Se han observado problemas en la propagación comercial de la planta, sea ésta realizada a través de semillas, debido a su reducido tamaño y a que en la polinización se produce baja productividad de frutos (Fuchs et al., 2010). Asimismo, el uso de estacas como método de propagación vegetativa se ve limitado por su pobre enraizamiento. Por ello, la micropropagación se muestra como una alternativa para la introducción de la planta a la agricultura comercial.
La micropropagación presenta algunas ventajas comparada con la propagación vegetativa tradicional. Se puede aplicar para mantener colecciones de germoplasma de respaldo (Reed y Abdelnour-Esquivel, 1991), así como también para obtener plántulas libres de microorganismos patógenos a lo largo de todo el año (González et al., 2000; Ostrolucká et al., 2004). Así mismo, Rayas et al. (2019) consideraron que la propagación in vitro, libera las plantas de riesgos que se producen en el campo, lo que reduce los costos, asegura el mantenimiento de la fidelidad genética y facilita el intercambio de germoplasma, lo que también es mencionado por Arellano et al. (2009) y Jiménez-Terry y Agramonte (2013).
Por otra parte, Barrios-Paternina y Mercado-Gómez (2014) mencionaron que las especies silvestres son capaces de mejorar genéticamente a sus parientes cultivadas comercialmente, lo que puede generar, ya sea de forma inducida o natural híbridos más resistentes a enfermedades, plagas y factores de estrés como temperaturas y sequías. De allí la importancia de la propagación in vitro de M. rupestris, como alternativa a la producción de frutales pertenecientes a la familia Ericaceae de forma comercial, como ya se viene haciendo con el arándano (Vaccinium corymbosum L.). En el Centro de Investigaciones en Recursos Genéticos, Biotecnología y Bioseguridad–CIRGEBB, de la Universidad Nacional Agraria La Molina se han establecido in vitro plantas de M. rupestris a partir de semillas de frutos maduros. Este es un paso importante para establecer un protocolo de propagación in vitro de la especie. Sin embargo, para incrementar el número de plantas se requiere definir las condiciones de su multiplicación. Teniendo en cuenta lo anterior, la presente investigación tuvo como objetivo determinar el efecto de zeatina y kinetina para multiplicar in vitro plantas de M. rupestris.
MATERIALES Y MÉTODOS
El desarrollo experimental se llevó a cabo en el Centro de Investigación de Recursos Genéticos, Biotecnología y Bioseguridad (CIRGEBB) de la Universidad Nacional Agraria La Molina en Lima, Perú.
Material vegetal
El estudio se llevó a cabo con plántulas in vitro de M. rupestris, existentes en el banco de germoplasma del Centro de Investigaciones en Recursos Genéticos, Biotecnología y Bioseguridad–CIRGEBB, de la Universidad Nacional Agraria La Molina. Estas se establecieron in vitro a partir de semillas de frutos maduros colectados a mano por habitantes del centro poblado de San Francisco perteneciente al Distrito de Conchán, provincia de Chota de la Región de Cajamarca (Figura 1).

Figura 1. Planta de Macleania rupestris de donde se colectaron los frutos.
El poblado de San Francisco se encuentra ubicado en el Distrito de Conchán, distrito rural de 120 viviendas, con una temperatura promedio anual de 17 °C (Figura 2), siendo las temperaturas mínimas medidas en el mes de julio (12.6 °C) y las máximas en el mes de noviembre (26.6 °C).
Figura 2. Ubicación del Distrito Conchán de la provincia de Chota, Región de Cajamarca, Perú (Pérez, 2006).
El Distrito Conchán se ubica a una altitud promedio de 2 400 m s. n. m, con pluviosidad variable. Abril es el mes de mayor intensidad de lluvias, con 115.05 mm. Los suelos de la provincia de Chota son de pendiente ligeramente inclinada y de textura predominantemente arcillosa, pesados y pedregosos, con pH ácido (Alcántara, 2011).
Condiciones de cultivo
El medio de cultivo basal empleado fue el propuesto por Lloyd y McCown (1980), conocido como Woody Plant (WP), al que se adicionaron los reguladores del crecimiento zeatina y kinetina.Se prepararon soluciones madre de zeatina 1 000 mg l-1 y kinetina 1 000 mg l-1.
A partir de la composición se conformaron tres medios de cultivo para la multiplicación in vitro. Como control se utilizó WP (Tabla 1).
Tabla 1. Composición de los medios de cultivo utilizados para la micropropagación de Macleania rupestris Kunth A.C. Sm.
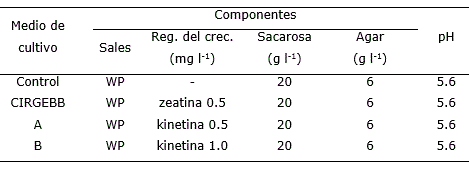
Como explante inicial se utilizaron microesquejes formados por segmentos de tallos de plántulas desarrolladas en medio de cultivo basal WP, de 60 días de cultivadas in vitro. En condiciones de asepsia, se obtuvieron esquejes de aproximadamente 1 centímetro de longitud con al menos una yema y una hoja, los que fueron colocados en frascos de cultivo a razón de cinco explantes por frasco (lo que constituyó una unidad experimental). Los frascos se sellaron con papel aluminio estéril y Parafilm.
Los explantes en sus respectivas unidades experimentales fueron llevados al área de cultivo, con luminosidad de 47.74 μmol m-2 s-1 de intensidad, 22 ± 2 °C y fotoperiodo de 8 horas de luz/16 horas de oscuridad controlado por un reloj programador.
El diseño experimental constó de cuatro tratamientos (medios de cultivo) en unidades experimentales constituidas por frascos de vidrio de 250 ml de capacidad con 25 ml de medio de cultivo (Control, CIRGEBB, A, B) y con cinco explantes por unidad experimental. Para el análisis estadístico se consideró el diseño completamente al azar (DCA) con cuatro tratamientos y siete repeticiones (n=35 por tratamiento).
Las variables analizadas fueron: altura del explante (cm), número de brotes y número de hojas por explante, a los 60 y 120 días de cultivo.
Análisis estadístico
Los resultados fueron sometidos a una prueba de bondad de ajuste de Kolmogorov - Smirnov, para establecer si se ajustaban a una distribución normal, con la finalidad de saber si los mismos se tratarían con análisis de varianza de forma paramétrica o no paramétrica debido a que se contó con una muestra mayor de 50 (Herrera et al., 2012). Los análisis estadísticos se realizaron con el software estadístico InfoStat versión 2018.
RESULTADOS Y DISCUSIÓN
De acuerdo con el análisis estadístico, a través de la prueba de Kolmogarov - Smirnov se demostró que las cuatro variables de respuesta estudiadas, no cumplían con el supuesto de normalidad (p-valor < 0.05), por lo que se decidió aplicar análisis de varianza no paramétrica de H de Kruskal-Wallis.
La aplicabilidad de la estadística no paramétrica a ciencias biológicas, agrícolas y técnicas fue demostrada por Herrera et al. (2012) y Núñez-Colín (2018). Los autores citados concluyeron que la falta de criterio o inexperiencia de muchos investigadores y estudiantes hace que no se realicen las pruebas preliminares para el cumplimiento de los estrictos supuestos de los análisis paramétricos, lo que lleva a conclusiones erróneas y contradicciones estadísticas.
La altura de los explantes fue en general uniforme, con un tamaño menor para los tratamientos WP y CIRGEBB a los 120 días, aunque este último sin diferencias también con el resto (Tabla 2).
Tabla 2. Altura de plantas in vitro de Macleania rupestris en diferentes medios de cultivo.
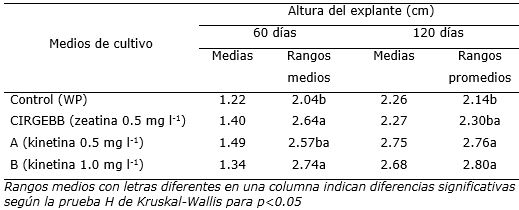
En los tratamientos con las citoquininas produjo un aumento en la altura de los explantes. El efecto de estos reguladores es dependiente de la especie vegetal y de la etapa de micropropagación (Castillo, 2004). El uso de citoquininas, en la propagación in vitro, tiene como objetivo, la interrupción de la dominancia de la yema apical, promover la inducción y proliferación de yemas axilares, por lo que la determinación de las concentraciones adecuadas y el tipo de citoquinina que debe usarse, son pasos de suma importancia (Ostrolucká et al., 2004; Erig y Schuch, 2006). Se ha generalizado en los trabajos in vitro el uso de zeatina y kinetina. Sin embargo, el alto costo de la zeatina la limita para un uso intensivo como regulador de crecimiento, aunque a pequeña escala su empleo está recomendado por ejemplo para iniciar el crecimiento de explantes (Reed y Abdelnour-Esquivel, 1991; Jiménez-Bonilla y Abdelnour-Esquivel, 2017). El costo de zeatina es un problema en laboratorios como el CIRGEBB en donde debe seleccionarse medios de cultivo que además de eficaces sean económicos. Por ello se busca conocer el efecto de otra citoquinina, como la kinetina, para reemplazar su uso.
Los resultados de la presente investigación coinciden con los referidos por Minchala et al. (2014) quienes evaluaron el uso de kinetina y obtuvieron mayor crecimiento de brotes de explantes de Tabebuia billbergii (Bureau & K. Schum.) Standl. (Bignoniaceae) cuando utilizaron 1.0 mg l-1.
Adicional al análisis estadístico realizado, al observar las características de las plántulas desarrolladas hasta los 120 días en los diferentes medios de cultivo (Figura 3), se pudo notar que las crecidas en el medio de cultivo con zeatina (Figura 3 D), presentaban hojas y brotes rojizos y de apariencia clorótica, así como entrenudos cortos, características no deseables para su uso como explantes en los procesos de micropropagación. Sin embargo, las plántulas obtenidas en los medios de cultivo con kinetina (Figura 3 B, C) se observaron más vigorosas, con hojas y tallos verdes, entrenudos separados y tipo ideal para la multiplicación.

Figura 3. Plántulas in vitro de Macleania rupestris a los 120 días de cultivo. A (Medio de cultivo WP Control), B (Medio de cultivo B, WP+kinetina 1.0 mg l-1), C (Medio de cultivo A, WP+kinetina 0.5 mg l-1), D (Medio de cultivo CIRGEBB, WP+zeatina 0.5 mg l-1).
Si se comparan las plántulas desarrolladas en los medios de cultivo B (WP+kinetina 1.0 mg l-1) y A (WP+kinetina 0.5 mg l-1), se observó un mejor tipo de plántulas en este último (Figura 3 C), ya que no solo eran de mayor altura, sino que poseían entrenudos más largos y mejor color, lo que las hace adecuadas como plántulas proveedoras de explantes para micropropagación.
El efecto de kinetina como regulador de crecimiento observado en la presente investigación coincide con el descrito por Cantos et al. (2018) al estudiar su aplicación en el crecimiento de plántulas de Coffea arabica L. (Rubiaceae), al igual con resultados significativamente superiores. De igual forma, Smanhotto y Biasi (2019) utilizaron kinetina y zeatina como reguladores de crecimiento en la micropropagación de Vaccinium virgatum Ait (Ericaceae) y concluyeron que bajo las condiciones de su estudio, los tratamientos con zeatina mostraron mejores respuestas en comparación con un medio de cultivo base Woody Plant.
Los resultados indicaron que los tratamientos aplicados influyeron de forma significativa sobre los valores de la variable número de brotes, con una mayor cantidad promedio en el medio de cultivo CIRGEBB (Tabla 3). Así mismo, en el tratamiento con el medio de cultivo B con 1.0 mg l-1 de kinetina el número de brotes fue mayor al obtenido en el control. Según Padilla (2008), la formación de brotes es una de las etapas fundamentales en la micropropagación ya que no solamente permite obtener un alto número de clones homogéneos, sino que también permite disminuir costos de producción, al momento de inducir a una planta in vitro que forme dos brotes, el costo de producción individual se reduce a la mitad. Es importante destacar que M. rupestris es una especie silvestre, no domesticada, que tiene un enorme potencial económico y social. Por ello, debe buscarse el método más adecuado para propagarla. No se ha obtenido éxito en el enraizamiento de estacas extraídas de las plantas provenientes de los ecosistemas naturales. Por tanto, todo aporte en su multiplicación contribuirá a su posible utilización.
Tabla 3. Número de brotes de plantas in vitro de Macleania rupestris obtenidos en diferentes medios de cultivo.
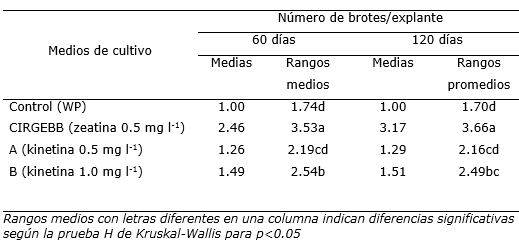
En contraste, Las características de las plántulas favorecieron a los tratamientos con kinetina (Figura 3), por lo que se puede decir que puede reemplazar el medio de cultivo CIRGEBB, ya que con este último se obtuvieron plantas que por sus características no son aptas para la micropropagación. Resultados similares fueron obtenidos por Ahmadi et al. (2011), al aplicar tratamientos con kinetina para la propagación in vitro de Matthiola incana (L.) W.T. Aiton (Brassicaceae), quienes observaron buenas características en las plántulas, así como número de brotes significativos.
En otra especie, también se apreció una respuesta similar de los explantes por Chamorro et al. (2007) quienes obtuvieron que la forma y tamaño de los brotes fueron de mejor calidad en el tratamiento con kinetina a 0.5 mg l-1 en Limonium var. Misty blue (Plumbaginaceae). Esta diferencia podría atribuirse a las diferentes citoquininas y las diferentes concentraciones que afectan e inciden en la formación de brotes, sumado a la relación auxina/citoquinina, sin olvidar la respuesta propia de la especie, determinada por sus características genéticas y su respuesta a las condiciones del medio de cultivo en el que se desarrollan (Bermúdez-Caraballoso et al., 2017).
Al igual que con las variables anteriores, a los 60 y 120 días de cultivo, el análisis de varianza mostró diferencias significativas (Tabla 4) entre los tratamientos para el número de hojas, con el mayor valor también para el medio de cultivo CIRGEBB. En este caso, cuantificar el número de hojas fue un método indirecto para evaluar el número de entrenudos en la multiplicación in vitro de M. rupestris teniendo en cuenta su correspondencia por la disposición de las hojas y que resultó más fácil sin necesidad de extraer las plantas del frasco.
Tabla 4. Número de hojas de plantas in vitro de Macleania rupestris a 60 y 120 días en diferentes medios de cultivo.
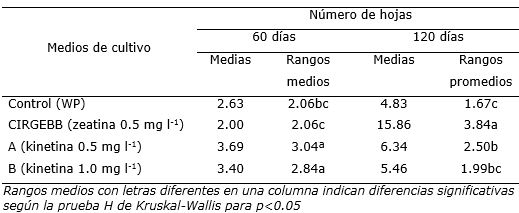
Sin embargo, al observar las características de las plántulas (Figura 3), se notó que aun cuando se formaron mayor cantidad de hojas en el medio de cultivo con zeatina, fueron de menor tamaño y de un color amarillo rojizo, lo que es desfavorable, si se compara con los tratamientos con kinetina, cuyas hojas se observan de mayor tamaño y de color verde. Esta vez no solo para la micropropagación, sino para otros usos de la hoja como explante o para fines de extracción de ADN.
En concordancia con estos resultados, el efecto de la zeatina sobre el crecimiento de brotes y el desarrollo foliar ha sido informado por otros autores. En este sentido, Urrea et al. (2009) al estudiar la micropropragación de Lippia dulcis Trevir. (Verbenaceae) concluyeron que los tratamientos con kinetina mostraron, no solo diferencias significativas favorables respecto al número de hojas, sino que además se obtuvieron hojas con el tamaño y vigor adecuados para la propagación. Un resultado similar también fue observado por Duhoky y Rasheed (2010) con Gardenia jasminoides. Igualmente, Brenes et al. (2015) obtuvieron diferencias significativas en el número de brotes de Vaccinium spp., al aplicar zeatina con una mayor producción de brotes y hojas, al igual que Jacinto (2018) al cultivar in vitro plántulas de Rosa sp.
CONCLUSIONES
Tanto el uso de zeatina como kinetina en el medio de cultivo WP permiten la multiplicación in vitro de M. rupestris. Sin embargo, la adición de zeatina favorece el desarrollo de las plantas con características fenotípicas adecuadas para la micropropagación. Atendiendo a los resultados se propone utilizar el medio de cultivo A (WP+kinetina 0.5 mg l-1).
AGRADECIMIENTOS
Los autores reconocen el valioso apoyo financiero brindado para la realización de la presente investigación al Proyecto 009-2016--INIA-PNIA/UPMSI/IE titulado “Domesticación de berries nativos de la región Cajamarca, relacionados al arándano, mediante el uso de herramientas biotecnológicas”.
Conflicto de interés
Todos los autores realizaron aportes significativos al documento y quienes están de acuerdo con su publicación y manifiestan que no existen conflictos de interés en este estudio.
REFERENCIAS
Abril DL (2010) Las ericáceas con frutos comestibles del altiplano Cundiboyacense. Tesis para optar al título de biólogo, Pontificia Universidad Javeriana, Bogotá, Colombia
Ahmadi A, Kaviani B, Tarang A, Bohlooli S (2011) Effect of different concentrations of kinetin on regeneration of ten weeks (Matthiola incana). Plant Omics Journal 4(5): 236-238
Alcántara GH (2011) Pendiente de los suelos del departamento de Cajamarca. Disponible en: http://zeeot.regioncajamarca.gob.pe/sites/default/files/Pendiente.pdf. Consultado 25/06/2019
Arellano AC, Korneva SB, Fische FC, Cabanilla L, Tola N, Ochoa A, Ramos-Leal M, Pincay A (2009) Micropropagación de caña de azúcar en Ecuador. Biotecnología Vegetal 9(4): 235-238
Barrios-Paternina E, Mercado-Gómez J (2014) Plantas útiles del corregimiento Santa Inés y la vereda San Felipe (San Marcos, Sucre, Colombia). Revista Ciencia en Desarrollo 5(2): 131-144
Bermúdez-Caraballoso I, Rodríguez M, Jiménez A (2017) Efecto del uso combinado de citoquininas en la formación de yemas adventicias en banano cv. ‘Gros Michel’ (Musa AAA). Biotecnología Vegetal 17(1): 51-56
Brenes A, Castillo R, Gómez-Alpízar L (2015) Micropropagación de cuatro cultivares de arándano (Vaccinium spp.) a partir de segmentos foliares de dos procedencias. Agronomía Costarricense 39(1): 7-23
Cantos G, Pinargote J, Palma R (2018) Influencia de la fitohormona kinetina en el crecimiento de plántulas de Coffea arabiga L. injertadas sobre patrón robusta en vivero. Revista cubana de ciencias forestales 6(2): 134-145
Castillo A (2004) Propagación de plantas in vitro: una biotecnología que nos acompaña hace mucho tiempo. Disponible en: http://www.inia.org.uy/publicaciones/documentos/lb/ad/2004/ad_382.pdf. Consultado 21/06/2019
Chamorro A, Martínez S, Fernández C, Mosquera T (2007) Evaluación de diferentes concentraciones de algunos reguladores de crecimiento en la multiplicación y enraizamiento in vitro de Limonium var. Misty blue. Agronomía Colombiana 25(1): 47-53
Córdoba SL, Guzmán JR, Pérez BA, Zúñiga PT, Pacheco RA (2010) Propagación de especies nativas de la región andina. Jardín Botánico José Celestino Mutis, Bogotá DC, Colombia
Dastmalchi K, Flores G, Petrova V, Pedraza-Peñaloza P, Kennelly EJ (2011) Edible Neotropical blueberries: antioxidant and compositional fingerprint analysis. Journal of Agricultural and Chemistry 59(7): 3020-3026; doi: 10.1021/jf200367j
Duhoky MMS, Rasheed KA (2010) Effect of Different Concentrations of Kinetin and NAA on Micropropagation of Gardenia jasminoides. Journal of Zankoy Sulaimani 13(1): 103-120
Durán-Casas S, Veloza-Suan C, Magnitskiy S, Lancheros HO (2013) Evaluation of uva camarona (Macleania rupestris Kunth A.C. Smith) propagation with air layering. Agronomía Colombiana 31(1): 18-26
Erig AC, Schuch MW (2006) Fatores que afetam a multiplicaçao in vitro de Mirtilo. Scientia Agraria 7(2): 83-88
Fernández SA (2012) Caracterización Morfológica de Cavendishia bracteata y Macleania rupestris (Ericaceae) en la sabana de Bogotá. Tesis para optar al título de biólogo, Pontificia Universidad Javeriana, Bogotá, Colombia
Fuchs EJ, Ross-Ibarra J, Barrantes G (2010) Reproductive biology of Macleania rupestris (Ericaceae), a pollen-limited Neotropical cloud-forest species in Costa Rica. Journal of Tropical Ecology 26: 351-354; doi:10.1017/S0266467410000064
González M, López M, Valdez, A, Ordas R (2000) Micropropagation of three Berry fruit species using nodal segments from field grown plants. Annals of Applied Biology 137(1): 73-78; doi:10.1111/j.1744-7348.2000.tb00059.x
Herrera M, Guerra CW, Sarduy L, García Y, Martínez CE (2012) Diferentes métodos estadísticos para el análisis de variables discretas. Una aplicación en las ciencias agrícolas y técnicas. Revista Ciencias Técnicas Agropecuarias 21(1): 58-62
Huamantupa I, Cuba ZM (2011) Tres nuevos registros de la familia Ericaceae para la flora peruana. Revista Q'EUÑA 4: 7-13
Jacinto ME (2018) Evaluación de tres niveles de auxinas y citoquininas para la obtención de plantas madre de rosa (Rosa sp.) variedad Freedom en condiciones in vitro. Revista Apthapi 4(2): 1073-1081
Jiménez-Bonilla V, Abdelnour-Esquivel A (2017) Protocolo de micropropagación de arándano nativo de Costa Rica (Vaccinium consanguineum). Tecnología en Marcha 31(1): 144-159; doi:10.18845/tm.v31i1.3504
Jiménez-Terry F, Agramonte D (2013) Cultivo in vitro y macropropagación como vía de sostenibilidad de la propagación de especies forestales. Biotecnología Vegetal 13(1): 3-21
Lagos-Burbano TC, Ordoñez-Jurado H, Criollo-Escobar H, Burbano S, Martínez Y (2010) Descripción de frutales nativos de la familia Ericaceae en el altiplano de Pasto, Colombia. Revista Colombiana de Ciencias Hortícolas 4(1): 9-18
Leiva S, Zapata M, Gayoso G, Chang L (2013) Frutas silvestres con potencial vitamínico de los Andes Centrales de América. Arnaldoa 20(2): 315-358
Lloyd G, McCown BH (1980) Commercially-feasible micropropagation of mountain laurel, Kalmia latifolia, by use of shoot tip culture. Combined Proceedings International Plant Propagators' Society 30: 421-427
Lozano NB, Valencia ML (1992) Anatomía floral de Macleania rupestris (HBK) AC SMITH (uva camarona). Agronomía Colombiana 9(1): 85-101
Luteyn JL, Pedraza P (2006) Blueberry relatives of the new world tropics (Ericaceae). Disponible en: http://sweetgum.nybg.org/science/projects/ericaceae/. Consultado 12/07/2019
Minchala J, Eras VH, Poma R, Yaguana M, Muñoz L, Delgado G (2014) Propagación in vitro de guayacán negro, Tabebuia billbergii (Bignoniaceae), a partir de explantes obtenidos de plántulas in vitro. Centro de Biotecnología 3(1): 6-14
Morales M, Øllgaard B, Kvist LP, Borchsenius F, Balslev H (2006) Botánica económica de los andes centrales. Disponible en: https://www.academia.edu/31617453/Botánica_Económica_de_los_Andes_Centrales_2006.pdf. Consultado 21/07/2019
Núñez-Colín CA (2018) Análisis de varianza no paramétrica: un punto de vista a favor para utilizarla. Acta Agrícola y Pecuaria 4(3): 69-79; doi:10.30973/aap/2018.4.3/1
Ortiz KE, Iñamagua WF (2019) Evaluación de métodos de propagación de Macleania rupestris (Joyapa) mediante la germinación de semillas y micropropagación de meristemas. Tesis para optar al título de Ingeniero Agrónomo, Universidad de Cuenca, Cuenca, Ecuador
Ostrolucká MG, Libiaková G, Ondrußková E, Gajdoßová A (2004) In vitro propagation of Vaccinium species. Acta Universitatis Latviensis Biology 676: 207-212
Padilla ED (2008) Evaluación de medios de cultivo para la micropropagación in vitro de orquídeas de las especies Cattleya spp. y Oncidium lanceanum en Tarapoto. Tesis para optar al título de Ingeniero Agrónomo, Universidad Nacional de San Martín, Tarapoto, Perú
Pennington J, Fisher R (2009) Classification of fruits and vegetables. Journal of Food Composition and Analysis 22(5): 23-31; doi:10.1016/j.jfca.2008.11.012
Pérez W (2006) Provincia de Chota. Disponible en: http://chota.webcindario.com/9_Datos_generales.htm. Consultado 10/06/2019
Rayas A, López J, Medero VR, Basail M, Santos A, Gutiérrez Y (2019) Conservación in vitro de cultivares de Ipomoea batatas (L.) Lam por crecimiento mínimo con el uso de manitol. Biotecnología Vegetal 19(1): 43-51
Reed BM, Abdelnour-Esquivel A (1991) The use of Zeatin to initiate in vitro cultures of Vaccinium species and cultivars. HortScience 26: 1320-1322
Salinas NR, Betancur J (2005) Las ericáceas de la vertiente pacífica de Nariño, Colombia. Acta biológica Colombiana 10(1): 98-99
Smanhotto C, Biasi LA (2019) In Vitro Establishment of ‘Delite’ Rabbiteye Blueberry Microshoots. Horticulturae 5(24): 1-14; doi:10.3390/horticulturae5010024
Tapia ME (2000) Origen y domesticación de las especies alimenticias en la región andina. Disponible en: http://www.fao.org/. Consultado 10/06/2019
Urrea AI, Castrillón PA, Monsalve Z (2009) Propagación in vitro y desdiferenciación tisular en Lippia dulcis. Actualidades Biológicas 31(90): 21-29
Valencia ML, Carrillo NM (1991) Anatomía del fruto de Macleania rupestris (HBK) AC Smith (uva camarona). Agronomía Colombiana 8(2): 286-305
Van den Eynden V, Cueva E, Cabrera O (2003) Wild Foods from Southern Ecuador. Economic Botany 57(4): 576-603; doi:10.1663/0013-0001(2003)057[0576:WFFSE]2.0.CO;2
Veloza C, Durán S, Magnitskiy S, Lancheros H (2014) Rooting ability of stem cuttings of Macleania rupestris Kunth A.C. Sm., a South American fruit species. International Journal of Fruit Science 14(4): 343-361; doi:10.1080/15538362.2014.897889
Recibido: 07-10-2019
Aceptado: 31-10-2019
Copyright (c) 2020 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
