Artículo original
Biotecnología Vegetal Vol. 20, No. 2: 104 - 112, abril - junio, 2020
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Influencia del sistema radical de plantas de Coffea arabica L. cv. Caturra rojo J-884, obtenidas por embriogénesis somática, durante la fase de conversión
Influence of the root system of Coffea arabica L. cv. Caturra rojo J-884 plants obtained by somatic embryogenesis, during the conversion phase
Raúl Barbón1*https://orcid.org/0000-0002-4284-0281
Nosleiby Ortiz1,2https://orcid.org/0000-0003-4990-4521
Alina Capote1https://orcid.org/0000-0003-1095-9664
Anabel Pérez1 https://orcid.org/0000-0002-3689-0792
1Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54 830.
2Estación Experimental Agro-forestal de Jibacoa. Rincón Naranjo, Jibacoa. Manicaragua. Villa Clara. Cuba. CP 54 590.
*Autor para correspondencia e-mail: raulb@ibp.co.cu
RESUMEN
El manejo del sistema radical de las plantas obtenidas por embriogénesis somática aumenta la eficiencia de su adaptación en condiciones de vivero. Este trabajo tuvo como objetivo determinar la influencia de las características del sistema radical de plantas de cafeto obtenidas por embriogénesis somática en la supervivencia y adaptación ex vitro de las plantas en vivero. Se utilizaron plantas de Coffea arabica L. cv. Caturra rojo J-884. Se conformaron dos tratamientos de manejo: plantas con poda total de la raíz y plantas con poda parcial de la raíz a una longitud de 1.5 cm. A los 180 días de cultivo se evaluaron diferentes variables morfo-fisiológicas. Se encontró que la presencia o no del sistema radical influyó en el desarrollo morfológico de plantas durante la fase de conversión en vivero. La supervivencia fue mayor en las plantas con poda parcial de sus raíces (91.8%) con respecto a las plantas con una poda total del sistema radical (76.8%). De igual forma, los valores en las variables morfológicas y fisiológicas evaluadas fueron mayores significativamente. Este manejo permite que no se desechen plantas obtenidas durante la fase de germinación que presenten alguna deformación provocada por el efecto físico del frasco de cultivo.
Palabras clave: adaptación ex vitro, embrión somático, índices fisiológicos, vivero
ABSTRACT
The management of the root system of the plants obtained by somatic embryogenesis increases the efficiency of their adaptation under nursery conditions.This work aimed to determine the influence of the characteristics of the root system of coffee plants obtained by somatic embryogenesis on the survival and ex vitro adaptation of plants in the nursery. Plants of Coffea arabica L. cv. Caturra Rojo J-884 were used. Two management treatments were established: plants with total root pruning and plants with partial root pruning to a length of 1.5 cm. At 180 days of culture, different morpho-physiological variables were evaluated. It was found that the presence or not of the root system influenced the morphological development of plants during the conversion phase in the nursery. Survival was higher in plants with partial pruning of their roots (91.8%) compared to plants with a total pruning of the root system (76.8%). Similarly, the values in the morphological and physiological variables evaluated were significantly higher. This management allows that plants obtained during the germination phase that show some deformation caused by the physical effect of the culture bottle are not discarded.
Keywords: ex vitro adaptation, morphology, nursery, physiological indices, somatic embryo
INTRODUCCIÓN
Entre las fases del proceso de la embriogénesis somática, la fase de conversión es una de las más importantes. Consiste en la supervivencia y desarrollo de propágulos en condiciones ambientales ex vitro en un determinado sustrato (Morales et al., 2009).
La adaptación de las plantas in vitro a condiciones ambientales ex vitro es uno de los puntos críticos del proceso para la obtención de plantas. Por ello, constituye una de las fases más importantes del proceso de embriogénesis somática. Esta es la fase final, de ahí que sea trascendental para la propagación comercial de plantas. Depende en gran medida de la eficiencia total del proceso durante la propagación in vitro que garantiza la adaptación de las plantas antes de ser llevadas a campo (Rodríguez et al., 2005). Especialmente, una adecuada fase de enraizamiento y mantener una buena humedad relativa en los primeros días de adaptación son clave para lograrla (Morales et al., 2009).
Por otra parte, la mayoría de trabajos de investigación se han basado en aumentar la formación de embriones somáticos, el porcentaje de germinación y la conversión en plantas, pero faltan esfuerzos de investigación en los aspectos fisiológicos y los procesos moleculares durante la fase de conversión (Yang et al., 2013).
Entre los desafíos que impiden la aplicación más amplia de la embriogénesis somática para la propagación clonal y la obtención de plantas de calidad están los bajos porcentajes de germinación de embriones somáticos y la conversión de las plantas en casa de cultivo y viveros (Afreen et al., 2002; Kumar et al., 2006; Barbón et al., 2014). Se ha logrado en cafeto hasta un 65% de conversión de embriones en plantas (Ducos et al., 2007) y es dependiente de factores como los sustratos utilizados, el genotipo y las condiciones ambientales.
En adición a lo anterior, durante la germinación de los embriones somáticos existe heterogeneidad en la longitud del sistema radical de las plantas, así como malformaciones producidas durante el crecimiento de las raíces en el espacio reducido de los frascos de cultivo, lo cual puede influir en la fase de conversión. En este sentido, investigaciones realizadas por Echeverría et al. (2014) demostraron la presencia de anormalidades en la fase de conversión, especialmente del sistema radical, en plantas de cafeto obtenidas mediante embriogénesis somática indirecta. Estas fueron evidentes después de la fase de germinación en sistemas de inmersión temporal tipo RITA®, en el cual se generaron deformaciones en la raíz principal y secundarias. Se constató una disminución de 70% en su masa fresca y 30% en la longitud del tallo, con respecto a las que mantenían una buena rectitud radical.
El éxito final de la propagación in vitro a escala comercial depende de la capacidad de regenerar plantas a bajo costo y con altas tasas de supervivencia (Chandra et al., 2010). A pesar de la factibilidad de reproducción clonal y vegetativa de los cultivares de cafeto a través de embriogénesis somática es necesario el perfeccionamiento de los procesos de selección y manejo para el adecuado desarrollo de las plántulas desde la fase de conversión o adaptación ex vitro, debido a que en condiciones de campo se ha observado mortalidad que se presume está asociada a problemas del sistema radical. La causa de este problema es el largo sistema radical de estas plantas que dificulta su correcto trasplante y desarrollo (Echeverría et al., 2014). Es por ello que el objetivo del siguiente trabajo fue determinar la influencia de las características del sistema radical de plantas de cafeto obtenidas por embriogénesis somática en la supervivencia y adaptación ex vitro en condiciones de vivero.
MATERIALES Y MÉTODOS
El ensayo se realizó en un vivero, ubicado en la zona del macizo de Guamuhaya (Villa Clara, Cuba).
Material vegetal
Plantas obtenidas por embriogénesis somática (Barbón et al., 2003) de Coffea arabica L. cv. Caturra rojo J-884 y con las características morfológicas según describieron Ortiz et al. (2017).
Caracterización morfofisiológica de las plantas según características del sistema radical
Se conformaron dos tratamientos de manejo: plantas con poda total de las raíces y plantas con poda parcial de las raíces a una longitud de 1.5 cm (Figura 1).
A las plantas sin presencia de raíces se les aplicó una mezcla compuesta por talco industrial y una solución inductora de la formación de raíces que contenía una mezcla de ácido indolacético (AIA), ácido indolbutírico (AIB) y ácido naftalenacético (ANA) a una concentración de 1.0 g l-1 cada uno. Todas las plantas seleccionadas de los diferentes tratamientos presentaban como mínimo de tres a cuatro pares de hojas.

Figura 1. Plantas de Coffea arabica L. cv. Caturra rojo J-884 obtenidas por embriogénesis somática con poda total y parcial del sistema radical.
Por cada tratamiento se emplearon 120 plantas. Para la adaptación ex vitro de las plantas se utilizaron tubetes (Propileno atóxico con AntiUV) de un volumen total de 180 cm3. El sustrato estuvo conformado por suelo Fersialítico pardo (categoría 2) y humus de lombriz en una relación 1:1.
Las condiciones del vivero durante el ensayo fueron de una temperatura promedio durante el día de 24.5±3.0 °C, 85% de humedad relativa y 224-457 μmol m-2 s-1 de intensidad luminosa determinada con un luxómetro (EXTECH Light meter, R.P. China). Durante los primeros 15 días de cultivo, en el vivero, se empleó una malla de color negro para obtener un 70% de sombreo y se retiró posteriormente para incrementar la luminosidad.
El riego se realizó por microaspersión con una frecuencia de cuatro veces al día (9.00, 11.00, 14.00 y 16.00 horas) y una duración de dos minutos cada riego. A las plantas también se les realizaron tres aplicaciones de fertilizante (NPK) en una proporción (7:14:7) diluido al 12%, una cada 60 días y en cada tubete se añadieron 20 ml al comienzo del cultivo.
A los 180 días de cultivo se evaluaron las siguientes variables:
- Supervivencia (%) se definió como el número de plantas vivas a los 15 días de cultivo en condiciones de vivero.
- Altura de las plantas (cm) desde la base del tallo hasta el ápice. Se realizó la medición con el empleo de una regla graduada.
- Diámetro del tallo de las plantas (cm). Se realizó la medición con el empleo de un Pie de Rey a 1 cm de altura de la base del tallo.
- Número de pares de hojas (u).
- Área foliar de las plantas (cm2). Se determinó según el método propuesto por Soto (1980) para cultivares de C. arabica L. basada en la fórmula siguiente:
AF (cm2) = largo de hoja x ancho de la hoja x 0.64 (referido a área foliar de todas las hojas nuevas formadas durante la adaptación ex vitro).
- Masa fresca (g) y seca (g) de hojas, tallo, raíz y total.
- Índices fisiológicos:
Tasa de Asimilación Neta: TAN = 2(P2-P1)/(A2+A1)(t2-t1) (g dm-2 día-1)
Tasa de Crecimiento Relativa: TCR = 2(P2-P1)/(P2+P1)(t2-t1)(g g-1día-1)
Tasa de Crecimiento absoluta: TAC = (P2-P1)/(t2-t1)(g día-1)
Índice de Área foliar (IAF): IAF = AF/A
Relación o razón de área foliar: RAF = 1/2(A1/P1+ A2/P2)(dm2 g-1)
Donde en la fórmula: P1 es la masa seca total (g) al inicio del cultivo, P2 es la masa seca total (g) a los 180 días de cultivo (t2), A1 es el área foliar al inicio del ensayo, A2 es el área foliar a los 180 días de cultivo, t1= 0 días y t2= 180 días, AF es el área foliar total y A es el área ocupada por la planta.
Análisis estadísticos
Se empleó del paquete estadística InfoStat versión 1.0 (2012). La comparación de los valores de las variables se realizó mediante una prueba paramétrica de Tukey o una prueba no paramétrica de Kruskal Wallis, con previa comprobación de los supuestos de normalidad y homogeneidad de varianza.
RESULTADOS Y DISCUSIÓN
La supervivencia de las plantas de Coffea arabica L. cultivar Caturra rojo J-884 obtenidas por embriogénesis somática, a las cuales se les realizó poda parcial de sus raíces (1.5 cm), fue mayor con diferencias significativas con respecto a las plantas con una poda total del sistema radical (Figura 2).

Figura 2. Supervivencia de plantas de Coffea arabica cv. Caturra rojo J-884 obtenidas por embriogénesis somática, con poda parcial (1.5 cm de longitud) y poda total del sistema radical, durante la fase de conversión en vivero a los 15 días de cultivo.
Se encontró que la presencia o no del sistema radical influyó en el desarrollo morfológico de las plantas durante la fase de conversión en vivero (Figura 3). En las plantas con parte del sistema radical se obtuvieron los mayores valores en las diferentes variables morfológicas evaluadas, con diferencias significativas con respecto al tratamiento donde se eliminaron las raíces (Tabla 1).

Figura 3. Plantas de Coffea arabica cv. Caturra rojo J-884, obtenidas por embriogénesis somática, en la fase de conversión en vivero a los 180 días de cultivo. (A) plantas con poda parcial del sistema radical (1.5 cm de longitud) y (B) plantas con poda total.
Tabla 1. Crecimiento y desarrollo de plantas de Coffea arabica L. cv. Caturra rojo J-884 procedente de embriogénesis somática con poda parcial y poda total del sistema radical, a los 180 días de cultivo en vivero.

A los 180 días de cultivo en las plantas con poda total y parcial del sistema radical se observó una correcta formación y desarrollo de las raíces sin presencia de malformaciones (Figura 4). Las plantas con poda total de las raíces produjeron varias raíces principales en el nuevo sistema radical formado y una de estas tomó la guía como raíz principal (Figura 4 a).
Los resultados corroboraron hallazgos previos de Georget et al. (2017) sobre la capacidad de enraizamiento de plantas de cafeto obtenidas por embriogénesis somática lo cual es un indicativo de rejuvenecimiento celular y posibilita incrementar la eficiencia del proceso de propagación por esta vía. En este sentido, estas dos formas de manejo pueden ser fundamentales para lograr disminuir la aparición de malformaciones en el sistema radical de las plantas de cafeto en el momento de la plantación en condiciones ex vitro (vivero o casa de cultivo). Permiten que la raíz se desarrolle de forma recta y sin malformaciones no deseadas.
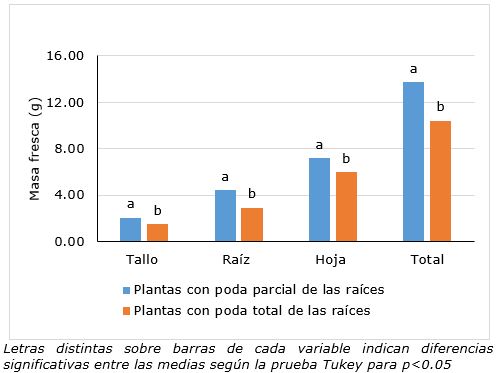
Figura 4. Sistema radical de plantas de Coffea arabica L. cv. Caturra rojo J-884 obtenidas por embriogénesis somática, a los 180 días de cultivo en vivero. A) Raíces de plantas con poda total B). Raíces de plantas con poda parcial (1.5 cm de longitud).
De forma similar como en cafeto, se han establecido procesos de selección y manejo del sistema radical en especies coníferas obtenidas por embriogénesis somática (Bonga, 2016). Por ejemplo, las compañías Bosque Genetics Ltd. y Arbogen en Nueva Zelanda producen anualmente más de 50 000 plántulas de Pinus radiata L. a las cuales le aplican manejos de cortes y enraizamientos para producir 2.5 – 3.0 millones de plantas por año.
Con la puesta en práctica de estas dos alternativas de manejo no hubo deformaciones en el sistema radical, como son las planteadas por Echeverría et al. (2014). Según estos autores, una de las problemáticas en vivero de las plantas de cafeto regeneradas por embriogénesis somática son las malformaciones, principalmente por enrollamientos, dobleces y engrosamientos cuando no hay poda de la raíz. Otro aspecto que se debe tener en cuenta es la altura de la planta para una fase de conversión exitosa (Barbón et al., 2014).
El tipo de manejo del sistema radical de las plantas procedente de embriogénesis somática de Coffea arabica L. cv. Caturra rojo J-884 en el momento de la plantación en condiciones de vivero también influyó en el incremento de la masa fresca y seca a los 180 días de cultivo (Figura 5, Figura 6).

Figura 5. Influencia del manejo del sistema radical en la masa fresca de las plantas de Coffea arabica L. cv. Caturra rojo J-884 obtenidas por embriogénesis somática, a los 180 días de cultivo en vivero.

Figura 6. Influencia del manejo del sistema radical en la masa seca de las plantas de Coffea arabica L. cultivar Caturra rojo J-884 obtenidas por embriogénesis somática, a los 180 días de cultivo en vivero.
Las plantas de cafeto obtenidas por embriogénesis somática que se plantaron en el vivero con poda parcial de sus raíces (1.5 cm de longitud) mostraron un mayor crecimiento reflejado en un mayor contenido de masa fresca y seca, con diferencia significativa con respecto al tratamiento con poda total del sistema radical. La masa fresca y seca de las plantas de los dos tratamientos influyó en los valores de los índices fisiológicos durante los 180 días de cultivo. En las plantas con poda parcial de la raíz se alcanzaron los mayores valores en los índices fisiológicos con diferencias significativas con el tratamiento de poda total de las raíces (Tabla 2).
Tabla 2.. Índices fisiológicos de plantas de Coffea arabica L. cv. Caturra rojo J-884 obtenidas por embriogénesis somática plantada con poda parcial (1.5 cm) y con poda total del sistema radical raíz en la fase de conversión a los 180 días de cultivo.

De igual forma, en las plantas con poda parcial se obtuvieron los mayores niveles de tasa de asimilación neta, como consecuencia del buen desarrollo foliar y un mayor incremento de la masa seca en el tiempo. En esta misma variante también se alcanzaron los mejores resultados en cuanto a la tasa de crecimiento relativo y absoluto por tener este tratamiento el mayor incremento en gramos de masa fresca y seca en el tiempo. Los altos valores del índice de área y razón foliar alcanzados en esta variante fueron debido a los altos valores de área foliar durante los 180 días de cultivo en la fase de conversión. Pocos son los estudios en los cuales se combina el análisis de variables morfológicas e índices fisiológicos en plantas de cafeto obtenidas por embriogénesis somática. El análisis de los índices fisiológicos permitió confirmar los resultados de supervivencia y adaptación ex vitro de las plantas de cafeto obtenidas por embriogénesis somática, independientemente del tipo de manejo de la raíz.
La aplicación de este manejo del sistema radical de las plantas obtenidas por embriogénesis somática aumenta la eficiencia para la propagación de plantas. Permite que no se desechen plantas obtenidas durante la fase de germinación que presenten alguna deformación provocada por el efecto físico del frasco de cultivo, el cual causa la curvatura del sistema radical.
CONCLUSIONES
Durante la fase de conversión en vivero de plantas obtenidas por embriogénesis somática, el sistema radical y su manejo tienen influencia en el desarrollo morfológico de las plantas. La poda parcial del sistema radical de las plantas posibilita una mejor respuesta en las variables morfológicas y fisiológicas con respecto a la eliminación del sistema radical.
AGRADECIMIENTOS
Esta investigación fue financiada en el marco del proyecto CITMA NACIONAL (P131LH001315): Escalado productivo en biofábrica de la metodología de embriogénesis somática en cafeto para la obtención de plantas in vitro con un óptimo crecimiento y desarrollo en condiciones de vivero y campo. Los financistas no tuvieron participación en el diseño del estudio, la investigación y el análisis de los datos, la decisión de publicar o la preparación del manuscrito.
Conflicto de interés
Los autores no declaran conflicto de intereses.
Contribución de los autores
Conceptualización: RB, NB; Conservación de datos: RB, NO, AC; An�lisis formal: RB, NB; Adquisición de fondos: RB; Investigación: RB, NO, AC, AP; Metodología: RB, NO; Recursos: RB, NO, AC, AP; Supervisión: RB; Validación: RB, NO; Visualización: RB, NO; Escritura -primera redacción: RB, NO; Escritura - revisión y edición: RB
REFERENCIAS
Afreen F, Zobayed SMA, Kozai (2002) Photoautotrophic culture of Coffea arabusta somatic embryos: development of a bioreactor for large‐scale plantlet conversion from cotyledonary embryos. Annals of botany 90(1): 21-29; doi:10.1093/aob/mcf151
Barbón R, Nguyen H, Capote A, de Feria M, Pérez A, Rivero L, Leiva M, O Hurtado (2014) Efecto de mezclas de sustratos en la fase de conversión de plantas de Coffea arabica L. cv. ‘Caturra rojo’ obtenidas por embriogénesis somática. Biotecnología Vegetal 14(4): 205-213
Barbón R, Jiménez E, Capote A (2003) Influencia del genotipo y la densidad de inoculación sobre la diferenciación de embriones somáticos de Coffea arabica L. cv. Caturra rojo y Coffea canephora cv. Robusta. Biotecnología Vegetal 3(3): 131-135
Bonga JM (2016) Conifer clonal propagation in tree improvement programs. En: Park YS, Bonga JM, Moon HK (eds). Vegetative propagation of forest trees Part 1: Development and trends in vegetative propagation of forest trees, pp. 3-31. NIFOS, Korea
Chandra S, Bandopadhyay R, Kumar V, Chandra R (2010) Acclimatization of tissue cultured plantlets: from laboratory to land. Biotechnol Lett 32: 1199-1205; doi:10.1007/s10529-010-0290-0
Ducos JP, Lambot C, Pétiard V (2007) Bioreactors for coffee mass propagation by somatic embryogenesis. International Journal of plant developmental biology 1(1): 1-12; doi:10.1007/s11627-007-9075-0
Echeverría F, Barquero M, Rodríguez D (2014) Estudio del desarrollo radical en almácigo de híbridos F1 de café obtenido por cultivo de tejidos. Agronomía Costarricense 38(1): 67-74
Georget F, Courtel P, Malo E, Hidalgo M, Alpizar E, Breitler JC, Bertrand B, Etienne H (2017) Somatic embryogenesis-derived coffee plantlets can be efficiently propagated by horticultural rooted mini-cuttings: A boost for somatic embryogenesis. Scientia Horticulturae 216: 177-185; doi:10.1016/j.scienta.2016.12.017
Kumar V, Naidu MM, Ravishankar GA (2006) Developments in coffee biotechnology— in vitro plant propagation and crop improvement. Plant cell, Tissue and organ culture, 87(1): 49-65; doi:10.1007/s11240-006-9134-y
Morales C, De la Fe C, Corbera J, Calaña JM (2009) Estudio de la aclimatización de vitroplantas de Anturio (Anthurium andreanum Lin.). Cultivos Tropicales 30(4): 48-51
Ortiz N, Barbón R, Capote A, Pérez A, Robaina M (2017) Caracterización morfológica en vivero de plantas de Coffea arabica L. cv Caturra rojo J-884 obtenidas por embriogénesis somática. Biotecnología Vegetal 17(4): 251-257
Ortiz N, Turiño M, Ferras Y, Meneses I (2014) Efectos de diferentes sustratos en el desarrollo de vitroplantas de Coffea arabica L. en fase de aclimatización. Café Cacao 13(1): 66-69
Rodríguez A, Rodríguez A A, Nodals B, Álvarez D, Estrada J, García X, Pompa C, Hernández A, Somonte R, Sánchez A (2005) Biotecnologías hechas a la medida para el desarrollo endógeno de la agricultura urbana en tres municipios de Cuba. Revista Agrotecnia de Cuba 1: 1-16
Sánchez A, Suárez E, Labarca C, Viloria Z, Albany N, Vílchez J, Bracho B (2007) Aclimatización de vitroplantas sin raíces de zábila (Aloe vera (L.) Burm. f.) de diferentes tamaños. Revista de la Facultad de Agronomía de La Universidad del Zulia 24(1): 67-72
Vázquez EB, Torres S G (2006) Fisiología Vegetal. Editorial Félix Varela, La Habana
Yang J, Zhao S, Yu C, Li C (2013) Large-scale plantlet conversion and ex vitro transplantation efficiency of siberian ginseng by bioreactor culture. The Scientific World Journal 2013 (1): 1-8; doi:0.1155/2013/829067
Recibido: 11-03-2020
Aceptado: 05-04-2020
Copyright (c) 2020 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
