Artículo original
Biotecnología Vegetal Vol. 20, No. 2: 113 - 128, abril-junio, 2020
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Caracterización química y bioactividad de metabolitos secundarios del tallo de Melochia villosa (Sterculiaceae)
Chemical characterization and bioactivity of secondary metabolites of the stem of Melochia villosa (Sterculiaceae)
Fátima Rodríguez1*https://orcid.org/0000-0002-3878-2269
Haydelba D’Armas2,3https://orcid.org/0000-0001-9301-3801
José Lanza4https://orcid.org/0000-0002-7155-4671
Mario Alcarraz5https://orcid.org/0000-0001-5262-2969
Vidalina Heredia6https://orcid.org/0000-0002-6556-5948
1Departamento de Ciencias, Unidad de Estudios Básicos, Núcleo de Monagas, Universidad de Oriente. Maturín. Estado Monagas. Venezuela. CP 6201.
2Departamento de Química, Escuela de Ciencias, Núcleo de Sucre, Cumaná, Universidad Oriente. Cumaná. Estado Sucre. Venezuela. CP 6101.
3Universidad Estatal de Milagro. Milagro. Provincia de Guayas. Ecuador. CP 091050.
4Viamed Technical Laboratory SPA. Santiago RM. Chile. CP 8320000.
5Laboratorio de Bioprocesos Industriales, Universidad Nacional Mayor de San Marcos. Lima. Perú. CP 51.
6Laboratorio de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos. Lima. Perú. CP 51.
*Autora para correspondencia e-mail: rodriguezffatima3@gmail.com
RESUMEN
Melochia villosa (Mill.) Fawc. & Rendle es una de las especies pertenecientes a la familia Sterculiaceae que fitoquímicamente ha sido muy poco estudiada. El objetivo de la investigación fue identificar metabolitos secundarios presentes en el tallo de M. villosa con propiedades de aplicación como posibles fármacos y contribuir con la quimiotaxonomía de la especie. Para la elucidación estructural se utilizaron técnicas como la espectroscopia infrarroja, resonancia magnética nuclear, y cromatografía de gases acoplada a espectrometría de masas. En el fraccionamiento cromatográfico del extracto alcohólico se obtuvieron nueve fracciones, de las cuales se realizaron ensayos con las fracciones 3, 5, 8 y 9. Las fracciones 3 y 9 mostraron actividad antifúngica contra Fusarium vercillioides y F. poae. Las fracciones 5 y 8 produjeron letalidad en nauplios de Artemia salina. Del fraccionamiento del extracto etéreo se obtuvieron ocho fracciones, en su mayoría con presencia de esteroles insaturados, donde las fracciones II, VII y VIII con actividad letal. Se evidenció la presencia del grupo carbonilo y el enlace éster, así como el éster diisoctilico del ácido 1,2-bencenodicarboxílico. También se observó la presencia del ácido hexadecanoico, éster mono (2-etilhexílico) del ácido 1,2-bencenodicarboxílico, éster undecílico del ácido undecanoico, así como colestan-3-ona y la spinasterona, ambos compuestos derivados de esteroles insaturados.
Palabras clave: ácido hexadecanoico, colestan-3-ona, Cromatografía de Gases acoplada a Espectrometría de Masas, elucidación estructural, Espectroscopía Infrarroja, éster undecílico del ácido undecanoico, Resonancia Magnética nuclear, spinasterona.
ABSTRACT
Melochia villosa (Mill.) Fawc. & Rendle is one of the species belonging to the Sterculiaceae family that has been little studied phytochemically. The objective of the research was to perform phytochemical analysis and characterization of the alcoholic and ethereal extracts of the stem of this species, in order to identify secondary metabolites present in this botanical part with properties of application as possible drugs, as well as contributing to the chemotaxonomy of the species. For structural elucidation, techniques such as infrared spectroscopy, nuclear magnetic resonance, and gas chromatography coupled to mass spectrometry were used. In the chromatographic fractionation of the alcoholic extract, nine fractions were obtained, of which only fractions 3, 5, 8 and 9 could be tested, with antifungal activity against Fusarium vercillioides, and F. poae for fractions 3 and 9 respectively. Fractions 5 and 8 produced lethality on nauplios of Artemia salina. Eight fractions were obtained from the fractionation of the ethereal extract, mostly with the presence of unsaturated sterols, where fractions II, VII and VIII lethal activity. The presence of the carbonyl group and the ester bond was evidenced, as well as the diisoctylic ester of 1,2-benzenedicarboxylic acid. The presence of hexadecanoic acid, mono-(2-ethylhexyl) ester of 1,2-benzenedicarboxylic acid, undecyl ester of undecanoic acid, as well as cholestan-3-one and spinasterone, both compounds derived from unsaturated sterols, were also observed.
Keywords: cholestan-3-one, Gas Chromatography coupled to Mass Spectrometry, hexadecanoic acid, Infrared Spectroscopy, Nuclear Magnetic Resonance, spinasterone, structural elucidation, undecyl ester of undecanoic acid.
INTRODUCCIÓN
En la literatura científica se han informado varias investigaciones fitoquímicas que indican que las plantas de la familia Sterculiaceae son una fuente de posibles metabolitos secundarios bioactivos. Por ejemplo, en una investigación realizada en Waltheria ovata Cav. se ha demostrado que el extracto etanólico de la raíz de esta especie presenta efecto antioxidante que supera a trolox y vitamina C (Herrera, 2016).
En relación con el género Helicteres, se informó la presencia de esteroles en los extractos de las hojas, tallos y frutos de la especie Helicteres baruensis Jacq; y polifenoles en todos los extractos. Además, se identificó un esterol a través de Espectroscopía Infrarroja (IR) y Espectroscopía de Resonancia Magnética Nuclear (RMN), cuya posible estructura es la del campesterol (Tarache, 2007). Recientemente, D’Armas et al. (2018) refirieron la presencia de alcaloides, saponinas, sesquiterpenlactonas, esteroles y terpenoides y una fuerte actividad letal contra larvas de Artemia salina Linnaeus 1978, en los extractos metanólicos de las parte aéreas de Helicteres guazumifolia Kunth.
Del género Melochia, las especies más investigadas han sido Melochia corchorifolia L. y Melochia tomentosa L. Algunos flavonoides y alcaloides ciclopeptídicos, como frangufolin, franganin y adouetin-y´ fueron encontrados en M. corchorifolia (Tschesche y Reutel, 1968). Sin embargo, para M. tomentosa se detectó la posible presencia de flavonoides y esteroles insaturados. Del fraccionamiento cromatográfico del extracto metanólico de las hojas de la misma especie se logró identificar los ácidos hexadecanoico y octadecanoico con sus respectivos esteres metílicos, y se aisló un derivado acetilado de un esterol a partir del extracto metanólico del tallo (Espinoza, 2010).
En la literatura científica consultada aparecen pocos estudios de naturaleza fitoquímica y biológica referentes a la especie Melochia villosa. En el análisis fitoquímico preliminar realizado a los extractos crudos de las hojas, tallo y flores de M. villosa se evidenció la presencia de esteroles insaturados y triterpenos pentacíclicos en todos los extractos, exceptuando el extracto alcohólico de las hojas, flavonoides solo en los extractos alcohólicos y fenilpropanoides en los extractos alcohólicos de las hojas y tallo. El extracto alcohólico del tallo mostró actividad antifúngica leve contra Fusarium poae, y actividad letal contra Artemia salina, con una CL50 de 10.00 µg ml-1, mientras que el extracto etéreo del tallo fue letal con una CL50 2.06 µg ml-1. Por su parte, el extracto alcohólico de las hojas mostró actividad antibacteriana contra cinco cepas bacterianas y actividad letalidad con CL50 de 74.68 µg ml-1 (D’Armas et al., 2013). Posteriormente, se informó la caracterización estructural del extracto alcohólico de las hojas de esta especie, donde se identificó por Cromatografía de Gases acoplada a Espectrometría de Masas (CG/EM) la presencia de varios ácidos grasos y algunos de sus esteres, con la presencia dominante del ácido hexadecanoico que fue además aislado e identificado en la subfracción B2 de dicho extracto mediante RMN H1 y C13 (Rodríguez et al., 2015).
Teniendo en cuenta la evidencia previa de la actividad biológica mostrada especialmente por los extractos crudos del tallo de la especie (D’Armas et al., 2013), el objetivo de este trabajo fue identificar metabolitos secundarios presentes en el tallo de M. villosa con propiedades de aplicación como posibles fármacos y contribuir con la quimiotaxonomía de la especie. Para ello se decidió realizar el fraccionamiento cromatográfico de los extractos alcohólico y etéreo del tallo de M. villosa y profundizar en la caracterización estructural y bioactividad de algunas fracciones como posible fuente de metabolitos secundarios bioactivos en esta importante parte botánica de la especie.
MATERIALES Y MÉTODOS
Material vegetal
Ejemplares adultos de M. villosa recolectados en Puerto Ayacucho, Estado Amazonas, Venezuela.
Obtención de extractos
El material vegetal del tallo de M. villosa fue separado de los otros órganos de la planta y posteriormente molido en un molino eléctrico. Seguidamente, los extractos fueron obtenidos mediante extracción simple. El material vegetal se dejó en remojo durante 48 horas primeramente en etér dietílico y luego en una mezcla 1:1 metanol:etanol. Finalmente el líquido fue filtrado y el solvente evaporado a presión reducida, según la metodología aplicada por D’Armas et al. (2013).
Fraccionamiento cromatográfico
Extracto alcohólico del tallo (EALT)
El EALT fue fraccionado mediante Cromatografía de columna (CC). Se utilizó una columna cromatográfica de 35 cm de altura, con un diámetro de 2.4 cm, rellena con sílica gel de diámetro 5-70 mesh (0.2-0.5 mm) como fase estacionaria, en una relación extracto-sílica de 1:60, y como fase móvil solventes como hexano, diclorometano, acetato de etilo, metanol y las respectivas mezclas de estos variando la polaridad en orden creciente. Seguidamente, se empleó la cromatografía en capa fina (CCF) sobre placas de vidrio de 20 x 20 cm2, recubiertas con sílica gel tipo GF con un espesor de 0.5 mm, y placas de aluminio recubiertas con sílica gel e indicador de fluoresceína. Se utilizó la luz ultravioleta de onda corta (100-280 nm) y una solución ácida de molibdato de amonio al 10% en H2SO4 al 5% como agentes reveladores. Ocasionalmente, se utilizó la cromatografía en capa fina preparativa (CCFP) sobre placas de vidrio de 20 x 20 cm2, recubiertas con sílica gel tipo GF con un espesor de 0.1 mm, para subfraccionar y lograr el aislamiento de algún compuesto.
Extracto etéreo del tallo (EET)
El extracto en éter dietílico de M. villosa fue separado mediante CC, en una columna de 25 cm de altura con un diámetro de 0.8 cm, y se fraccionaron 250 mg del extracto en una relación 1:30 extracto-sílica (35-70 mesh), utilizando eluyentes como éter de petróleo, cloroformo, acetato de etilo y metanol, y la subfracción III (50 mg) se separó por CCFP, en una placa de vidrio de 20 x 20 cm2, recubierta con sílica gel tipo GF con un espesor de 1 mm, y como fase móvil una mezcla 1:1 éter de petróleo-cloroformo. Se utilizó la luz ultravioleta de onda corta (100-280 nm) y solución ácida al 10% en H2SO4 al 5% en molibdato de amonio como agentes reveladores.
Pruebas químicas y biológicas
Detección de esteroles insaturados y/o triterpenos pentacíclicos
Ante la evidencia existente de presencia de esteroles insaturados y flavonoides en los extractos crudos del tallo de M. villosa (D’Armas et al., 2013), se aplicó prueba de detección de estas familias de metabolitos a la mayoría de las fracciones provenientes del EET según la metodología de Marcano y Hasegawa (2002).
Actividad antifúngica
En función de la evidencia previa de actividad antifúngica del EALT de M. villosa contra Fusarium poae (D’Armas et al., 2013), se ensayó la actividad antifúngica contra cuatro cepas distintas de hongos (Mucor racemosus Fres., Tricoderma viride Pers ex S. F Gray., Fusarium poae (Peck) Wollenw., y Fusarium verticillioides Sacc), proporcionados por el laboratorio de Fitopatología y Microbiología del Departamento de Biología de la Universidad de Oriente, Núcleo de Sucre, Venezuela. Para ello se utilizó la metodología de Madubunyi (1995).
Actividad letal contra Artemia salina
Tomando como evidencia previa la actividad letal mostrada por los extractos crudos del tallo de M. villosa que fueron observadas por D’Armas et al. (2013) se evaluó el nivel de toxicidad de algunas fracciones provenientes de los extractos alcohólico y etéreo del tallo de la especie fraccionados en este trabajo. Se utilizó el crustáceo A. salina y se aplicó la metodología propuesta por Meyer et al. (1982). La concentración letal media (CL50) se determinó mediante un programa estadístico (métodos Binomial, Probit y Logit) propuesto por Stephan (1977).
Caracterización estructural
Para el análisis por IR, los compuestos separados se disolvieron en cloroformo (CHCl3) u otro solvente según su polaridad, se colocaron en celdas de cloruro de sodio (NaCl) y se analizaron en un espectrofotómetro de infrarrojo FTIR16PC (Perkin Elmer). Los resultados fueron comparados con las frecuencias de vibración y estiramiento características de cada grupo funcional.
La CG/EM se realizó utilizando un cromatógrafo de gases (Hewlett- Packard HP, modelo 5890, serie II), acoplado a un espectrómetro de masas de la misma marca (modelo 5971 A), y la identificación de los compuestos se realizó mediante la comparación con los espectros de masa existentes en la base de datos y biblioteca NIST 2008 del Laboratorio de Química Ambiental de la Universidad Simón Bolívar, Caracas, Venezuela.
En el análisis RMN, las muestras fueron disueltas en un solvente deuterado según su solubilidad y se colocaron en un tubo de resonancia, posteriormente sometido a un campo magnético dentro del equipo de RMN. Para tal fin, se utilizó un equipo de RMN (Bruker AM 300) (frecuencia de resonancia 1H = 300 MHz) perteneciente al Instituto Venezolano de Investigaciones Científicas (IVIC). Los desplazamientos obtenidos (δH y δC) se informaron en partes por millón (ppm), en relación con un estándar interno de tetrametil silano (TMS), y el cálculo teórico del espectro RMN de la molécula se realizó utilizando el programa RMN Predictor para 1H y 13C.
RESULTADOS Y DISCUSIÓN
Fraccionamiento cromatográfico
Extracto alcohólico del tallo (EALT)
Del fraccionamiento cromatográfico de 1.2 g del EALT se obtuvieron nueve fracciones, de las cuales se analizó la fracción 3 mediante IR y CG/EM. Por su parte, la fracción 5 por haber sido obtenida en mayor cantidad (73.3 mg), fue subfraccionada en una columna cromatográfica de 22 cm de altura, con un diámetro de 0.5 cm, en una relación fracción-sílica 1:30, y se obtuvieron cinco subfracciones que posteriormente se ensayaron con una CCF. En la subfracción 5.1 se constató la presencia de una mezcla poco compleja de compuestos que no lograron separarse, y otra mancha de un presunto compuesto aislado con un Rf de 0.80; por lo que se aplicó una CCFP en la que se utilizó sílica gel tipo GF en placas de 1.0 mm de espesor, y una mezcla diclorometano-AcOEt 4:1 como fase móvil, y se logró aislar el compuesto (Tabla 1). Finalmente se realizó una CG/EM a la subfracción 5.1.1 (banda que se fue con el solvente), y un análisis de RMN de 1H y 13C al compuesto aislado (subfracción 5.1.2).
Tabla 1. Subfracciones obtenidas del fraccionamiento cromatográfico de la subfracción 5.1 del EALT de Melochia villosa mediante Cromatografía en capa fina preparativa (CCFP).

Extracto etéreo del tallo (EET)
Del fraccionamiento cromatográfico de 250 mg EET se obtuvieron ocho fracciones, en su mayoría con muy poco rendimiento. En tal sentido, solo fue posible realizar el subfraccionamiento de la fracción III (50.3 mg) mediante una CCFP, en la que se observó la separación de dos franjas diferentes con Rf de 0.14 y 0.58 respectivamente (subfracciones III.1 y III.2), las cuales no pudieron recuperarse en cantidad suficiente para ser analizadas, mientras de la subfracción III.3 se obtuvieron 7 mg que posteriormente se analizaron mediante IR y CG/EM para su elucidación estructural. El resto de las fracciones provenientes de este extracto, fueron ensayadas en su mayor parte mediante las pruebas fitoquímicas para la detección de metabolitos secundarios, así como también se logró ensayar la letalidad de las fracciones II, VII y VIII con A. salina.
Pruebas químicas y biológicas
Detección de esteroles insaturados y/o triterpenos pentacíclicos
Según las pruebas fitoquímicas aplicadas, se detectó la presencia de esteroles insaturados en todas las fracciones EET (IV, V, VI, VII, VIII) que se lograron ensayar. Esto indicó que dicha familia de metabolitos probablemente está presente en buena proporción en todas las fracciones del extracto. Sin embargo, los flavonoides estuvieron ausentes.
Actividad antifúngica
La evaluación de la actividad antifúngica de las fracciones 3 y 9 del EALT evidenciaron actividad antimicrobiana moderada contra las cepas de F. verticilliodes y F. poae, respectivamente (Tabla 2). Esto indicó, que probablemente los compuestos presentes en las mencionadas fracciones poseen algún efecto antifúngico contra estas especies de Fusarium. El aumento en la actividad de estas fracciones con respecto al extracto crudo del cual provienen (D’Armas et al., 2013) pudiera deberse a un efecto antagónico sufrido por interacción del compuesto activo con otros metabolitos presentes en el mismo extracto, o en su defecto, un efecto de concentración, es decir, la concentración del metabolito activo aumenta en la totalidad de la muestra (fracción) al ser separado de otros.
Estudios previos han demostrado el efecto antifúngico de extractos polares y apolares de otras especies pertenecientes a la familia Sterculiaceae, como por ejemplo H. guazumifolia (D’Armas et al., 2018) y Helicteres isora L. (Pandey et al., 2015), al inhibir el crecimiento de cepas de hongos (Aspergillus oryzae (Ahlburg), Curvularia lunata (Wakker), Mucor sp., Candida albicans, entre otros).
Tabla 2. Actividad antifúngica de fracciones provenientes del extracto alcohólico (EALT) del tallo de Melochia villosa (Mill.) Fawc. & Rendle.

Actividad letal contra A. salina
Respecto a la letalidad de fracciones de los extractos alcohólico y etéreo del tallo de M. villosa, la 5, 8 y 9 del EALT, así como las fracciones II, VII y VIII del EET, evidenciaron actividad letal o tóxica contra A. salina (CL50 <1000.0 μg ml-1) a las 48 h de exposición (Tabla 3). Posiblemente estas fracciones provenientes de ambos extractos del tallo de dicha especie, sean una fuente de metabolitos con propiedades promisorias para la inhibición del crecimiento de células cancerígenas. Se conoce que este bioensayo tiene correlación con actividades citotóxicas (Meyer et al., 1982; McLaughlin et al., 1988). Por ello, este resultado sugiere la presencia de algún agente citotóxico potencial en M. villosa, como en otros extractos de la familia Sterculiaceae (Li et al., 2016; Dayal et al., 2017).
Tabla 3. Letalidad de las fracciones de extractos del tallo de Melochia villosa (Mill.) Fawc. & Rendle sobre Artemia salina Linnaeus.

Caracterización estructural
Metabolitos secundarios presentes en el EALT
Análisis de IR de la fracción 3
El análisis de IR de la fracción 3 mostró las bandas asignadas al streching característico de los enlaces C-H alifáticos en la región comprendida entre 3019 y 2854 cm-1, la banda del enlace carbonilo C=O a los 1719 cm-1, a los 1215 cm-1 la banda correspondiente del enlace C-O del grupo éster, y una banda intensa asignada a los estiramientos de los enlaces CH2 de una cadena alifática a los 758 cm-1 (Figura 1).
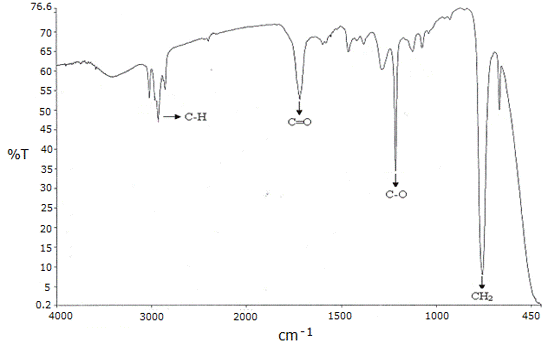
Figura 1. Espectro IR de la fracción 3 proveniente del extracto alcohólico del tallo de Melochia villosa.
Análisis de CG/EM de la fracción 3
La fracción 3 se observó como un sólido color naranja muy opaco, siendo esta una de las fracciones más limpias y poco contaminadas. En el análisis posterior de CG/EM (Figura 2) se encontró la separación de cuatro compuestos, de los cuales el éster diisoctilico del ácido 1,2-bencenodicarboxílico fue el componente mayoritario y los ésteres 2-metilpropil-butilico y metílico butílico del mismo ácido fueron los componentes en menor cantidad (Tabla 4). El espectro de masas del éster diisoctilico del ácido 1,2 bencenodicarboxílico produjo un ion molecular a una relación m/z de 390, poco observable por lo que se asume que se trata de un ion poco estable. Además, se lograron detectar las señales correspondientes a m/z 279, 167, 149 y 57 (Figura 3).
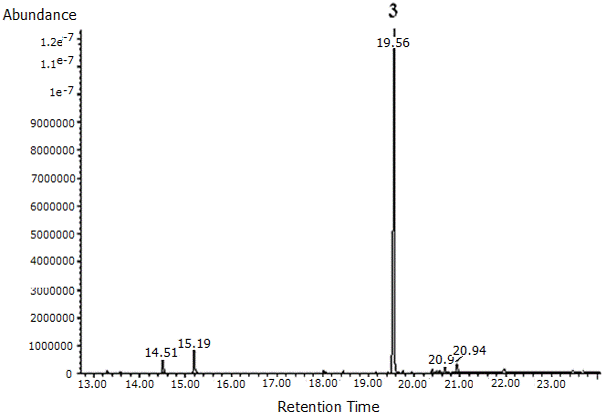
Figura 2. Cromatograma de la separación de los componentes que integran la fracción 3 del extracto alcohólico del tallo de Melochia villosa, obtenido mediante CG/EM.
Tabla 4. Composición química de la fracción 3 del extracto alcohólico del tallo de Melochia villosa.

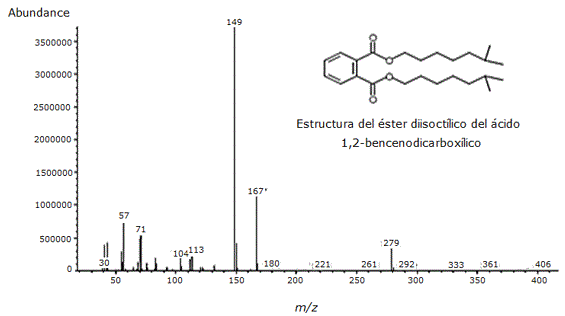
Figura 3. Espectro de masas del éster diisoctílico del ácido 1,2-bencenodicarboxílico identificado como compuesto mayoritario de la fracción 3 del extracto alcohólico del tallo de Melochia villosa a un tiempo de retención 19.559.
Del fraccionamiento cromatográfico del extracto alcohólico de las hojas de M. villosa, en el análisis de CG/EM de la subfracción C2 se identificaron varios ftalatos, entre los que se encontraba el DBP como compuesto mayoritario (Rodríguez et al., 2015), por lo que se podría decir en forma general, que este tipo de compuestos se encuentra presente en las distintas partes botánicas de dicha especie. A pesar de que los ftalatos son petroquímos utilizados como plastificantes o disolventes en una variedad de productos industriales (Namikoshi et al., 2006), han sido informados en la literatura científica como metabolitos secundarios aislados en forma natural, y se ha encontrado su presencia en distintas plantas como Aloe vera L., Euphorbia cyparissias L. y Euphorbia seguieriana Neck. (Rowshanul y Rezaul, 2009). Además, el contenido de la abundancia natural de 14C en el dibutil ftalato (DBP) de Laminaria japonica Aresh. y Undaria pinnatifida (Harv), dos algas pardas, y Ulva sp., un alga verde, reveló que este compuesto se produce en forma natural, además de encontrarse que el contenido de 14C del di-(2-etilhexil) ftalato obtenidos de las algas estaba entre 60-80% (Namikoshi et al., 2006). Otro estudio refirió la presencia del DBP como metabolito secundario aislado de Mimusops elengi Linn (Ruikar et al., 2011). Por su parte, en la caracterización estructural de Whalteria berteroi (Spreng.) J.G. Saunders (Sterculiaceae) fueron encontrados el ácido 1,2-bencenodicarboxílico y algunos de sus ésteres como el éster di-(2-etilhexilico) y el éster diisooctílico del mismo ácido en su extracto alcohólico (Salazar, 2012).
Análisis de CG/EM de la subfracción 5.1.1
De la subfracción 5.1.1, se lograron identificar mediante CG/EM cinco compuestos presentes en distinta cantidad, de los cuales tres de ellos se encontraron en mayor abundancia. Los compuestos en menor proporción identificados en la subfracción 5.1.1 fueron los ésteres metílico y etílico del ácido hexadecanoico (Tabla 5, Figura 4).
Tabla 5. Composición química de la subfracción 5.1.1 del extracto alcohólico del tallo de Melochia villosa.

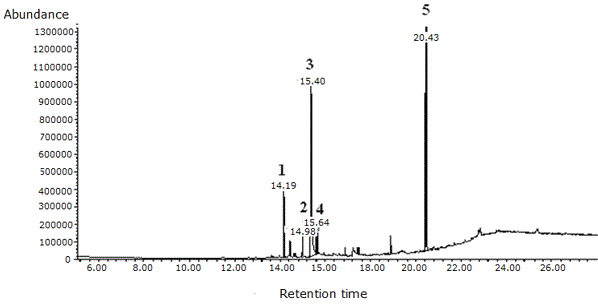
Figura 4. Cromatograma del fraccionamiento de la subfracción 5.1.1 del extracto alcohólico del tallo de Melochia villosa obtenido mediante CG/EM.
Cabe destacar que los compuestos de mayor abundancia identificados en este análisis, fueron también encontrados en la fracción B1 del extracto alcohólico de las hojas (EALH) de M. villosa (Rodríguez et al., 2015), lo cual sugiere que están presentes en ambas partes de la planta.
El espectro de masas del éster metílico del ácido hexadecanoico (Figura 5), mostró un pico a m/z 270 correspondiente al ion molecular de dicho éster, de fórmula molecular C17H34O2, un pico base a m/z 74 y los picos correspondientes a los fragmentos más abundantes a m/z 227, 143, 87 y 55 respectivamente.

Figura 5. Espectro de masas del éster metílico del ácido hexadecanoico identificado en el extracto alcohólico del tallo de Melochia villosa y separado en el tiempo de retención de 14.980.
Por su parte, el espectro de masas del éster etílico del ácido hexadecanoico (Figura 6), exhibió el pico propio del ion molecular correspondiente a la fórmula de dicho compuesto (C18H36O2) a m/z 284; un pico base a m/z 88, y se observaron también los picos correspondientes a los fragmentos más abundantes a m/z 241, 157, 101, 73 y 55.

Figura 6. Espectro de masas del éster etílico del ácido hexadecanoico identificado en el extracto alcohólico del tallo de Melochia villosa y separado al tiempo de retención de 15.398.
Análisis de RMN de la subfracción 5.1.2
El análisis de RMN 1H de la subfracción 5.1.2, evidenció cinco señales correspondientes a los distintos tipos de protones presentes en el compuesto estudiado, así como también se observó la señal correspondiente al solvente. En la ampliación del RMN 1H, a un desplazamiento δH 0.83 ppm se observó un triplete correspondiente al acoplamiento de los protones del grupo metilo -CH3 terminal (H11 y H22), un multiplete muy intenso a un δH de 1.27 ppm, asignado a los metilenos (–CH2-)n de la zona alifática (H4-H20 y H13-H21), a los 1.59 ppm un multiplete correspondiente al protón metilénico –CH2-CH2-COO- correspondiente al carbono 3 de la molécula (H3), un triplete al δH 2.27 ppm, asignado al protón metilénico –CH2-COO- adyacente al grupo carbonilo (H2) y finalmente un triplete correspondiente a un protón metilénico adyacente a un oxígeno –COO-CH2-(H12) a un desplazamiento químico de 4.03 ppm (Figura 7, Tabla 6).
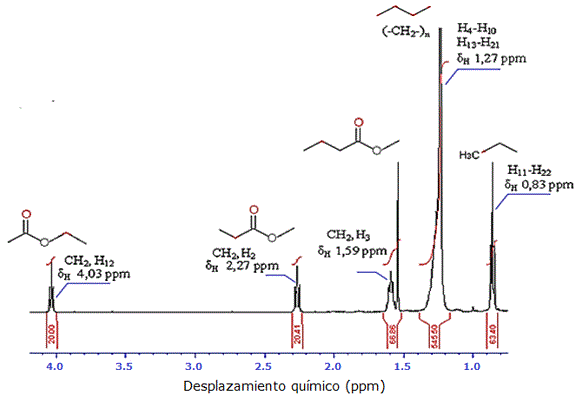
Figura 7. Espectro RMN 1H de la subfracción 5.1.2. del extracto alcohólico del tallo de Melochia villosa.
Tabla 6. Desplazamientos químicos δH del espectro RMN de 1H de la subfracción 5.1.2. del extracto alcohólico del tallo de Melochia villosa.
El espectro de RMN de 13C de este compuesto (Figura 8), mostró una señal a un δC de 15 ppm correspondiente a los carbonos de los grupos metílicos terminales de la molécula (-CH3) (C11 y C22), una señal a los 23 ppm asignada a los carbonos metilénicos adyacentes a los metilos terminales (CH3-CH2-) (C10 y C21). Además, un pico muy intenso correspondiente a los carbonos metilénicos de la zona alifática de la molécula a un desplazamiento químico δC de 30 ppm, una señal a un δC de 32 ppm asignada a los carbonos metilénicos (-CH2-) C9 y C20 del compuesto; otra señal a los 35 ppm, correspondiente al carbono metilenico –CH2-COO- adyacente al grupo carbonilo (C2); un desplazamiento químico a δC de 65 ppm asignado al carbono metilénico COO-CH2- adyacente al oxígeno del grupo éster (C12); así como también, se evidenció a campo bajo la señal correspondiente al carbono carbonílico de la molécula -COO-(C1) con desplazamiento quimico δC de 174 ppm. Dicha información se confirmó con el experimento DEPT-135 de RMN en dos dimensiones, el cual además dio indicios de tratarse de una molécula simétrica con los metilos terminales superpuestos y el grupo éster en el centro (Figura 9, Tabla 7).
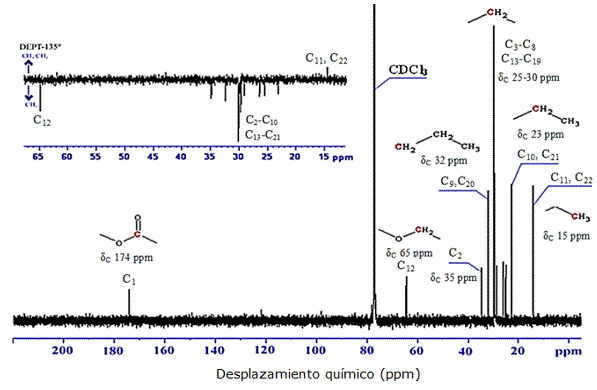
Figura 8. Espectro de RMN de 13C incluyendo espectro bidimensional DEPT-135 de la subfracción 5.1.2 del extracto alcohólico del tallo de Melochia villosa.
Tabla 7. Desplazamientos químicos δC del espectro RMN 13C de la subfracción 5.1.2 del estracto alcohólico del tallo de M. villosa.
En el análisis de RMN para 1H y 13C de la subfracción 5.1.2 del EALT de M. villosa se confirmó que dicho espectro corresponde a un éster alifático de 22 átomos de carbono con estas características, identificado como éster undecilico del ácido undecanoico (Figura 9).

Figura 9. Estructura del éster undecilico del ácido undecanoico identificado de la subfracción 5.1.2 del extracto alcohólico del tallo de Melochia villosa mediante RMN H1 y C12.
En estudios realizados anteriormente a otras plantas de la familia Sterculiaceae, se encontró la presencia de algunos ésteres de ácidos grasos, tales como el éster metílico del ácido pentadecanoico, en el extracto metanólico de Helicteres guazumifolia (Vásquez, 2010); los ésteres metílicos de los ácidos octadecanoico e icosanoico en M. tomentosa (Espinoza, 2010), así como también se identificó la presencia del éster metílico del ácido hexadecanoico en ambas especies, y los ácidos dodecanoico, tetradecanoico, hexadecanoico, heptadecanoico y octadecanoico como compuestos principales de la especie Whalteria berteroi (Salazar, 2012). Por su parte, en el extracto alcohólico de las hojas de M. villosa fueron identificados varios ácidos grasos de los cuales el ácido hexadecanoico fue el más abundante (Rodríguez et al., 2015). Los ésteres etílicos de ácidos grasos se utilizan junto con cambios en el estilo de vida (dieta, adelgazamiento y ejercicio) para reducir la cantidad de triglicéridos (sustancias grasas) en la sangre. Los ésteres etílicos de ácidos omega 3 pertenecen a una clase de medicamentos denominados agentes antilipémicos o reguladores de los lípidos, puesto que es posible que dichas sustancias actúen al reducir la cantidad de triglicéridos y otras grasas que se producen en el hígado (Medline Plus, 2019).
En estudios previos realizados al extracto alcohólico (EALT) del tallo de M. villosa se detectó la presencia de esteroles insaturados y/o triterpenos pentaciclicos, además de flavonoides y fenilpropanoides, con actividad letal contra A. salina y una CL50 de 10.00 µg ml-1 a las 48 horas, y una leve actividad antifúngica contra Fusarium poae (D’Armas et al., 2013). Atendiendo a ello se presume que este tipo de metabolitos pudo haber quedado en las fracciones que no lograron ser analizadas mediante las técnicas espectroscópicas utilizadas, y en menor proporción el extracto alcohólico, tal vez debido a su naturaleza poco polar.
Metabolitos secundarios presentes en el extracto etéreo del tallo (EET) de M. villosa.
Análisis IR de la subfracción III.3
El espectro de IR de la sufracción III.3 mostró las bandas asignadas a los estiramientos propios de los enlaces CH alifáticos a los 3018 y 2851 cm-1; a los 1714 cm-1, se observó una banda correspondiente a las vibraciones del grupo carbonilo C=O, los estiramientos característicos del enlace C-O del grupo éster a los 1215.49 cm-1, y finalmente una banda bastante intensa a los 758 cm-1 que corresponde a los CH2 de una cadena alifática (Figura 10).
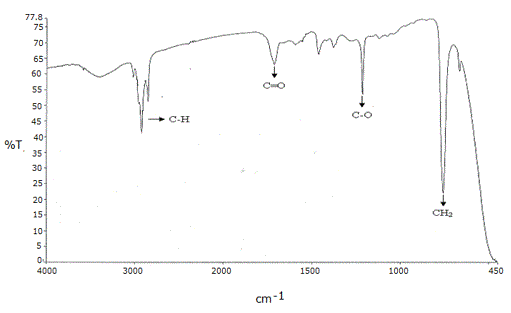
Figura 10. Espectro de IR de la subfracción III.3 proveniente del extracto etéreo del tallo de Melochia villosa.
Análisis de CG/EM de la subfracción III.3
El análisis de CG/EM de la subfracción III.3, reveló la presencia de 6,10,14-trimetil-2-pentadecanona, 4,8,12,16-tetrametilheptadecan-4-olido y los ésteres di-butílico y mono (2-etilhexilico) del ácido 1,2-bencenodicarboxílico. De igual forma, fueron también separados e identificados, el éster 2-hidroxi-1metilpropilico del ácido octadecanoico, colestan-3-ona y spinasterona (Figura 11, Tabla 8).

Figura 11. Cromatográfica de gases de los componentes de la subfracción III.3 del extracto etéreo del tallo de Melochia villosa.
Tabla 8. Composición química de la subfracción III.3 del extracto etéreo del tallo de Melochia villosa.

Los compuestos colestan-3-ona y spinasterona, poseen como estructura núcleo el sistema policíclico del ciclopentanoperhidrofenantreno, típico de compuestos pertenecientes al grupo de esteroles insaturados (Figura 12), por lo que ambas moléculas probablemente deriven de su correspondiente esterol, lo cual confirma la presencia de este tipo de metabolitos secundarios en el tallo M. villosa, tal y como se evidenció en las pruebas químicas realizadas. De acuerdo con lo observado en los estudios fitoquímicos en otras plantas pertenecientes a la familia Sterculiaceae, se presume que esta familia de metabolitos secundarios es característica en las plantas de esta familia.
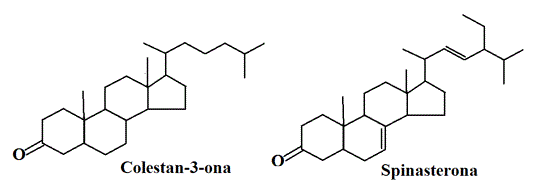
Figura 12. Estructuras de: colestan-3-ona y spinasterona, identificados en la subfracción III.3 del extracto etéreo del tallo de Melochia villosa.
CONCLUSIONES
El tallo es uno de los principales órganos de Melochia villosa que podría ser considerado como una fuente prometedora de metabolitos secundarios bioactivos para el desarrollo de productos farmacológicos. Fracciones de extracto alcohólico del tallo poseen propiedades antifúngicas contra Fusarium verticillioides y F. poae, además provocan letalidad en Artemia salina. Los ácidos carboxílicos y ésteres de ácidos que son los compuestos con mayor abundancia en este extracto podrían ser los responsables de dicha actividad biológica. Entre ellos se encuentra el éster undecílico del ácido undecanoico. Igualmente, fracciones del extracto etéreo del tallo contienen esteroles insaturados como colestan-3-ona y spinasterona.
AGRADECIMIENTOS
A la Universidad de Oriente UDO-VE, Cumaná, Venezuela, por colaborar con sus instalaciones para el desarrollo de esta investigación, al Instituto Venezolano de Investigaciones científicas (IVIC) y a la Universidad Simón Bolívar, Caracas, Venezuela, por su colaboración para la realización de los análisis de RMN y CG/EM.
Conflicto de interés
Todos los autores realizaron aportes significativos al documento y quienes están de acuerdo con su publicación y manifiestan que no existen conflictos de interés en este estudio.
Contribución de los autores
Conceptualización: FR, HD, Investigación: FR, JL, MA, VH, Escritura - primera redacción: FR, HD, MA, VH, Escritura - revisión y edición: FR, HD, MA, VH.
REFERENCIAS
D’Armas H, Rodríguez F, Salazar J (2013) Estudio fitoquímico preliminar y bioactividad de la planta Melochia villosa proveniente del estado amazonas, Venezuela. Saber 25(4): 382-389
D’Armas H, Vásquez V, Ordaz G (2018) Phytochemical screening and bioactivity analysis of extracts from Helicteres guazumifolia Kunth (Sterculiaceae). International Journal of Herbal Medicine 6(1): 47-50
Dayal R, Singh A, Mishra KP (2017) Potential of enhancing tumor toxicity by crude ethanolic extracts of fruits of Helicteres isora (L.). Journal of Pharmacognosy and Phytochemistry 6(1):417-423
Espinoza B (2010) Análisis fitoquímico y bioactividad de la planta Melochia tomentosa (Sterculiaceae). Trabajo de pregrado. Departamento de Química. Universidad de Oriente, Cumaná, Venezuela
Herrera O (2016) Efecto antioxidante y antitumoral in vitro del extracto etanólico de la raíz de Waltheria ovata Cav. "lucraco" en línea celular de cáncer de próstata DU-145. Disponible en: https://www.researchgate.net/publication/303960971. Consultado 14/05/2019
Li K, Yu Y, Sun S, Liu Y, Garg S, Kaul S, Lei Z, Gao R, Wadhwa R (2016) Functional Characterisation of Anticancer Activity in the Aqueous Extract of Helicteres angustifolia L. Roots. PlosOne 11(3): e0152017; doi: 10.1371/journal.pone.0152017
Madubunyi I (1995) Antimicrobial activities of the constituents of Garcinia kola seeds. Intern J Pharm 33: 232-237
Marcano DY, Hasegawa M (2002) Fitoquímica orgánica. UCV, Litopar
McLaughlin J, Rogers L, Anderson J (1998) The use of biological assay to evaluate botanicals. Drug information journal 32(2):513-524
Medline Plus (2019) Esteres etílicos del ácido graso omega 3. Disponible en: http://www.nlm.nih.gov/medlineplus/spanish/druginfo/meds/a607065-es.html. Consultado 28/06/2019
Meyer BN, Ferrigni NR, Putnam JE, Jacobsen LB, Nichols DJ, McLaughlin JL (1982) Brine shrimp: A convenient general bioassay for active plant constituents. Planta Medica 45(1):31-34
Namikoshi M, Fujiwara T, Nishikawa T, Ukai K (2006) Natural Abundance 14C Content of Dibutyl Phthalate (DBP) from Three Marine Algae. Marine Drugs 4(4): 290-297
Pandey A, Upadhyaya A, Pande KK (2015) Screening of antimicrobial activity of Helicteres isora, Cichcory intybus and Litsea chinensis. International Journal of Bioassays 4(7):4127-4130
Rodríguez F, D’Armas H, Salazar J (2015) Caracterización estructural de algunos componentes del extracto alcohólico de las hojas de Melochia villosa (Sterculiaceae) proveniente del Amazonas venezolano. Saber 27(1): 67-77
Rowshanul M, Rezaul M (2009) Antimicrobial and Citotoxic Activity of Di-(2-ethylhexyl) Pthalate and Anhydrosophoradiol-3-acetate Isolated from Calotropis gigantea (Linn) Flower. Journal of Molecular Biology 37(1):31-36
Ruikar A, Gadkari T, Phalgune U, Puranik V, Deshpade N (2011) Dibutil Phtalate, a secondary metabolite from Mimusops elengi. Chemistry of Natural Compounds 46(6):955
Salazar C (2012) Metabolitos secundarios presentes en la planta Whalteria berteroi (Sterculiaceae) colectada en el estado Amazonas (Venezuela) y su actividad antimicrobiana y letal. Tesis de pregrado Departamento de Química, Universidad de Oriente, Cumaná, Venezuela
Stephan C (1977) Methods for calculating in LC50. En: Mayer FL, Hamelink J (eds). Aquatic Toxicology and Hazard Evaluation, pp. 65-84. ASTM International, Philadhelphia; doi: 10.1520/STP32389S
Tarache A (2007) Separación e identificación de algunos compuestos constituyentes de la planta Helicteres baruensis Jacq. (Sterculiaceae) y su actividad biológica. Trabajo de pregrado. Departamento de Química, Universidad de Oriente, Cumaná, Venezuela
Tschesche R, Reutel I (1968) Alkaloide aus Sterculiaceae, über peptidalkaloide aus Melochia corchorifolia. Tetrahedron Letters 35: 3817-3818
Vásquez V (2010) Aislamiento e identificación de algunos constituyentes de la hoja de la planta Helicteres guazumifolia Kunth (Sterculiaceae) y su posible actividad biológica. Trabajo de pregrado. Departamento de Química. Universidad de Oriente, Cumaná, Venezuela
Recibido: 03-02-2020
Aceptado:06-04-2020
Copyright (c) 2020 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
