Artículo original
Biotecnología Vegetal Vol. 20, No. 3: 189 - 201, julio - septiembre, 2020
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN: 2074-8647, RNPS: 2154
Optimización del medio de cultivo y las condiciones de fermentación para la producción de un biofertilizante a base de Azotobacter chroococcum
Optimization of the culture medium and fermentation conditions for Azotobacter chroococcum based biofertilizers production
María Cristina Pérez Peñaranda 1* https://orcid.org/0000-0001-6001-017X
Julio Oramas García 1 https://orcid.org/0000-0001-7230-874X
Emilio Arcadio Sotolongo Valdés 2 https://orcid.org/0000-0001-7839-3148
Yoandra Román Tabio 1 https://orcid.org/0000-0001-9414-1928
Héctor López Rodriguez2
1Unidad de Desarrollo–Innovación del Grupo Empresarial Laboratorios Biológicos Farmacéuticos (LABIOFAM). Ave. Independencia km 16 ½. Boyeros. La Habana. Cuba.
2Facultad de Ingeniería Química, Universidad Tecnológica de La Habana. Calle 114, No. 11901, entre Ciclovía y Rotonda. Marianao. La Habana. Cuba.
*Autora para correspondencia e-mail: mcperezpenaranda@gmail.com
RESUMEN
En Cuba se ha desarrollado un biofertilizante a base de una cepa de Azotobacter chroococcum, fijadora de nitrógeno. Ante la necesidad de estandarizar su escalado industrial este trabajo tuvo por objetivo optimizar el medio de cultivo y las condiciones de fermentación. Se realizaron ensayos a escala de zaranda y luego en fermentador. En cada caso se realizó validación experimental. Para la optimización del medio de cultivo, se aplicó un diseño factorial 23 con puntos estrellas equidistantes y seis repeticiones en el centro del plan, para ajustar superficies respuesta. Se realizaron un total de 19 corridas experimentales, con tres repeticiones cada una y se determinó la ecuación de regresión. Como variable respuesta se determinó el crecimiento celular por densidad óptica λ=540 nm (DO540). Para optimizar el crecimiento microbiano en función de la velocidad de agitación y el flujo de aire se empleó un fermentador de 7.5 litros con un diseño factorial 22, tomando como variable respuesta la DO540. Con el medio de cultivo optimizado se obtuvo un crecimiento de 2 – 4 x 109 UFC ml-1, que unido al empleo de una velocidad de agitación y flujo de aire óptimo permiten incrementar el contenido de biomasa bacteriana. Se redujo el tiempo de fermentación a 10 horas con respecto a las 20 a 22 horas que se empleaban en el esquema de producción. Se redujo el 40%, 50% y 20% respectivamente de las fuentes de carbono, nitrógeno y fósforo.
Palabras clave: bioproducto, diseño compuesto central, metodología de superficie respuesta
ABSTRACT
In Cuba, a biofertilizer has been developed based on a nitrogen fixer Azotobacter chroococcum strain. This work aimed to optimize the culture medium and the fermentation conditions for industrial scale. First, tests in the shaker were carried out and then in a fermenter. In each case an experimental validation was performed. For the optimization of the culture medium, a central composite design was used to adjust response surfaces. A 23 factorial design with equidistant star points and six repetitions in the center of the plan. A total of 19 experimental runs were performed, with three repetitions determined. As a response variable, cell growth was determined by optical density λ = 540 nm (OD540). To optimize microbial growth based on agitation speed and air flow, a 7.5, liter with a factorial design 22 was used, taking OD540 as the response variable. With the means of optimized cultivation a growth of 2-4 x 109 UFC ml-1 was obtained that allow to increase the content of bacterial biomass together to the use of a speed of agitation and good flow of air. The new conditions allowed to reduce the time of fermentation at 10 hours, less than 20 to 22 hours used in the production scheme. In addition, 40%, 50% and 20% respectively, of carbon, nitrogen and phosphorus sources were reduced.
Keywords: bioproduct, central composite design, response surface methodology
INTRODUCCIÓN
La agricultura tradicional ha buscado acrecentar la producción agrícola mediante el manejo del agua, los nutrientes, el control de malezas, insectos y organismos fitopatógenos. Actualmente se trabaja en la agricultura de precisión que se enfoca en identificar los puntos más sensibles del manejo del cultivo para aumentar su rendimiento y disminuir la cantidad de agroquímicos utilizados (Camelo-Rusinque et al., 2017).
El uso excesivo de fertilizantes químicos y plaguicidas no solo deteriora la calidad del suelo sino que también degrada en gran medida la calidad del agua subterránea y, por lo tanto, los nutrientes minerales disponibles. La creciente demanda de producción de cultivos con una reducción significativa del uso de fertilizantes químicos sintéticos y plaguicidas es un gran desafío. La producción comercial de biofertilizantes y su fácil disponibilidad en el mercado podría contribuir a cambiar esta situación en diferentes sectores agrícolas Por esta razón el uso de estos bioproductos ha tomado cada vez más fuerzas debido a que se puede recuperar la fertilidad de las tierras al aportar microorganismos benéficos que ayudan a lograr un equilibrio ecológico. Las rizobacterias promotoras del crecimiento vegetal (PGPR, del inglés: Plant Growth Promoting Rhizobacteria) muestran un papel importante en la industria de la agricultura sostenible y se han obtenido resultados alentadores (Bhardwaj et al., 2014; Astafyeva y Shalabayeva, 2016; Vejan et al., 2016; Stamenković et al., 2018; Kaur y Purewal, 2019).
El nitrógeno es uno de los elementos esenciales para el crecimiento de las plantas, la productividad y calidad de las cosechas, después del agua es el principal elemento limitante de la productividad vegetal. El aporte de este nutriente a los suelos puede ser por medio de la descomposición de la materia orgánica, descargas eléctricas, utilización de fertilizantes sintéticos y por fijación biológica del nitrógeno. Lo más empleado para la reposición de nitrógeno son los fertilizantes químicos pero las plantas son capaces de utilizar solamente el 50% de lo que se aplica por lo que el resto se pierde en el sistema suelo-planta y causa pérdidas económicas y contaminación ambiental. Por ello, se viene estudiando la posibilidad de introducir dicho nutriente por procesos biológicos que son más eficientes y ecológicos (Pedraza et al., 2010). Las bacterias fijadoras de nitrógeno (diazótrofas) fueron las primeras en producirse comercialmente con fines de biofertilización (Dobereiner y Day, 1975; Page y Shivprasad, 1991).
Los inoculantes microbianos adquirirán una mayor importancia en el contexto de la agricultura cubana de los próximos años dado que son imprescindibles para garantizar rendimientos agrícolas estables, y asegurar un balance de nutrientes más positivo (N y P principalmente). Esto permitirá proteger la fertilidad de los suelos y el medio ambiente en el país, sin dejar de producir alimentos para la población (Martínez et al., 2017). Sin embargo, se requieren estudios que contribuyan a la producción sostenible y con calidad de estos productos biológicos.
El diseño del medio de cultivo es la primera etapa para la producción de un bioproducto. Finaliza con la selección de los componentes de acuerdo con las necesidades nutricionales del microorganismo para su crecimiento (Ertola y Mignore, 2006). La modificación y variación de fuentes nutricionales ha sido empleada para maximizar la producción de biomasa en bacterias promotoras de crecimiento vegetal (Moreno et al., 2011).
Los diseños estadísticos son ampliamente empleados para la optimización de procesos industriales (Ren et al., 2008). Una selección y aplicación de diseños debe realizarse de forma secuencial, lo cual permite determinar niveles y factores que influyen sobre la respuesta óptima de una variable. En procesos de fermentación microbiana para obtener bioproductos con bacterias se requiere identificar las variables independientes y sus valores óptimos que mayor influencia tienen en el rendimiento del producto deseado. El empleo de la metodología de superficie de respuesta es útil para optimizar combinaciones de factores (Rao et al., 2000, Box et al., 2005; Bezerra et al., 2008; Moreno et al., 2011; Jiménez, 2015). Estas estrategias ha sido empleadas por diferentes autores (Isar et al., 2006; Altaf et al., 2007).
Azotobacter chroococcum está catalogada como una PGPR con amplio efecto sobre diferentes cultivos como algodón (Gossypium hirsutum L.), maíz (Zea mays L.), trigo (Triticum aestivum L.), entre otros (Kizilkaya, 2008; Romero-Perdomo et al., 2018; Abdel et al., 2020). Por sus atributos de promoción de crecimiento tales como fijación biológica de nitrógeno, producción de compuestos indólicos, solubilización de fosfatos, producción de sideróforos (Kennedy et al., 2005; Becking, 2006; Wani et al., 2016), se ha utilizado como principio activo en la formulación de biofertilizantes, en procesos de bioremediación y producción de polímeros (Myshkina et al., 2008).
En Cuba se realizaron investigaciones tecnológicas que permitieron definir un medio de cultivo para la producción del bioproducto DIMARGON a base de Azotobacter chroococcum (Dibut y Martínez-Viera, 1994). Ha sido utilizado con resultados positivos en varios cultivos (Delgado et al., 2003; Dibut, 2009; González et al., 2012; León et al., 2012; Rodríguez et al., 2016). Para elaborar el medio de cultivo se emplean elementos trazas cuyo uso no es viable desde el punto de vista económico para producción a gran escala. Con la finalidad de estandarizar su escalado industrial mediante un proceso de fermentación y mejorar la calidad de su formulación, este trabajo tuvo como objetivo optimizar el medio de cultivo y las condiciones de fermentación de la bacteria.
MATERIALES Y MÉTODOS
Cepa bacteriana
Se empleó una cepa de Azotobacter chroococum, conservada por liofilización, del cepario de la Unidad Productora de Vacunas Virales y Bacterianas (UP-7) de LABIOFAM.
Para optimizar el medio de cultivo de crecimiento de la bacteria se realizaron ensayos a escala de zaranda y posteriormente, en un fermentador con cinco litros de volumen efectivo se ajustaron las condiciones de fermentación velocidad de agitación y flujo de aire. En cada caso se realizó validación experimental. Se empleó un diseño factorial para la sustitución de la fuente de carbono en el medio de cultivo inicial por otra y la variación de la composición de la fuente de nitrógeno y fósforo, así como la eliminación de la solución de microelementos, lo cual es una de las causas que hacia incosteable el medio de cultivo en la producción. La duración del proceso fermentativo inicial era de 20-22 horas para obtener la biomasa a partir de la cepa bacteriana.
Optimización de medio de cultivo a escala de zaranda
El diseño y la formulación del medio de cultivo tuvo en cuenta la composición elemental de las bacterias (Scragg, 2000). La optimización se realizó mediante un diseño compuesto central (DCC) para ajustar superficies respuesta (Box et al., 2005).
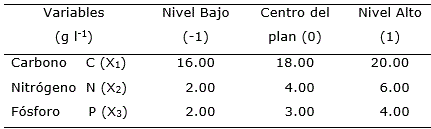
Los niveles de los factores se determinaron según ensayos previos y la composición del medio de cultivo original (Dibut y Martínez-Viera, 1994) para obtener el biofertilizante a base de A. chroococcum. Se tomaron como variables independientes las concentraciones de las fuentes de carbono, nitrógeno y fósforo. Cada factor con dos niveles: alto y bajo (+1), (-1).
Como variable respuesta se determinó el crecimiento celular (biomasa) por lectura de Densidad Óptica λ =540 nm (DO540). Se aplicó un diseño factorial 23 con puntos estrellas equidistantes y cinco repeticiones en el centro del plan considerado como cero (Tabla 1). Se realizaron un total de 19 corridas experimentales, con tres repeticiones cada una y se determinó la ecuación de regresión. Para la representación gráfica se utilizó la metodología de superficie respuesta.
Tabla 1. Concentraciones de fuentes de nutrientes (g l-1) para la optimización de medio de cultivo a escala de zaranda en la fermentación de Azotobacter chroococum.
Con las combinaciones óptimas obtenidas del análisis de superficie respuesta para la mayor producción de biomasa, se realizaron tres fermentaciones para validar experimentalmente los resultados.
Obtención del preinóculo
Se prepararon tres Erlenmeyers de 250 ml de capacidad con un volumen de 100 ml del medio de cultivo formulado con las concentraciones de la fuente de carbono, nitrógeno y fósforo correspondientes al centro del plan. Se esterilizó en autoclave a 121 °C y 111.5 kPa durante 25 minutos, luego se adicionaron 2 ml del medio de cultivo a cada tubo de la cepa conservada, se agitó hasta desprender el cultivo y la suspensión de células obtenida se añadió a cada Erlenmeyer. El preinóculo permaneció en zaranda durante 12 horas a 220 rpm. Mediante la observación de los caracteres morfológicos de las células bacterianas en la tinción de Gram se comprobó la pureza del cultivo.
Optimización del medio de cultivo a escala de zaranda
Los medios de cultivo para la fermentación en zaranda se prepararon en Erlenmeyers de 250 ml de capacidad con un volumen de 90 ml del medio de cultivo formulado según el diseño experimental factorial 23 con tres repeticiones de cada tratamiento. La esterilización del medio de cultivo se realizó en autoclave a 121 °C y 111.5 kPa durante 25 minutos. Los Erlenmeyers se inocularon con 10 ml de preinóculo para un volumen total de 100 ml y se colocaron en zaranda 12 horas a 30 °C y 220 rpm. Se realizaron mediciones de la DO540 y el pH al inicio de la fermentación y posteriormente cada dos horas hasta la fase estacionaria del cultivo, y se construyó la curva de crecimiento de la biomasa. Se comprobó la pureza mediante tinción de Gram.
Determinación de biomasa
El incremento en biomasa se determinó por masa seca (mg), se tomaron muestras por duplicado de 1.5 ml de cada dilución en tubos de ensayo (Eppendorfs) previamente secados a 50 °C por 24 h y luego pesados. Los cultivos bacterianos se centrifugaron a 14 000 rpm por 20 minutos a 4 °C y el sobrenadante fue decantado. Los tubos se llevaron al horno a 50 °C hasta lograr peso constante y se utilizó como blanco el medio de cultivo sin inocular. Para la determinación de la DO540 se tomaron muestras por duplicado de 1.5 ml de cada dilución en tubos de ensayo (Eppendorfs) y se realizó la curva patrón de masa seca (mg). Se realizaron mediciones de la DO540 al inicio y posteriormente cada dos horas para cada réplica de los medios de cultivo ensayados hasta la fase estacionaria del cultivo, y se construyó la curva de crecimiento. Se cuantificaron los azúcares reductores mediante la técnica del ácido 3.5 dinitrosalicílico (DNS) (Miller, 1959).
Determinación de parámetros cinéticos
Los parámetros cinéticos calculados fueron biomasa producida (ΔX), velocidad específica máxima de crecimiento (μmáx) y rendimiento Yx/s. El Yx/s se calculó como la relación entre la biomasa producida (g) y el consumo total de sustrato (g) (ΔS) (Doran, 2013). A partir de los datos de la curva de crecimiento se graficó el logaritmo natural de la concentración de células en función del tiempo según la ecuación: ln X = lnX0 +μmáx (t – t0).
Determinación de unidades formadoras de colonias (UFC ml-1)
Se realizaron diluciones seriadas desde 10-1 hasta 10-10 y se inocularon tres placas por cada dilución en Agar nutriente, se incubaron a 30 °C por 24 horas. Posteriormente se realizó el conteo de UFC ml-1 por placa.
Comprobación experimental de la formulación del medio de cultivo
Con el medio de cultivo formulado a partir del procesamiento de datos por STATGRAPHICS, fueron realizadas tres fermentaciones en zaranda durante 24 horas a 30 °C, pH=7.4, y a una velocidad de agitación de 220 rpm. Se determinó DO540 y pH cada 2h, con lo cual se construyeron las curvas de crecimiento de la biomasa para cada fermentación.
Optimización de las condiciones de fermentación
Para optimizar las condiciones de fermentación se empleó un fermentador de 7.5 litros de volumen total con cinco litros de volumen efectivo. Se tuvieron en cuenta los resultados de la optimización del medio de cultivo y se analizó el efecto de la velocidad de agitación y el flujo de aire sobre la producción de biomasa de la bacteria.
Se empleó un diseño factorial 22 con tres repeticiones en el centro del plan, para un total de 11 corridas experimentales y tres corridas de comprobación. Como variable respuesta se determinó el pH y el crecimiento celular por DO540 al inicio y cada dos horas hasta concluir el experimento. Se comprobó la pureza mediante tinción de Gram y se cuantificaron las Unidades Formadoras de Colonias (UFC ml-1).
Se determinó la ecuación de regresión. Para la representación gráfica se utilizó la metodología de superficie respuesta. Los parámetros para la fermentación de 5 l de volumen efectivo se presentan en la tabla 2.
Tabla 2. Factores y niveles empleados en la optimización de la velocidad de agitación y el flujo de aire en fermentador de 5 l de volumen efectivo.

Para validar experimentalmente los resultados, con las combinaciones que el análisis de superficie respuesta arrojó como óptimas para la mayor producción de biomasa, se realizó una fermentación discontinua durante 12 horas utilizando el medio de cultivo optimizado. El pH se ajustó a 7.4 antes de esterilizar. La concentración de azúcares expresados como reductores al inicio de la fermentación fue de 18 g l-1. Se realizó la curva de crecimiento a partir de mediciones de DO540 cada dos horas y se determinó el consumo de sustrato por el método del DNS.
Para la obtención del preinóculo de la fermentación se prepararon dos Erlenmeyers con 500 ml del medio de cultivo optimizado y se esterilizó en autoclave a 121 °C y 111.5 kPa durante 30 minutos. Luego se adicionaron 10 ml del medio de cultivo a dos tubos de cultivo de A. chroococum, se agitaron hasta desprender el cultivo y la suspensión de células obtenida se inoculó en cada Erlenmeyers, estos se mantuvieron en zaranda a 220 rpm durante 12 horas. Se realizó evaluación de la pureza mediante tinción de Gram.
Se prepararon para la fermentación 4 l del medio de cultivo optimizado y se esterilizó en autoclave a 121°C y 111.5 kPa durante 45 minutos. Se inoculó con un litro de preinóculo para un volumen total de 5 l. La fermentación se realizó durante 12 horas, a 30 °C.
Se realizaron mediciones de la DO540 y pH al inicio y posteriormente cada dos horas para cada réplica de los medios ensayados hasta completar 12 horas. Con los resultados de la DO540 a partir de la curva patrón realizada se determinaron los valores de crecimiento de biomasa en (g l-1), con los que se construyó la curva de crecimiento de la cepa. Se realizó evaluación de la pureza mediante tinción de Gram y se cuantificó el número de UFC ml-1.
Tratamiento estadístico de los resultados experimentales
Se empleó el software Statistic Package for Social Science (SPSS) versión XV- Centurión y Microsoft Excel para Windows. En los procesos de optimización se generó un modelo de la curva de regresión con los coeficientes significativos. Se realizó un análisis de varianza y los resultados se mostraron mediante diagramas de Pareto. El intervalo de confianza establecido fue de 95%, se tomaron como significativos los factores con un valor de Probabilidad (P)>F menor de 0.05.
RESULTADOS Y DISCUSIÓN
Optimización de medio de cultivo a escala de zaranda
En el diseño factorial utilizado se obtuvo una ecuación de la forma: Y=b0 + b1X1 + b2X2 + b11X12 + b12X1X2 + b22X22 al tener en cuenta el efecto de las tres variables independientes (concentraciones de carbono, fósforo y nitrógeno).
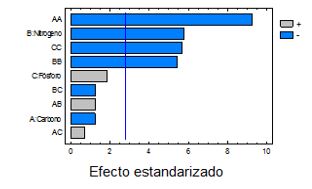
Figura 1. Diagrama de Pareto del efecto de las fuentes de carbono, nitrógeno y fósforo en la en la optimización del medio de cultivo para la producción de biomasa de Azotobacter chroococcum.
La fuente de nitrógeno y las interacciones cuadráticas del factor carbono, nitrógeno y fósforo fueron significativas con 95% de nivel de confianza (Figura 1). Una disminución en la fuente de nitrógeno aumentó la producción de biomasa. El aumento en la concentración de la fuente de nitrógeno, puede disminuir la producción de biomasa al originar inhibición del crecimiento o muerte de la cepa lo que coincide con los criterios expresados por otros autores (Rojas y Moreno-Sarmiento, 2008).

Figura 2. Gráficas de superficie respuesta (A) y de contorno (B) del crecimiento de Azotobacter chroococcum en función de las fuentes de carbono y nitrógeno.
El análisis a través de la metodología de superficie respuesta demostró que la variable dependiente se incrementaba cuando la concentración de la fuente de carbono está en su nivel medio y la de nitrógeno cercano a su nivel bajo manteniendo el fósforo en el centro (Figura 2). Las bacterias fijadoras de nitrógeno son exigentes en los requerimientos nutricionales, principalmente con las fuentes de carbono (Balows et al., 1992).

Figura 3. Gráficas de superficie respuesta (A) y de contorno (B) del crecimiento de Azotobacter chroococcum en función de las fuentes de carbono y fósforo.
El crecimiento de la biomasa (Figura 3) mostró su máximo valor cuando las concentraciones de carbono y fósforo se encontraban en su nivel medio. El fósforo, estimula el metabolismo del carbono, la manipulación y la fijación de nitrógeno (Sabra et al., 1999). En todas las demás fronteras se observó una disminución de la biomasa.
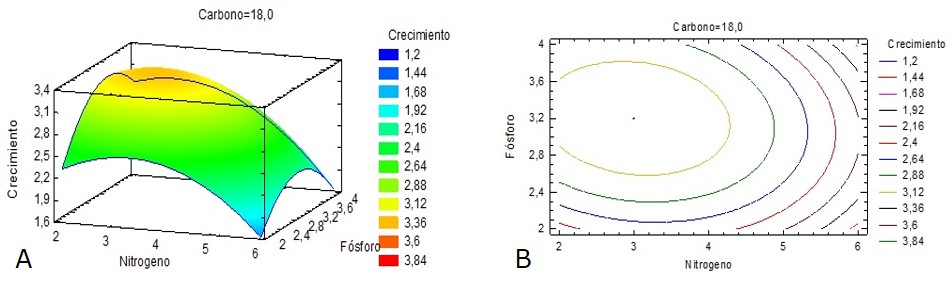
Figura 4. Gráficas superficie respuesta (A) y de contorno (B) del crecimiento de Azotobacter chroococcum en función de las fuentes de nitrógeno y fósforo.
La mayor producción de biomasa se obtuvo para una concentración intermedia entre los niveles bajo y medio de la fuente de nitrógeno y cuando el factor fósforo se encontraba cercano a su nivel central (Figura 4). A pesar de que las bacterias del género Azotobacter son fijadoras de nitrógeno, la adición de nitrógeno en el medio de cultivo disminuye la fase Lag y el tiempo de generación, lo que disminuye consecuentemente el tiempo de fermentación (Vermani et al., 1997).
Optimización de las condiciones de fermentación
La cinética de crecimiento promedio de las tres fermentaciones realizadas de la cepa de A. chroococcum (Figura 5) en el medio de cultivo optimizado mostró que a partir de las 12 horas el valor de absorbancia se mantuvo constante. Este resultado confirmó que el microorganismo se encontraba en fase estacionaria, debido a que se agota algún nutriente esencial del medio de cultivo o porque los productos de desecho que han liberado durante la fase exponencial hacen que el medio sea inhóspito para el crecimiento microbiano (Scragg, 2000). El pH se mantuvo en un rango favorable para el crecimiento entre 6.4 y 7.1.
El crecimiento estimado con el medio de cultivo formulado fue de 3.33, en la comprobación experimental se alcanzó un valor de crecimiento de 3.07 con lo que se verificó que lo predicho teóricamente por el programa estadístico es correcto, valor similar a lo que se obtiene cuando se utiliza como medio de cultivo caldo nutritivo (Gutiérrez y Arboleda, 2018).
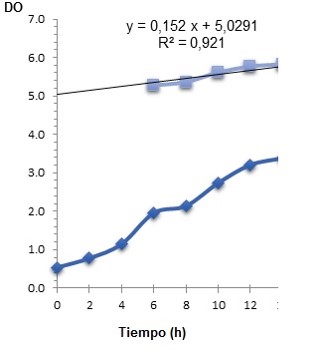
Figura 5.Crecimiento de Azotobacter chroococcum en zaranda en el medio de cultivo formulado, a 30 °C, 220 rpm. 2-4 x109 UFC ml-1 (p<0.05).
En este estudio a nivel de zaranda se corroboró que la metodología de superficie respuesta es útil para optimizar el proceso fermentativo (Tabla 3). En procesos de fermentación donde intervienen especies de Azotobacter se ha utilizado por diferentes autores con resultados positivos (Moreno et al., 2011; Jiménez, 2015; Camelo-Rusinque et al., 2017).
Tabla 3. Comparación de los parámetros cinéticos obtenidos en zaranda con el medio de cultivo para producción de Azotobacter chroococcum y el medio de cultivo optimizado.

Se comprobó que la interacción cuadrática de la velocidad de agitación y el flujo de aire tuvieron efecto significativa en el aumento de biomasa en la fermentación para un intervalo de confianza del 95% y R2= 0.9285 (Figura 6). Los factores agitación y aireación de forma aislada, favorecieron el crecimiento de la biomasa con valores elevados de velocidad de agitación pero también con valores bajos en menor medida. Esto se explica porque el factor velocidad de agitación no es significativo. En el caso del flujo de aire se tiene el mayor valor de la variable respuesta algo desplazado del nivel bajo, lo que está en concordancia con lo expresado por Camelo-Rusinque et al. (2017).
La aplicación del análisis de regresión generó la ecuación cuadrática:
Biomasa (g l-1) =62.6864 – 0.176342A + 3.42205*B + 0.00012751A2– 0.00155AB – 1.34036B2

Figura 6. Efecto de la velocidad de agitación y el flujo de aire en la producción de biomasa de Azotobacter chroococcum.
Con el modelo de regresión se obtuvo la gráfica de superficie respuesta para la interacción agitación-flujo de aire (Figura 7). Los contornos para la producción de biomasa se representan como función de la velocidad de agitación y el flujo de aire. No se logró obtener un valor máximo del crecimiento de biomasa debido a que el fermentador empleado no superaba los 800 rpm por lo que el centro del contorno se encuentra desplazado. Autores como Peña et al. (2000) y Rojas y Moreno-Sarmiento (2008) señalaron que elevando los niveles de aireación en el fermentador se obtiene una mayor respuesta del crecimiento de la biomasa, esto debido a las necesidades metabólicas de Azotobacter chroococcum , el cual requiere una mayor presencia de oxígeno para su óptimo crecimiento. Con estas condiciones se logró obtener una concentración máxima de biomasa de 2.27 g l-1 lo cual es muy importante para la producción industrial de la bacteria. Mediante el análisis matemático se determinó que los valores óptimos de velocidad de agitación y flujo de aire fueron de 815 rpm y 0.8 vvm. Con esta misma especie, el efecto Camelo-Rusinque et al. (2017) demostraron que el efecto combinado de la aireación y la agitación en sus niveles más altos promovieron mayores producciones de biomasa. Para desarrollar un producto óptimo, es importante conocer y comprender el proceso, incluida la fisiología de las bacterias y plantas, los procesos tecnológicos de multiplicación masiva, así como la formulación existente y el efecto específico sobre la planta deseada (Stamenković et al., 2018).
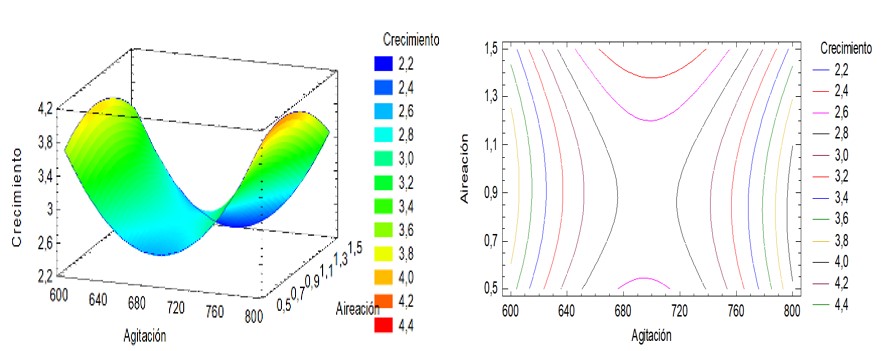
Figura 7. Gráficos superficie respuesta (A) y de contorno (B) con el efecto de la velocidad de agitación y el flujo de aire sobre la producción de biomasa de Azotobacter chroococcum en fermentador de 7.5 litros.
Los resultados de la optimización de las condiciones de velocidad de agitación-flujo de aire validados experimentalmente (Figura 8) mostraron que la fase exponencial se mantuvo hasta las 10 horas. Se obtuvo un valor máximo de producción de biomasa de 6.77, superior a lo obtenido en estudios con otros medios de cultivo informados por otros autores (Gutiérrez y Arboleda, 2018). El crecimiento estimado con las condiciones obtenidas de agitación-aireación fue de 5.47 g l-1 que se correspondió en un 97.45% al estimado por el modelo predictivo (R2=0.974). Este resultado mostró correspondencia de los datos experimentales con el modelo. Al cesar el crecimiento celular, no se había agotado la fuente de carbono y energía ya que solo se consumieron 8 g, lo que indicó que la inhibición del crecimiento de la biomasa no ocurrió por agotamiento del sustrato limitante en el proceso (Figura 9) sino quizás por exceso y la formación de metabolitos tóxicos. Este aspecto puede ser objeto de nuevos estudios.

Figura 8. Curva de Crecimiento promedio de Azotobacter chroococcum en fermentador de 5 litros de volumen efectivo en condiciones de velocidad de agitación 800 rpm y 0.88 vvm.
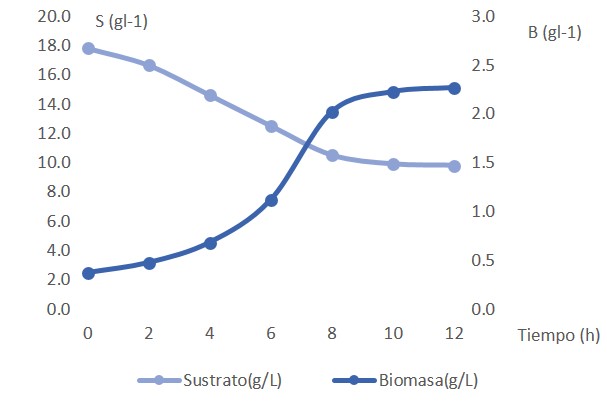
Figura 9. Relación entre la concentración de biomasa y el consumo de azúcares reductores en la fermentación de Azotobacter chrococcum en fermentador de 5 litros de volumen efectivo.
En el fermentador se alcanzó un mayor aprovechamiento de los componentes del medio de cultivo por la bacteria ya que los parámetros cinéticos fueron superiores a los obtenidos en zaranda (Tabla 4). Resultados similares fueron informados por Camelo-Rusinque et al. (2017).
Tabla 4. Parámetros cinéticos obtenidos en zaranda y fermentador de 5 l de volumen efectivo para la producción de biomasa de Azotobacter chroococcum.

La bacteria finalizó la fase de crecimiento exponencial con una disminución del tiempo a 10 horas cuando se ajustaron las condiciones óptimas de agitación y flujo de aire, en el fermentador.
Con el medio de cultivo diseñado para la cepa A. chrococcum se redujeron las concentraciones de carbono, nitrógeno y fósforo en 40%, 50% y 20% respectivamente con respecto al medio de cultivo propuesto originalmente. Además, se incrementó en 60% la producción de biomasa. Las condiciones de velocidad de agitación (800 rpm) y flujo de aire (0.88 vvm) en el fermentador de 5 litros de volumen efectivo garantizaron que el tiempo de fermentación disminuyera a 10 horas.
Los resultados del trabajo contribuirán a la producción a gran escala de A. chrococcum para ser empleado como biofertilizante en la producción agrícola de alimentos en el país. Esta especie ha sido valorada como una de las más importantes dentro de los microorganismos promotores del crecimiento vegetal por su capacidad de habitar la raíz de las plantas y mejorar su desarrollo. Tiene influencia positiva a través de la solubilización de fosfatos, la fijación de nitrógeno, la producción de reguladores del crecimiento, la protección contra organismos patógenos y la recuperación de condiciones ambientales estresantes. Los beneficios de aplicaciones en diferentes cultivos han sido referidos (Stamenković et al., 2018). Según Van Oosten et al. (2018) la inoculación con bacterias beneficiosas como A. chroococcum puede ser una solución ideal para sistemas de bajos insumos, donde las limitaciones ambientales y la fertilización química limitada pueden afectar el rendimiento potencial.
CONCLUSIONES
Con un medio de cultivo semisintético sin microelementos, velocidad de agitación y flujo de aire óptimos se incrementa el contenido de biomasa bacteriana para la producción industrial de A. chroococcum.
AGRADECIMIENTOS
Los autores desean agradecer a la Unidad de Desarrollo e Investigación de LABIOFAM, a la Facultad de Ingeniería Química de la Universidad Tecnológica de la Habana y al Fondo Financiero de Ciencia e Innovación (FONCI). Los financistas Los financistas no tuvieron participación en el dise�o del estudio, la colecta y análisis de los datos, la decisión de publicar o la preparación del manuscrito es de la institución y el colectivo de autores del proyecto.
Conflicto de interés
Los autores no declaran conflictos de interés.
Contribución de los autores
Conceptualización MCPP, JOG y EASV, Metodología MCPP, JOG y YRT, Validación JOG y YRT, Investigación MCPP, JOG y HLR, Supervisión MCPP y EASV, Recursos MCPP y JOG, Escritura – primera redacción MCPP, JOG y EASV, YRT, Escritura - revisión y edición MCPP.
REFERENCIAS
Abdel AAH, Abu MF, Kordrostami M (2020) Inoculation with Azospirillum lipoferum or Azotobacter chroococcum reinforces maize growth by improving physiological activities under saline conditions. J Plant Growth Regul 39: 1293-1306; doi:10.1007/s00344-020-10065-9
Altaf M, Naveena BJ, Reddy G (2007) Use of inexpensive nitrogen sources and starch for L (+) lactic acid production in anaerobic submerged fermentation. Bioresour Technol 98(3): 498-503
Astafyeva Y, Shalabayeva K (2016) Dependence of Azotobacter chroococcum culture growth rate on salt concentrations. Engineering for Rural Development 25(27): 182-186
Bhardwaj D, Ansari MW, Sahoo RK (2014) Biofertilizers function as key player in sustainable agriculture by improving soil fertility, plant tolerance and crop productivity. Microb Cell Fact 13: 66; doi:10.1186/1475-2859-13-66
Balows A, Hans G, Truper MD, Wim H, Karl-Heinz S (1992) The Prokaryotes (Second edition). Springer- Verlag, Dordrecht
Becking JH (2006) The Family Azotobacteraceae. Prokaryotes 6: 759-783
Bezerra MA, Santelli RE, Oliveira EP, Villar LS, Escaleira LA (2008) Response surface methodology (RSM) as a tool for optimization in analytical chemistry. Talanta 76: 965-977
Box EP, Hunter JS, Hunter WG (2005) Statistics for Experimenters: Design, Innovation, and Discovery. Wiley-Interscience, London; ISBN: 978-0-471-71813-0
Camelo-Rusinque M, Moreno-Galván A, Romero-Perdomo F, Bonilla-Buitrago R (2017) Desarrollo de un sistema de fermentación líquida y de enquistamiento para una bacteria fijadora de nitrógeno con potencial como biofertilizante. Revista Argentina de Microbiología 49:(3) 289-296
Delgado Y, Cupull R, Pérez C, Sánchez A, Vilchez M (2003) Efecto de Azotobacter spp. en la estimulación de la germinación y el desarrollo de posturas de Coffea arabica L. Centro Agrícola 30(1): 26-31
Dibut B, Martínez-Viera R (1994) Dimargon, nuevo medio de cultivo para la producción industrial de biopreparados a base de Azotobacter chroococcum . Revista Cultivos Tropicales 15(1): 12-14
Dibut B (2009) Biofertilizantes como insumos en agricultura sostenible. Editorial Universitaria, Ciudad de La Habana; ISBN: 978-959-16-1032-4
Dobereiner J, Day J (1975) Nitrogen fixation in rhizosphere of grasses. En: Stewart WDP (Ed). Nitrogen Fixation by Free-living Microorganisms, pp. 39-56. Cambridge Univ Press, London
Doran PM (2013) Bioprocess engineering principles. Elsevier Ltd, London; doi:10.1016/C2009-0-22348-8
Ertola Y, Mignore C (2006) Microbiología Industrial. Latina PRdDCyTdA, Washington DC
González R, Iglesias A, Lorenzo J, Dibut, B (2012) Selección de cepas de Azotobacter chroococcum para su aplicación en la aclimatización de plantas in vitro de piña cv. Cayena lisa. Biotecnología Vegetal 12(3): 157-164
Gutiérrez M, Arboleda M (2018) Evaluación de la actividad promotora de crecimiento vegetal de dos cepas nativas de Azotobacter sp. en plantas de tomate bajo invernadero. Tesis de Grado, Pontificia Universidad Javeriana, Bogotá, Colombia
Isar J, Agarwal L, Saran S, Saxena RK (2006) A statistical method for enhancing the production of succinic acid from Escherichia coli under anaerobic conditions. Bioresour Technol 97: 1443-1448
Jiménez M (2015) Superficies de Respuesta mediante un Diseño Central Compuesto. Revista Varianza 11: 31-36
Kaur P, Purewal SS (2019) Biofertilizers and Their Role in Sustainable Agriculture. En: Giri B, Prasad R, Wu QS, Varma A (eds). Biofertilizers for Sustainable Agriculture and Environment, Soil Biology, vol 55 pp. 285-300. Springer, Cham; doi:10.1007/978-3-030-18933-4_12
Kennedy C, Rudnick P, Macdonald ML, Melton T (2005) Genus III. Azotobacter Beijerinck En: Brenner DJ, Krieg NR, Garrity GM (Eds). Bergey’s manual of systematic bacteriology. Vol. 2: The Proteobacteria. Part C: The Alpha-, Beta-, Delta-, and Epsilonproteobacteria, pp. 384-402. Springer, Baltimore
Kizilkaya R (2008) Yield response and nitrogen concentrations of spring wheat (Triticum aestivum) inoculated with Azotobacter chroococcum strains. Ecol Eng 33: 150-156
León Y, Hernández JM, Rodríguez N, Martínez R (2012) Aplicación de Azotobacter chroococcum en la producción de plántulas de tabaco negro. Cultivos Tropicales 33(2): 29-32
Martínez F, Gómez L, Aguilar Y, Martínez-Viera R, Castellanos N, Riverol M (2017) Manejo Sostenible de Suelos en la Agricultura Cubana. Agroecología 12(1): 25-38
Miller G (1959) Use of Dinitrosalicilic Acid Reagent for Determination of Reducing Sugar. Analytical Chemistry 31: 426-428
Moreno A, Rojas D, Bonilla R (2011) Aplicación de diseños estadísticos secuenciales en la identificación de fuentes nutricionales para Azotobacter chroococcum AC1. Revista Corpoica - Ciencia y Tecnología Agropecuaria 12(2): 151-158
Myshkina V, Nikolaeva D, Makhina T, Bonartsev A, Bonartseva G (2008) Effect of growth conditions on the molecular weight of poly-3-hydroxybutyrate produced by Azotobacter chroococcum 7B. Appl Biochem Microbiol 44(5): 482-486
Page W, Shivprasad D (1991) Azotobacter salinestris sp. nov., a sodium-dependent, microaerophili, and aeroadaptative nitrogen fixing bacterium. J Syst Bacteriol 41: 369-376
Pedraza R, Teixeira K, Scavino A (2010) Microorganismos que mejoran el crecimiento de las plantas y la calidad de los suelos. Corpoica 11(2): 155-164
Peña C, Trujillo-Rold MA, Galindo E (2000) Influence of dissolved oxygen tension and agitation speed on alginate production and its molecular weight in cultures of Azotobacter vinelandii (small star, filled). Enzyme and Microbial Technology 27: 390-398
Rao KJ, Kim CH, Rhee SK (2000) Statistical optimization of medium for the production of recombinant hirudin from Saccharomyces cerevisiae using response surface methodology. Process Biochemistry 35: 639-647
Ren J, Lin WT, Shen YJ, Wang JF, Luo XC, Xie MQ (2008) Optimization of fermentation media for nitrite oxidizing bacteria using sequential statistical design. Bioresour Technol (99): 7923-7927
Rodríguez J, Ríos Y, Baró Y (2016) Efectividad de cepas de Azotobacter sp. y Bacillus sp. para el control de especies fúngicas asociadas a hortalizas. Cultivos Tropicales 37: 13-19
Rojas J, Moreno-Sarmiento N (2008) Producción y formulación de prototipos de un biofertilizante a partir de bacterias nativas asociadas al cultivo de arroz (Oryza sativa). Revista Colombiana de Biotecnología 2: 50-62
Romero-Perdomo F, Abril M, Camelo M, Moreno-Galván A, Pastrana I, Rojas-Tapias D, Bonilla R (2018) Azotobacter chroococcum as a potentially useful bacterial biofertilizer for cotton (Gossypium hirsutum): Effect in reducing N fertilization. Revista Argentina de Microbiología 49(4): 377-383
Sabra W, Zeng A, Sabry S, Omar S, Deckwer W (1999) Effect of Phosphate and Oxygen Concentrations on Alginate Production and Stoichiometry of Metabolism of Azotobacter vinelandii under Microaerobic Conditions. Appl Microbiol Biotechnol 52: 773–780; doi:10.1007/s002530051590
Scragg A (2000) Biotecnología para ingenieros, sistemas biológicos en procesos tecnológicos. Editorial Limusa, México
Stamenković S, Beškoski V, Karabegović I, Lazić M, Nikolić N (2018) Microbial fertilizers: A comprehensive review of current findings and future perspectives. Spanish Journal of Agricultural Research16 (1): e09R01; doi:10.5424/sjar/2018161-12117
Van Oosten MJ, Di Stasio E, Cirillo (2018) Root inoculation with Azotobacter chroococcum 76A enhances tomato plants adaptation to salt stress under low N conditions. BMC Plant Biol 18: 205; doi:10.1186/s12870-018-1411-5
Vejan P, Abdullah R, Khadiran T, Ismail S, Nasrulhaq Boyce A (2016) Role of Plant Growth Promoting Rhizobacteria in Agricultural Sustainability—A Review. Molecules 21(5): 573; doi:10.3390/molecules21050573
Vermani M, Kelkar S, Kamat M (1997) Studies in Polysaccharide Production and Growth of Azotobacter vinelandii MTCC2459, a Plant Rhizosphere Isolate. Letter in applied microbiology 24(5): 379-383; doi:10.1046/j.1472-765X.1997.00137.x
Wani SA, Chand S, Wani MA, Ramzan M, Hakeem KR (2016) Azotobacter chroococcum – A Potential Biofertilizer in Agriculture: An Overview. En: Hakeem K, Akhtar J, Sabir M (eds). Soil Science: Agricultural and EnvironmentalProspectives, pp. 333-348. Springer, Cham; doi:10.1007/978-3-319-34451-5_15
Recibido: 26-04-2020
Aceptado: 02-07-2020
Copyright (c) 2021 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
