Artículo original
Biotecnología Vegetal Vol. 20, No. 3: 203 - 210, julio - septiembre, 2020
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Establecimiento in vitro de segmentos nodales de Handroanthus heptaphyllus de flores blancas
In vitro establishment of Handroanthus heptaphyllus nodal segments
Maura Isabel Díaz Lezcano1*https://orcid.org/0000-0003-4629-8255
Javier María Rodas Ramirez1https://orcid.org/0000-0003-4364-8651
Luis Roberto González Segnana1https://orcid.org/0000-0003-2545-1820.
Mirtha Vera de Ortiz1https://orcid.org/0000-0002-4381-2610
1Facultad de Ciencias Agrarias, Universidad Nacional de Asunción. Campus de San Lorenzo. San Lorenzo/Central. Paraguay. CP 1618.
*Autora para correspondencia e-mail: maura.diaz@agr.una.py
RESUMEN
La micropropagación podría ser utilizada como alternativa viable en la producción masiva de Handroanthus heptaphyllus (Vell.) Mattos (lapacho de flores blancas). El objetivo del presente trabajo fue establecer in vitro segmentos nodales de H. heptaphyllus. Los segmentos nodales fueron tomados de plantas jóvenes mantenidas en viveros a las cuales se les aplicaron tratamientos preventivos con fungicidas. Los explantes se desinfectaron con Hipoclorito de Sodio (NaClO) que se probó al 5 o al 10% durante 5 min. Posteriormente se colocaron en medio de cultivo Murashige y Skoog. Semanalmente hasta los 35 días de cultivo se cuantificaron los explantes vivos, contaminados o con necrosis. Los resultados demostraron la presencia de contaminantes microbianos en los explantes sometidos a los dos tratamientos. La incidencia en los explantes desinfectados con NaOCl al 10% no sobrepasó el 45% mientras que con 5% alcanzó 70%. Sin embargo, con la mayor concentración se produjeron pérdidas de 35% por necrosis de los explantes y una supervivencia de 20%. El uso se segmentos nodales de plantas jóvenes de H. heptaphylus de flores blancas permite su establecimiento in vitro como primer paso para la micropropagación de esta especie.
Palabras clave: desinfección, explantes, hipoclorito de sodio, lapacho de flores blancas, micropropagación
ABSTRACT
Micropropagation could be used as a viable alternative in the mass production of Handroanthus heptaphyllus (Vell.) Mattos (white lapacho). The objective of the present work was to establish in vitro of nodal segments of H. heptaphyllus. The nodal segments were taken from young plants kept in nurseries to which preventive treatments with fungicides were applied. The explants were disinfected with Sodium Hypochlorite (NaClO) which was tested at 5 or 10% for 5 min. Subsequently, it were placed in Murashige and Skoog culture medium. Live, contaminated or necrotic explants were quantified weekly until 35 days of culture. The results demonstrated the presence of microbial contaminants in the explants subjected to the two treatments. The incidence in the explants disinfected with 10% NaOCl did not exceed 45%, while with 5% it reached 70%. However, with the highest concentration there were losses of 35% due to necrosis of the explants and a survival of 20%. The use of nodal segments of young plants of white H. heptaphylus allows its in vitro establishment as a first step for the micropropagation of this species.
Keywords: disinfection, explants, lapacho of white flowers, micropropagation, sodium hypochlorite
INTRODUCCIÓN
Paraguay tiene una gran variedad de especies forestales que tienen muy buena madera, entre estas se puede mencionar Handroanthus heptaphyllus (Vell.) Mattos o comúnmente conocido como lapacho. El lapacho de flores blancas es muy apreciado por su llamativa belleza florística que proporciona un atractivo ornamental muy distinguido al mostrar sus ramas desfoliadas completamente cubiertas con flores de colores blancas. Este como todos los demás lapachos está en peligro de extinción por la masiva deforestación en Paraguay (Digilio y Legname, 1966; Gallo et al., 1999).
Según Lozano y Zapater (2008) en la coloración de las flores del género Handroanthus pueden ser rosado muy claras, rosado intensas hasta magenta y esporádicamente se presentan individuos con flores blancas, carácter mantenido mediante la realización de injertos. Una de las limitantes en la propagación de esta especie podría ser el genotipo, cuya expresión fenotípica es muy rara porque se forma con la presencia de un gen recesivo, que la convierte en una especie de muy difícil reproducción masiva con técnicas tradicionales como la siembra de semilla por su escasa viabilidad (Mori et al., 2012). En este sentido, H. heptaphyllus presenta dificultades en la reproducción por métodos convencionales.
La aplicación con fines maderables y el uso medicinal, ornamental e industrial hacen que las especies del género Handroanthus sean de interés para su propagación mediante técnicas biotecnológicas. Por otra parte, considerando la necesidad actual de conservar la diversidad biológica, es de suma importancia aportar desarrollos científicos que permitan conservar ex situ especies vegetales amenazadas, tal como lo son las especies del género Handroanthus (Larraburu, 2014).
Para la producción de material vegetal seleccionado de especies forestales se requiere buen conocimiento de la biología reproductiva, así como de los condicionamientos fisiológicos que influyen en la capacidad morfogenética en relación con la juvenilidad de los materiales vegetales (Hodson de Jaramillo et al., 2004). En este sentido, el uso de la biotecnología para la propagación clonal de especies forestales constituye una estrategia de apoyo a la silvicultura (Schuler et al., 2005). El cultivo in vitro de tejidos vegetales permite la propagación clonal de especies de propagación vegetativa o de variedades que se pretenden someter a protocolos de transformación genética (Martínez, 2014). Sin embargo, son escasos los trabajos científicos que abordan la propagación in vitro de especies de este género y en general, parten de la germinación in vitro de semillas (Larraburu et al., 2012; Larraburu y Llorente, 2015; Duarte et al., 2016; Larraburu et al., 2018). En el caso del lapacho de flores blancas no se encontraron referencias sobre su propagación por cultivo in vitro.
La micropropagación podría constituirse en una alternativa viable para la producción masiva del lapacho de flores blancas para su utilización con fines ornamentales, de restauración forestal, y/o para reforestación. Atendiendo a las problemáticas relacionadas con su propagación este trabajo se propuso como objetivo establecer in vitro segmentos nodales de plantas jóvenes de Handroanthus heptaphyllus.
MATERIALES Y MÉTODOS
El experimento fue llevado a cabo en el laboratorio de Biotecnología del Departamento de Biología de la Facultad de Ciencias Agrarias de la Universidad Nacional de Asunción, ubicada en el Campus de la UNA en la ciudad de San Lorenzo, Paraguay.
Material vegetal
Se utilizaron 40 segmentos nodales provenientes de plantas jóvenes de dos años de edad de Handroanthus heptaphyllus (Vell.) Mattos (lapacho de flores blancas) las cuales fueron obtenidas por injerto provenientes de veinte plantas madre de esta especie. Para confirmar la identificación de la especie se procedieron a verificar las claves botánicas según Zapater et al. (2009).
Las plantas madre fueron mantenidas bajo malla de media sombra de 50% de densidad en el vivero forestal de la Facultad de Ciencias Agrarias, en la ciudad de San Lorenzo, Paraguay con coordenadas geográficas: 25°20´14,37” S y 57°30´53,37”.
Se utilizaron recipientes de cultivo de polietileno de 14 cm de diámetro y 11 cm de profundidad con seis orificios con un sustrato compuesto por tierra agrícola y estiércol vacuno en relación 1:1, sustrato previamente esterilizado por insolación, y el riego se llevó a cabo a partir de aspersores por 20 minutos una vez al día.
Para la atención fitosanitaria las plantas se trataron con una combinación de fungicidas Dithane M-80 de composición Mancozeb etileno bis de manganeso (ditiocarbamato) a una concentración de 3 g l-1 aplicadas por medio de un pulverizador manual una vez por semana durante tres meses.
Establecimiento in vitro
Los segmentos nodales (con al menos una yema) se cortaron de las plantas jóvenes (extraídos de la zona apical del tallo). Se conformaron dos grupos de 20 segmentos cada uno que se envolvieron en gasa, se colocaron en un recipiente previamente desinfectado con alcohol 70% (v/v) y provisto de hielo para el traslado al laboratorio.
En la cámara de flujo laminar se realizó el proceso de desinfección que consistió en sumergir los segmentos nodales en etanol 70% (v/v) durante 3 minutos. Posteriormente, se transfirieron a frascos que contenían hipoclorito de sodio comercial al 5.0% (v/v) (20 segmentos) o 10% (v/v) (20 segmentos) durante 5 min. Se realizaron tres enjuagues con agua destilada estéril y los segmentos se cortaron 3-4 mm por encima y por debajo de los nudos (para una longitud aproximada de 2 cm).
Finalmente, los segmentos se colocaron en posición vertical (a razón de 1 segmento por frasco) en frascos de cultivo de 30 ml de capacidad con 15 ml de medio de cultivo MS (Murashige y Skoog, 1962).
Los frascos se ubicaron en las cámaras de crecimiento a 25 °C, fotoperiodo de 16 horas luz/oscuridad proporcionadas por lámparas de 2000 lux durante 35 días.
Semanalmente se cuantificó el número de segmentos contaminados por microorganismos y se calculó el porcentaje de contaminación microbiana por tratamiento. Además, se cuantificó el número de explante vivos o con necrosis y se calcularon los porcentajes de supervivencia y de explantes necrosados.
Análisis estadísticos
Los resultados obtenidos del experimento fueron sometidos a ANAVA (Análisis de Varianza) y las medias fueron comparadas con la prueba de Tuckey al nivel de 5% de probabilidad. Se empleó el softwar INFOSTAT versión 2017.
RESULTADOS Y DISCUSIÓN
Aunque a la toma de muestras las plantas madre no presentaban síntomas de la presencia de hongos, el tratamiento de las plantas madre con fungicida Dithane M-80 de composición Mancozeb etileno bis de manganeso (ditiocarbamato) (3 g l-1) no impidió que en fase establecimiento se presentaran contaminantes fúngicos que crecían en el medio del cultivo alrededor de los explantes (Figura 1 a). Al respecto, Pariani (2015) sostuvo que los fungicidas son productos químicos usados para la prevención y/o eliminación de agentes patógenos o contaminantes fúngicos dentro del cultivo de tejidos y usualmente se incluyen en el protocolo de desinfección. Sin embargo, en este caso no resultaron efectivos para eliminar los hongos filamentosos asociados a los segmentos nodales, posiblemente saprofíticos. El fungicida Mancozeb ha sido empleado con frecuencia para el manejo de enfermedades fúngicas en especies forestales como han referido Carrero et al. (2003) para Eucalyptus cinerea. A su vez, Toro y Quiroz (2007) recomendaron su uso en el control preventivo de enfermedades fúngicas que afectan a especies forestales en vivero.

Figura 1. Segmentos nodales de Handroanthus heptaphyllus establecidos in vitro. a. explante contaminado con hongos, b. con necrosis, c. explante establecido a los 15 días de cultivo.
La contaminación microbiana se mostró en ascenso a medida que el tiempo de cultivo aumentó y se encontraron diferencias significativas entre los tratamientos de desinfección utilizados (p<0.05) a partir de los 12 días de establecidos in vitro. La desinfección con NaClO al 10.0% durante 5 minutos permitió que el 55.0% de los explantes estuviera libre de contaminantes microbianos visibles a los 35 días de cultivo (Figura 2). Este resultado cobra gran importancia ya que no se menciona el uso de segmentos nodales de plantas de lapacho crecidas en condiciones naturales para su establecimiento in vitro. En contraste, diferentes autores han propuesto protocolos de desinfección de semillas de H. serratifolius y recomendaron el uso de NaClO en concentraciones de 2.0 al 10.0% de cloro activo (Carvalho et al., 2008; Nery et al., 2008). Estos autores han informado también que altas concentraciones de este desinfectante pueden ser fitotóxicas.
Según Scherwinski-Pereira y da Silva (2010) la contaminación puede aparecer inmediatamente después del establecimiento del explante en el medio de cultivo o permanecer en modo de latencia. Investigaciones de Larraburu (2014) indicaron que la desinfección de explantes de H. impetinginosus mediante lavado bajo corriente de agua, tratamiento con NaClO y enjuagues con agua estéril permitió la obtención de un bajo porcentaje de contaminación (5-10%). En este ensayo el uso de hipoclorito de sodio comercial al 10% resultó efectivo para reducir la contaminación microbiana asociada a los explantes que podría atribuirse al estado sanitario de las plantas madre. En ensayos realizados por Carranza-Patiño et al. ( 2012) estos autores concluyeron que las limitaciones en el establecimiento in vitro de especies leñosas, se deben en gran medida a la contaminación microbiana de los explantes provenientes del invernadero.
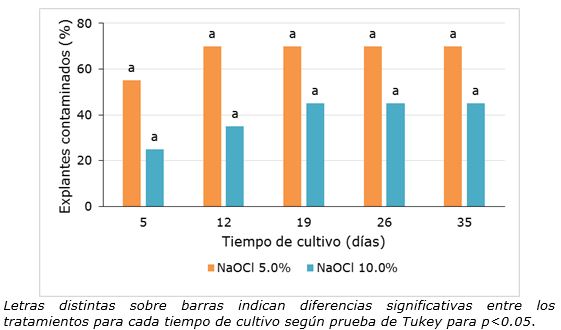
Figura 2. Porcentaje de contaminación microbiana en explantes procedentes de segmentos nodales de plantas jóvenes de Handroanthus heptaphyllus (Vell.) Mattos establecidos in vitro.
En este estudio, aunado a la presencia de contaminantes microbianos, se observó necrosis de los explantes (Figura 1 b). En el tratamiento con NaOCl comercial al 10% se observaron los mayores porcentajes de pérdidas (Figura 3).
Al respecto, se ha indicado que el uso de hipoclorito de sodio puede inhibir el crecimiento y provoca la muerte del explante en otras especies (Camargo y Pasqual, 1999) y ello es causa de pérdidas en el establecimiento in vitro como se comprobó en este ensayo. Autores como Romano et al. (2000) y Sotolongo (2003) informaron que el uso de hipoclorito de sodio durante 15 a 20 minutos disminuyó la contaminación microbiana, pero puede provocar la necrosis tisular e inclusive la muerte del explante. Varios desinfectantes se utilizan con frecuencia para la desinfección de explantes en el establecimiento in vitro de plantas leñosas. Por ejemplo, Carranza-Patiño et al. (2012) emplearon 15 g de hipoclorito de calcio durante 20 minutos en la micropropagación de árboles mediterráneos y lograron 95% de explantes vivos y libres de contaminación por hongos y bacterias. Asimismo, Pérez et al. (2012) utilizaron hipoclorito de sodio al 10% durante 10 minutos en la micropropagación de Swietenia macrophylla King y redujeron la contaminación al 14%. Indacochea et al. (2018), en sus investigaciones de establecimiento in vitro de Tabebuia billbergii, determinaron que el tratamiento con 1% Povidyn® por 20 min + 15% NaClO + 2 gotas Tween por 5 min + 0.5% HgCl2 por 5 min, resultó ser el mejor, debido a que el porcentaje de supervivencia de los explantes fue alto del 88%. Atendiendo a los resultados, se requiere continuar los estudios en aras de establecer estrategias que disminuyan la presencia de contaminantes fúngicos en el establecimiento de explantes nodales de H. heptaphyllus sin comprometer su supervivencia por la acción del desinfectante.
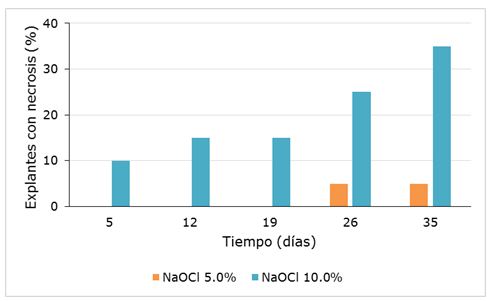
Figura 3. Porcentaje de explantes (segmentos nodales de plantas jóvenes) de Handroanthus heptaphyllus (Vell.) Mattos con necrosis en el establecidos in vitro.
Por otro lado, se conoce que las especies leñosas poseen una elevada cantidad de compuestos fenólicos, los cuales son las responsables del ennegrecimiento o la muerte celular de los explantes. Teixeira (2001) afirmó que cuando se extrae un explante de la planta madre, la primera respuesta del tejido es la oxidación de compuestos fenólicos en el sitio de corte. Esta podría ser otra causa de influencia en la necrosis de los explantes de H. heptaphyllus.
Roca y Mroginski (1991) mencionaron que los explantes con alto contenido de polifenoles, complican el cultivo in vitro ya que la oxidación de esta sustancia produce oscurecimiento y eventual muerte de los explantes. La oxidación u oscurecimiento de tejidos cultivados in vitro, se puede atribuir a la oxidación por radicales libres, de diferentes componentes celulares, así como, la oxidación de compuestos fenólicos catalizado por la enzima polifenol oxidasa (PPO) para producir quinonas, las cuales son especies químicas muy reactivas y propensas a reaccionar, generando daño e incluso la muerte celular (Bray et al., 2000). Azofeifa (2009) mencionó que la oxidación de tejidos y la exudación de fenoles, están interrelacionadas e influenciadas por un número de factores que incluyen al genotipo, el tratamiento de desinfección y el medio de cultivo. Estos factores deben tenerse en cuenta también para futuros experimentos.
Considerando las pérdidas por contaminación microbiana y necrosis de los explantes la supervivencia a los 35 días de cultivo llegó al 25% en el tratamiento con hipoclorito de sodio al 5% y al 25% en el tratamiento con el desinfectante al 10% (Figura 4). En el primero la mayor incidencia de pérdidas estuvo asociada a la contaminación microbiana y en el segundo a la necrosis de los explantes. No obstante, se lograron establecer in vitro segmentos nodales de plantas jóvenes de H. heptaphyllus de flores blancas (Figura 1 c).
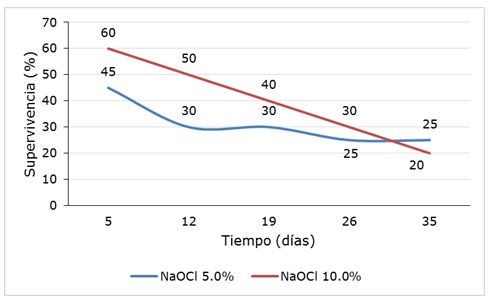
Figura 4. Porcentaje de supervivencia de explantes (segmentos nodales de plantas jóvenes) de Handroanthus heptaphyllus (Vell.) Mattos establecidos in vitro.
Sin embargo, atendiendo a que los estudios en el género Handroanthus son escasos y tomando en cuenta el criterio de Larraburu et al. (2012) de que cualquier mejora en los protocolos para el cultivo in vitro de este son importantes ya que proveen información valiosa, los resultados de este trabajo son alentadores y sientan las bases para el uso de un nuevo tipo de explante. A la vez, indican la posibilidad de propagar in vitro el lapacho blanco y contribuir a su conservación, restauración y uso. Los principales estudios en este sentido se han centrado en el lapacho rosado (H. impetiginosus) (Larraburu et al., 2012; Larraburu y Llorente, 2015), negro (H. heptaphylus) (Duarte et al., 2016) y amarillo (H. ochraceous) (Llorente et al., 2016; Larraburu et al., 2018).
CONCLUSIONES
El uso se segmentos nodales de plantas jóvenes de H. heptaphylus de flores blancas permite su establecimiento in vitro como primer paso para la micropropagación de esta especie. Se requiere continuar los estudios para incrementar los porcentajes de supervivencia a partir de este tipo de explante.
AGRADECIMIENTOS
Este trabajo fue financiado a través del Laboratorio de Biotecnologia de la Facultad de Ciencias Agrarias de la Universidad Nacional de Asunción. Los financistas no tuvieron participación en el diseño del estudio, la colecta y análisis de los datos, la decisión de publicar o la preparación del manuscrito es de la institución y el colectivo de autores del proyecto.
Conflicto de interés
Los autores no declaran conflicto de intereses.
Contribución de los autores
Conceptualización MIDL, JMRR, LRGS y MVO, Análisis formal MIDL, JMRR, LRGS y MVO, Investigación MIDL, JMRR, LRGS y MVO, Metodología MIDL, JMRR, LRGS y MVO, Recursos MIDL y LRGS, Supervisión MIDL, Escritura: primera redacción MIDL, JJRR Y LRGS, Escritura: revisión y edición de MIDL.
REFERENCIAS
Azofeifa A (2009) Problemas de oxidación y oscurecimiento de explantes cultivados in vitro. Agronomía Mesoamericana 20(1): 153-175
Bray E, Bailey-Serres, J, Weretilnyk E (2000) Responses to abiotic stresses. En: Buchanan B, Gruissem W, Jones R (Eds). Biochemistry and molecular biology of plants, pp. 1158-1203. American Society of Plant Physiologists, Maryland
Camargo JT, Pasqual M (1999) Efeito do escuro e do seccionamento de internódios do porta-enxerto de macieira, cv. Marubakaido, na calogênese in vitro. Revista Brasileira de Agrociência 5: 81-83
Carranza-Patiño H, Reyes-Morán W, Mora-Silva W, Cevallos-Falquez O, Escobar-Troya E, Cadme- Arévalo M, Nieto-Rodríguez J, Morante-Carriel J (2012) Propagación clonal in vitro de Swietenia macrophylla King (CAOBA). Ciencia y Tecnología 6(2): 1-8
Carrero C, Cedeño L, Quintero K, Pino H, Rodríguez L (2003) Identificación y sensibilidad in vitro a fungicidas del agente causal de la podredumbre del tallo en plántulas de Eucalyptus cinerea. Asociación Interciencia 28(11): 656-659
Carvalho LMM, Nery MC, Oliveira LM, Hilhorst HWM, Guimarães RM (2008) Morphophysiological development of Tabeluia serratifolia Vahl Nich. seeds. Scientia Agricola 65: 643-651
Digilio A, Legname P (1966) Los árboles indígenas de la provincia de Tucumán. Opera Lilloana 15, Universidad Nacional de Tucumán, Tucumán, Argentina
Duarte E, Sansberro P, Luna C (2016) Micropropagation of Handroanthus heptaphyllus (Vell.) Mattos from seedling explants. Afr J Biotechn 15: 1292–1298
Gallo E, Mansilla N, Díaz B (1999) Predicción del color de flores observando la pigmentación de los brotes en lapacho rosado. Centro de Estudios Regiones secas Tomo XVI Fundación CERS, Tucumán-Catamarca
Hodson de Jaramillo E, Ramírez C, Schuler I (2004) Biotecnología y producción forestal sostenible. En: Saile P, Torres M (eds). Conferencia Internacional de Bosques, Colombia: País de Bosques y Vida, pp. 251-256. Santa Marta, Bogotá DC
Indacochea B, Parrales J, Hernández A, Castro C, Vera M, Zhindón A, Julio Gabriel J (2018) Evaluación de medios de cultivo in vitro para especies forestales nativas en peligro de extinción en Ecuador. Revista Agronomía Costarricense 42(1): 63-89
Larraburu EE (2014) Morfogénesis in vitro de Handroanthus impetiginosus (Mart. ex DC.) Tesis Doctor en Ciencias Aplicadas, Universidad Nacional de Luján, Luján, Argentina
Larraburu EE, Llorente BE (2015) Azospirillum brasilense enhances in vitro rhizogenesis of Handroanthus impetiginosus (pink lapacho) in different culture media. Annals of Forest Science 72(2): 219-29
Larraburu EE, Apóstolo NM, Llorente BE (2012) In vitro propagation of pink lapacho: response surface methodology and factorial analysis for optimisation of medium components. Int J Forest Res 318258: 9; doi:10.1155/2012/318258
Llorente BE, Alasia MA, Larraburu EE (2016) Biofertilization with Azospirillum brasilense improves in vitro culture of Handroanthus ochraceus, a forestry, ornamental and medicinal plant. New Biotechnology 33: 32-40
Lozano EC, Zapater MA (2008) Delimitación y estatus de Handroanthus heptaphyllus y H. impetiginosus. Darwiniana 46(2): 304-317
Martínez E (2014) Cultivo in vitro mediante embriogénesis somática y transformación genética del maíz con genes biosíntesis de trehalosa. Chapingo, Texcoco, México
Mori NT, Teixeira de Moraes ML, Morita CM, Mori ES (2012) Genetic diversity between and within populations of Handroanthus heptaphyllus (Vell.) Mattos using microsatellite markers. Cerne Lavras 8: 9-15
Murashige T, Skoog F (1962) Revised Medium for Rapid Growth and Bioassays with tobacco tissue cultures. Physiologia Plantarum 15(3): 473-497
Nery MC, Carvalho MLM de, Oliveira LM de, Nery FC, Silva DG (2008) Germinação in vitro e ex vitro de embriões/sementes de Tabebuia serratifolia (Vahl) Nich. Cerne Lavras 14(1): 1-8
Pariani S (2015) La incubadora condiciones ambientales de cultivo-asepsia. En: Sharry S, Adema M, Abedini W (Eds). Plantas de probeta manual para la propagación de plantas por cultivo de tejidos in vitro, coordinación general 1a ed adaptada, pp.73-79. Universidad Nacional de La Plata, La Plata
Pérez J, Mesén F, Aguilar M, Hilje L (2012) Desarrollo de un método de micropropagación aplicable a genotipos selectos de Cedrela odorata L. optimización de la fase de multiplicación. Revista Forestal Centroamericana 38: 67-71
Roca WM, Mroginski LA (1991) Cultivo de tejidos en la agricultura. Fundamentos y aplicaciones. CIAT, Cali
Romano A, Barros S, Martins MA (2000) Micropropagation of the Mediterranean tree Ceratonia siligua. Plant Cell Tissue and Organ Culture 68: 35-41
Scherwinski-Pereira JE, da Silva FHC (2010) Contaminações microbianas na cultura de células, tecidos e órgãos de plantas. Embrapa, Brasilia
Schuler I, Baquero S, Gaona D, Vega E, Ramirez R, Nieto V, Hodson E (2005) Propagación in vitro del material seleccionado de Tabebuia rosea (Bertol.) DC. (Ocobo) y Cordia alliodora (Ruiz & Pav) Oken (Nogal cafetero). Revista Colombiana de Biotecnología 7(1): 39-50
Sotolongo SR (2003) Micropropagación de Psidium salutare (Myrtaceae). Revista del Jardín Botánico Nacional 24(1-2): 245-250
Teixeira JB (2001) Limitações ao processo de cultivo in vitrode espécies lenhosas EMBRAPA Recursos Genéticos e Biotecnologia. Disponible en: http://es.scribd.com/doc/60042247/limitacoes-na-cultura-in-vitro-de-lenhosas. Consultado 20/04/2017
Toro J, Quiroz I (2007) Fertilización de Eucalyptus globulus producidos en contenedor. Trama Impresores SA, Chile
Zapater MA, Califano L, Del Castillo E, Quiroga M, Lozano E (2009) Las especies nativas y exóticas de Tabebuia y Handroanthus (Tecomeae, Bignoniaceae) en Argentina. Darwiniana 47(1): 185-220
Recibido: 02-05-2020
Aceptado: 07-07-2020
Copyright (c) 2021 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
