Artículo original
Biotecnología Vegetal Vol. 21, No. 3: 211 - 223, julio - septiembre, 2020
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Inducción de respuestas defensivas en caña de azúcar frente a Sugarcane mosaic virus con dos bioproductos
Induction of defensive responses in sugarcane against Sugarcane mosaic virus with two bioproducts
José Alberto De la Fé Isaac1*https://orcid.org/0000-0003-1768-1044
Yaquelin Puchades Izaguirre1 https://orcid.org/0000-0001-6608-4997
María La O Hechavarría1 https://orcid.org/0000-0002-1469-8038
María de los Ángeles Zardón Navarro1 https://orcid.org/0000-0003-3625-5614
Ariel Arencibia Rodríguez1 https://orcid.org/0000-0002-7631-1329
Manuel Serrat Díaz2 https://orcid.org/0000-0003-1482-2454
1Instituto de Investigaciones de la Caña de Azúcar. Carretera a CUJAE, km 1½. Boyeros. La Habana. Cuba.CP 19390.
2Centro de Estudios de Biotecnología Industrial, Facultad de Ciencias Naturales y Exactas, Universidad de Oriente.Avenida Patricio Lumumba S N. Santiago de Cuba. Cuba. CP 90500. 000.
*Autor para correspondencia e-mail: jose.delafe@inicasc.azcuba.cu
RESUMEN
La caña de azúcar (Saccharum spp.), principal cultivo azucarero a nivel mundial, es afectada por múltiples agentes patógenos. Una de las enfermedades virales más importantes en este cultivo es el mosaico, causado por Sugarcane mosaic virus (SCMV). Esta investigación se realizó con el objetivo de demostrar la capacidad de dos bioproductos para inducir una respuesta de defensa contra este virus. El primero basado en la encapsulación de la enzima endopoligalacturonasa de la levadura Kluyveromyces marxianus CCEBI 2011 y otro cuyo principio activo está constituido por compuestos fenólicos producidos por caña de azúcar en biorreactores de inmersión temporal. Los cultivares SP70-1284 susceptible al SCMV y C323-68 resistente, fueron tratados con los bioproductos e inoculados con SCMV. Se evaluó la severidad de la infección, la acumulación de radicales superóxido y la expresión de 10 genes relacionados con la defensa. El cultivar resistente no presentó síntomas de infección durante el desarrollo del experimento, mientras que en el susceptible la aplicación de ambos bioproductos disminuyó la severidad de la infección entre 38.9 y 44.4% con respecto al control. Se observó la presencia de radicales superóxido en las primeras horas de interacción caña de azúcar – SCMV, mientras que a los 28 días post inoculación, se apreció una expresión diferenciada de tres genes relacionados con la defensa antiviral. Se demostró la capacidad de ambos bioproductos para inducir respuestas defensivas en caña de azúcar contra el SCMV.
Palabras clave: elicitor, endopoligalacturonasa, fenoles, genes R
ABSTRACT
Sugarcane (Saccharum spp.), main sugar crop worldwide, is affected by multiple pathogens. One of the most important viral diseases in this crop is mosaic, caused by Sugarcane mosaic virus (SCMV). This research was conducted with the objective of demonstrating the ability of two bioproducts to induce defenses response against this virus. The first based on the encapsulation of the endopolygalacturonase enzyme of the yeast Kluyveromyces marxianus CCEBI 2011 and another whose active principle is constituted by phenolic compounds produced by sugarcane in temporary immersion bioreactors. SP70-1284 cultivars susceptible to SCMV and resistant C323-68 were treated with the bioproducts and inoculated with SCMV. The severity of the infection, the accumulation of superoxide radicals and the expression of 10 defense-related genes were evaluated. The resistant cultivar did not show symptoms of infection during the development of the experiment, while in the susceptible the application of both bioproducts decreased the severity of the infection between 38.9 and 44.4% with respect to the control. The presence of superoxide radicals was observed in the first hours of sugarcane-SCMV interaction, while at 28 days’ post inoculation, a differentiated expression of three genes related to antiviral defense was observed. The ability of both bioproducts to induce defensive responses in sugarcane against SCMV was demonstrated.
Keywords: elicitor, endopolygalacturonase, phenol, R genes
INTRODUCCIÓN
Uno de los principales problemas que enfrenta la agricultura en la actualidad es el ataque de organismos fitopatógenos. Según estimaciones de la FAO anualmente entre el 20 y el 40% de la producción mundial de alimentos se pierde por las plagas, lo cual cuesta a la economía alrededor de 220 mil millones de dólares (FAO, 2019).
Las enfermedades causadas por los virus de las plantas son un problema importante en el cultivo de muchas especies vegetales y ornamentales en todo el mundo. Durante mucho tiempo, estos agentes patógenos han sido controlados mediante medidas convencionales como la rotación de cultivos, detección temprana, destrucción de plantas infectadas, protección cruzada, mejoramiento genético para la búsqueda de resistencia y control químico de sus vectores (Nicaise, 2014). Por otra parte, el entendimiento de los mecanismos de resistencia de las plantas frente a microorganismos patógenos ha permitido el desarrollo de nuevas tecnologías más eficientes y respetuosas con el ambiente, entre las que se encuentra el uso de la resistencia inducida (Enríquez et al., 2010).
Las plantas pueden percibir la presencia de agentes patógenos a través del reconocimiento de patrones moleculares asociados a organismos patógenos (PAMP, del inglés: Pathogen-Associated Molecular Patterns) o patrones moleculares asociados a daños (DAMP, del inglés: Damage-Associated Molecular Patterns) por los receptores de reconocimiento de patrones de sus células. Este reconocimiento desencadena la primera capa del sistema inmunitario de las plantas, denominada inmunidad desencadenada por PAMP / DAMP (PTI). La segunda capa, se activa cuando los microorganismos patógenos son capaces de burlar la PTI, se denomina inmunidad desencadenada por efectores (ETI), y comienza cuando las proteínas de resistencia de la planta reconocen estos efectores patógenos (Zvereva y Pooggin, 2012).
El término elicitor se empleó originalmente para moléculas capaces de inducir la producción de fitoalexinas, sin embargo, luego se le considera así a los compuestos que estimulan cualquier tipo de respuesta defensiva en plantas (Mishra et al., 2012). Estos productos se han utilizado para proteger las plantas contra varios organismos patógenos, dentro de los que se encuentran los virus (Chiu et al., 2018).
El mosaico de la caña de azúcar causado por Sugarcane mosaic virus (SCMV) provoca importantes pérdidas en los rendimientos azucareros a nivel mundial. Los métodos más efectivos para el manejo son el empleo de cultivares resistentes y la plantación de semilla sana. El proceso tradicional de selección de un nuevo cultivar de caña de azúcar (Saccharum spp.) toma entre 10 y 12 años (Santana et al., 2014), y en las últimas décadas se ha utilizado la ingeniería genética para obtener nuevos cultivares resistentes a la enfermedad (Guo et al., 2015; Yao et al., 2017). A pesar de esto es necesario evaluar la efectividad de otras alternativas para atenuar las pérdidas ocasionadas por este virus, ya que una vez plantado un campo con un cultivar susceptible, la única manera de controlar un brote de esta enfermedad sería la demolición de la plantación.
La O et al. (2016) realizaron la detección de genes relacionados con la defensa en cultivares de caña de azúcar inoculados con SCMV, para ello utilizaron ocho pares de cebadores de genes relacionados con la resistencia (genes R) expresados anteriormente en la interacción caña de azúcar - Sporisorium scitamineum. El uso de estos genes R pueden servir como una herramienta más durante la selección de cultivares resistentes, o de productos destinados a elevar la resistencia de cultivares susceptibles a los diversos microorganismos patógenos que afectan al cultivo.
En caña de azúcar se ha estudiado el papel de bioproductos contra agentes patógenos. Por ejemplo, Chalfoun et al. (2018) desarrollaron un bioestimulante derivado de una proteasa extracelular de Acremonium strictum W.Gams, el cual presentó un efecto protector contra la enfermedad de la raya roja producida por la bacteria Acidovorax avenae (Manns) Willems. Por otro lado, Ashwin et al. (2018) lograron inducir respuestas defensivas contra la enfermedad de la pudrición roja en el cultivar susceptible CoC 671, ocasionada por el hongo Colletotrichum falcatum Went, y para ello utilizaron un bioproducto basado en una proteína secretada por este mismo organismo patógeno. La aplicación foliar de un bioproducto basado en ARN se ha utilizado para elevar la defensa de varias especies vegetales contra diversos virus (Dubrovina y Kiselev, 2019), incluido SCMV. Gan et al. (2010) lograron inducir resistencia en maíz (Zea mays L.) frente a este agente patógeno con la aplicación de ARN bicatenarios (dsRNA, del inglés: double-stranded RNAs).
Ante la necesidad de otras alternativas para el manejo del mosaico de la caña de azúcar se requiere la búsqueda de nuevos productos para elevar la calidad y rendimientos del cultivo. Atendiendo a lo anterior, la presente investigación se realizó con el objetivo de demostrar la capacidad de dos bioproductos para inducir una respuesta de defensa contra SCMV en plantas de caña de azúcar.
MATERIALES Y MÉTODOS
Esta investigación se desarrolló en la Estación Territorial de Investigaciones de la Caña de Azúcar (ETICA) “Oriente-Sur”, en Palma Soriano, Santiago de Cuba, Cuba.
Material vegetal
Se utilizaron propágulos de 5 cm con una yema, provenientes de plantas de caña de azúcar (Saccharum spp.) de los cultivares SP70-1284 y C323-68, susceptible y resistente al SCMV respectivamente, según los datos del software SC-RESIST (La O et al., 2012), crecidas durante ocho meses en banco de semilla en condiciones de riego. Las atenciones culturales y fitosanitarias se realizaron según el instructivo técnico para el manejo de la caña de azúcar (Santana et al., 2014).
Los propágulos se plantaron a una distancia de 5 cm entre sí en canteros con 1.0 m de ancho por 4.0 m de largo y altura de 0.25 m. El sustrato consistió en suelo Pardo con carbonatos (Hernández et al., 1999). Las atenciones culturales y fitosanitarias se realizaron según el instructivo técnico para el manejo de la caña de azúcar (Santana et al., 2014).
Inoculación de las plantas con SCMV
El inóculo del virus se preparó a partir de jugo de hojas sintomáticas del cultivar B34104 (que se mantiene naturalmente infectado en una colección in vivo de inóculo de SCMV localizado en la Estación Provincial de Investigaciones de la Caña de Azúcar “Holguín”) mezclado con un polvo abrasivo (tierra de infusorios). La inoculación con el SCMV se realizó según Puchades et al. (2016) mediante frotación de las hojas +3 con motas de algodón embebidas en la preparación viral.
Aplicación de bioproductos
Se utilizaron dos bioproductos con el fin de inducir respuestas defensivas en caña de azúcar frente al SCMV. El primero, referido en lo adelante como Bioproducto - UO (BP-UO), se obtuvo en conjunto entre la ETICA Oriente - Sur y el Centro de Estudios de Biotecnología Industrial perteneciente a la Universidad de Oriente. Está basado en la encapsulación de una enzima endopoligalacturonasa (endoPG) de la levadura Kluyveromyces marxianus Van der Walt CCEBI 2011 en liposomas (Serrat et al., 2019). El segundo, denominado Bioproducto - VC (BP-VC), se obtuvo en la ETICA Villa Clara. Su principio activo está constituido por compuestos fenólicos producidos por caña de azúcar en biorreactores de inmersión temporal (Arencibia et al., 2008).
Se asperjó el área foliar de cada planta con 50 ml de los productos, con ayuda de frasco atomizador hasta punto de goteo. Se realizaron tres aplicaciones de los productos: a las 72 h y 1 h antes de la inoculación con SCMV, y 72 h después de esta. Se utilizaron cuatro tratamientos: 1) BP-UO + Inoculación SCMV, 2) BP-VC + Inoculación SCMV, 3) Inoculación SCMV (control de infección), 4) Sin inocular (control sano). Se utilizó un diseño completo al azar con tres repeticiones por tratamiento y 20 plantas por réplica.
Se realizaron muestreos que consistieron en fracciones del tercio medio de cinco hojas +3, a las 2 y 4 h post inoculación (hpi) para los estudios histológicos, y a los 28 días para la extracción de los ácidos nucleicos totales, estas últimas se conservaron a - 20 °C hasta su procesamiento.
Determinación de la severidad de infección por SCMV
Para la evaluación de la presencia de síntomas en las plantas, a los 28 días posteriores a la inoculación (dpi) se utilizó una escala visual de tres categorías, adaptada de la propuesta por da Silva et al. (2015). En esta 0 = sin síntomas, 1 = síntomas leves en hojas jóvenes, 2 = síntomas severos (mosaico generalizado con reducción del crecimiento). Con los valores registrados se determinó el porcentaje de severidad de la infección viral, calculado mediante la ecuación de Townsend – Heuberger (Townsend y Heuberger, 1943):
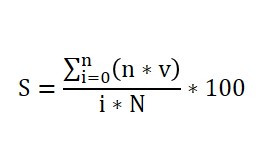
donde:
S= Severidad del ataque expresada como porcentaje
v= Valor de la categoría
i= Valor de la categoría más alta
n= No de plantas (partes de plantas) en cada categoría
N= No total de plantas (partes de plantas) investigadas
Análisis estadístico
Los datos originales se comprobaron de acuerdo con su normalidad y homogeneidad de varianza mediante prueba de Kolmogorov-Smirnov & Lilliefors; al no seguir una distribución normal, se utilizó la fórmula y = log (x+1) para transformar los porcentajes de severidad. Para la comparación de las medias entre tratamientos se aplicó la prueba de Tukey (p< 0.05).
Detección histoquímica de radicales superóxido
Para analizar la producción in situ de radicales superóxidos se utilizó la tinción histoquímica con nitroazul de tetrazolio (NBT, del inglés, Nitro Blue Tetrazolium), según Wohlgemuth et al. (2002) con modificaciones.
Las muestras foliares tomadas en fracciones del tercio medio de cinco hojas +3, a las 2 y 4 hpi, se sumergieron en solución amortiguadora fosfato de potasio 50 mmol l-1, pH 8 que contenía 0.1% (m/v) de NBT y azida sódica 10 mmol l-1. Para asegurar la infiltración del NBT, se hicieron dos golpes de vacío de 1 min cada uno. Seguidamente las muestras se incubaron en oscuridad durante 2 horas; y luego fueron sumergidas en hipoclorito de sodio 5% (v/v) hasta eliminar completamente la clorofila.
La acumulación de superóxido se estimó por observación en el microscopio estereoscopio de los depósitos negro - azulados de formazán (compuesto resultante de la interacción entre la solución NBT y los radicales superóxidos) en los tejidos foliares. Se utilizó una escala de tres niveles (Figura 1): 3 (Alto) = acumulación de gran cantidad de manchas en el tejido foliar, 2 (Medio) = acumulación de manchas dispersas y/o formación de líneas, 1 (Bajo) = acumulación de pocas manchas o ninguna. Se realizaron cortes transversales para observar en el microscopio óptico las acumulaciones intra-tisulares de radicales.

Figura 1. Niveles de acumulación de radicales superóxidos en tejidos foliares de caña de azúcar (Saccharum spp.) tras la tinción con NBT y la eliminación de la clorofila con NaClO 5% (v/v): A: 3 (Alto) = acumulación de gran cantidad de manchas en el tejido foliar, B: 2 (Medio) = acumulación de manchas dispersas y/o formación de líneas, C: 1 (Bajo) = acumulación de pocas manchas o ninguna.
Expresión de genes relacionados con la resistencia en Saccharum spp.
Para detectar la expresión de genes relacionados con la resistencia en los tejidos de las plantas de caña de azúcar tratadas con bioproductos se utilizaron 10 pares de cebadores para genes relacionados con la resistencia (Tabla 1), basados en el análisis de 243 secuencias previamente informadas sobre la interacción caña de azúcar - Sporisorium scitamineum (Heinze et al., 2001; Thokoane y Rutherford, 2001; La O et al., 2008; Que et al., 2011).
Tabla 1. Secuencia de cebadores, temperatura de anillamiento y tamaño esperado de los genes relacionados con la resistencia a agentes patógenos en caña de azúcar (Saccharum spp.) utilizados en el ensayo de expresión.

Extracción de ácidos nucleicos totales
La extracción de ácidos nucleicos totales se realizó por el método de bromuro de cetil trimetil amonio (CTAB) modificado por Racedo et al. (2016) en las fracciones del tercio medio de cinco hojas +3 tomadas a los 28 días después de la inoculación. La concentración y calidad del ARN se verificó mediante electroforesis en gel de agarosa 1.5%. El ADN presente en la muestra se eliminó por tratamiento con ADN-asa (Promega).
Amplificación de genes relacionados con la resistencia
El ADNc se sintetizó con la enzima reverso-transcriptasa M-MLV (Promega), según las especificaciones del proveedor; se empleó un oligo-dT como cebador y 1 μg de ARN libre de ADN. Las reacciones se realizaron con el siguiente programa: un ciclo de 25 °C (10 min); un ciclo de 42 °C (59 min); un ciclo de 95 °C (5 min); y un ciclo final a 4 °C durante 10 min.
La mezcla de PCR se realizó con 100 ng ADNc, 25 pmol de cada cebador, 2.5 μl de solución amortiguadora para PCR 1X (HeberBiotec), 2.5 μl MgCl2 (HeberBiotec), 0.5 μl dNTPs 10 μmol l-1 (HeberBiotec), 0.4 unidades de ADN-polimerasa (HeberBiotec) y agua tratada con dietil pirocarbamato, hasta un volumen final de 25 μl. Las reacciones se realizaron con el siguiente programa: un ciclo de 94 °C (3 min) 30 ciclos de 94 °C (30 s) / 52, 54, 56 °C (30 s) / 72 °C (1 min); un ciclo de 72 °C (10 min); y un ciclo final a 4 °C durante 10 min. Los resultados de la amplificación (5 μl) se visualizaron en gel de agarosa 1.5% teñido con Bromuro de etidio (Scharlau, España) 0.5 µg ml-1 sobre un transiluminador UV (Vilver Lourmat, Francia).
Análisis de expresión diferencial de genes relacionados con la resistencia
Para cada combinación de cultivar - gen - tratamiento, los datos se registraron como "1" para "presencia" y "0" para "ausencia". Con el empleo del software NTSYSpc v2.1 se realizó un análisis de agrupamiento jerárquico basado en la matriz de covarianza genética estimada, mediante el método de la media aritmética de grupos pareados desbalanceados (UPGMA) y coeficiente de disimilitud como medida de la diferencia entre grupos. Se tuvo en cuenta no fusionar conjuntos demasiado lejanos, como criterio de parada del agrupamiento.
RESULTADOS Y DISCUSIÓN
Determinación de la severidad de infección por SCMV
El cultivar resistente (C323-68) no presentó síntomas de SCMV durante el desarrollo del experimento; mientras que el susceptible mostró una respuesta que varió en función de los tratamientos aplicados (Figura 2). Las plantas del control sano sin inocular tenían un color verde uniforme en todas las hojas (sin síntomas de SCMV) (Figura 3 A). En el control de infección (Tratamiento 3) se observaron plantas con un patrón de zonas de color verde oscuro alternadas con otras más claras (síntoma típico del mosaico). También se apreciaron plantas con síntomas leves (mosaico ligero en hojas jóvenes) (Figura 3 B) y otras con síntomas severos de la enfermedad (clorosis y disminución en el crecimiento) (Figura 3 C). Las plantas tratadas con BP-UO disminuyeron la severidad de la infección en 44.4% con respecto al control de infección, mientras que las tratadas con BP-VC lo hicieron en 38.9%, lo cual es señal de la efectividad de los bioproductos para contrarrestar la infección viral.

Figura 2. Respuesta del cultivar de caña de azúcar (Saccharum spp.) SP70-1284 (susceptible al SCMV) a los 28 días después de aplicados dos bioproductos en los tratamientos: T1: BP-UO+SCMV; T2: BP-VC+SCMV; T3: inoculado con SCMV; T4: control sano sin inocular.

Figura 3. Síntomas de mosaico en el cultivar de caña de azúcar SP70-1284 (susceptible al SCMV) a los 28 dpi: A: sin síntomas; B: síntomas leves; C: síntomas severos.
En un estudio previo se demostró que BP-UO logra disminuir la severidad de esta enfermedad en caña de azúcar (Serrat et al., 2019). El BP-UO contiene una enzima endoPG, capaz de generar dentro de las plantas pequeños fragmentos de pectina derivados de la pared celular, llamados oligogalacturónidos (OGAs). Estos son elicitores capaces de inducir la acumulación de glucanasas y quitinasas, la deposición de calosa y lignina en la pared celular (Nafisi, 2015), así como la acumulación de fitoalexinas (Hou et al., 2019). Otras respuestas desencadenadas por los OGAs incluyen el incremento de la concentración del Ca2+ citoplasmático y la activación de componentes de las vías del ácido salicílico, del jasmonato y del etileno (Pavlopoulou et al., 2019).
BP-VC logró activar respuestas defensivas en plantas de tomate (Solanum lycopersicum L.) frente a la bacteria Ralstonia solanacearum L., agente causal de la marchitez bacteriana (Yang et al., 2010). Entre las funciones atribuidas a los metabolitos fenólicos se encuentran la lignificación de la pared celular, acción antioxidante, y control de la homeostasis durante el desarrollo de las plantas (Yang et al., 2010). Arencibia et al. (2008) encontraron que plantas de caña de azúcar del cultivar Badila micropropagadas en presencia de metabolitos fenólicos, expresaron genes relacionados con el metabolismo celular y el desarrollo, la defensa de las plantas, las vías de las auxinas, de los fenilpropanoides y las explosiones oxidativas.
Detección histoquímica de radicales superóxido (O2·-)
La tinción con NBT permitió la detección de radicales superóxido durante las primeras horas de infección con SCMV. La acumulación de estas especies se pudo observar con la formación de puntos y líneas de color negro azulados (Figura 4 A, B). Su acumulación en las hojas de caña de azúcar estuvo localizada principalmente en las células del haz vascular (Figura 4 C).

Figura 4. Acumulación de radicales superóxido en hojas de caña de azúcar (Saccharum spp.) (cultivar SP70-1284 inoculado con SCMV, susceptible). A: después de la tinción con NBT; B: después de la tinción con NBT y sin clorofila; C: corte transversal de una hoja teñida con NBT y sin clorofila (aumento 40x).
Al analizar las hojas de caña de azúcar teñidas con NBT se identificaron tres niveles de acumulación de superóxido (Figura 5). En el cultivar resistente el control sano sin inocular presentó un nivel medio de acumulación de radicales superóxido. La inoculación con el virus y la aplicación de los bioproductos mantuvieron bajos niveles de O2·- a las 2 hpi. Mientras que a las 4 hpi el tratamiento con BP-UO alcanzó un nivel alto, al igual que el control de infección (Tratamiento 3).
En el cultivar susceptible el control sano sin inocular presentó un nivel bajo de acumulación de O2·-. A las 2 hpi el tratamiento con BP-UO (Tratamiento 1) mostró un nivel medio de acumulación de radicales superóxido, que se mantuvo a las 4 hpi. El tratamiento con BP-VC (Tratamiento 2) mostró bajo nivel de O2·- a las 2 y 4 hpi. El control de infección a las 4 hpi mantuvo un nivel alto de especies de O2·-.

Figura 5. Acumulación de radicales superóxido en los cultivares de caña de azúcar C323-68 (resistente al SCMV) y SP70-1284 (susceptible al SCMV) en respuesta a la aplicación de dos bioproductos en los tratamientos: T1: BP-UO+SCMV; T2: BP-VC+SCMV; T3: inoculado con SCMV; T4: control sano sin inocular. Niveles de Acumulación: 1: Bajo; 2: Medio; 3: Alto.
Los resultados anteriores mostraron que ambos cultivares de caña de azúcar acumulan niveles basales de O2·-, aunque con distinta intensidad. La aplicación de los bioproductos mantuvo o disminuyó tales niveles, mientras que la infección viral aumentó las especies de O2·-. Se puede inferir que la producción de O2·- está relacionada con la capacidad de la caña de azúcar para protegerse contra la infección por SCMV, aunque esta vía por sí sola no es garantía de resistencia a la enfermedad. Las células mantienen niveles bajos de especies reactivas de oxígeno (ROS) y cualquier desviación de este balance puede ser utilizado para la señalización mediante ROS (Mittler, 2017).
Los OGAs producidos in situ en las plantas por la acción de la enzima endoPG pueden provocar este tipo de respuesta, ya que se ha comprobado anteriormente que inducen la formación de ROS (Hou et al., 2019). Otra respuesta que ha sido informada ante la presencia de estos elicitores es la expresión de genes relacionados con la defensa (Hou et al., 2019). Por otro lado, se ha indicado que los compuestos fenólicos son potentes inhibidores del estrés oxidativo, y pueden cooperar con enzimas peroxidasas en la captura de especies oxidativas como el peróxido de hidrógeno (Arencibia et al., 2012). Al respecto, Yang et al. (2010) observaron que BP-VC logró inducir otro tipo de respuestas, como la inducción de genes relacionados con la resistencia en plantas de tomate (Solanum lycopersicum L.).
Expresión de genes relacionados con la resistencia en Saccharum spp.
De un total de 10 genes probados relacionados con la resistencia solo tres genes mostraron una expresión diferencial a los 28 días post inoculación (dpi) en los diferentes tratamientos evaluados, estos fueron: sa2-18, sa1-17 y cu-29 (Figura 6).
En la figura 6A se muestra el patrón de expresión del gen sa2-18 a los 28 dpi. En el cultivar resistente este gen es constitutivo (Tratamiento 4), pero en el susceptible no se observa. Al retar ambos cultivares con SCMV (Tratamiento 3) su patrón cambió, C323-68 (resistente al SCMV) silencia el gen, mientras que SP70-1284 (susceptible al SCMV) lo expresa. Se aprecia que ambos productos mantienen la activación del gen en el cultivar resistente. Mientras que en el cultivar susceptible se induce solo con el Tratamiento 1.
La figura 6B muestra el patrón de expresión del gen sa1-17 a los 28 dpi. En el cultivar resistente este gen es constitutivo (Tratamiento 4), pero en el susceptible no se observa, similar a sa2-18. Al inocular ambos cultivares con SCMV (Tratamiento 3) su patrón cambió para el cultivar resistente, en el cual se silencia, mientras que en SP70-1284 (susceptible al SCMV) se mantiene la no expresión. La aplicación de BP-UO y BP-VC promueven la expresión del gen en los cultivares susceptible y resistente respectivamente.
En la figura 6C se muestra el patrón de expresión del gen cu-29 a los 28 dpi. El mismo es constitutivo en los dos cultivares evaluados. Al retar ambos con SCMV (Tratamiento 3) su patrón cambió, los cuales dejan de mostrar la banda esperada para este gen. La aplicación de BP-UO mantiene la activación del gen, mientras que BP-VC conserva el silenciamiento inducido por el virus.

Figura 6. Expresión de los genes sa2-18 (A), sa1-17 (B) y cu-29 (C) en los cultivares de caña de azúcar (Saccharum spp.) C323-68 (resistente al SCMV, carriles 1-4) y SP70-1284 (susceptible al SCMV, carriles 5-8) a los 28 dpi. PM = patrón de peso molecular 100 pb DNA Ladder (Promega); C- = control negativo (mezcla de reacción); BP-UO+SCMV (carriles 1 y 5); BP-VC+SCMV (carriles 2 y 6); Inoculado con SCMV (carriles 3 y 7); Control sano sin inocular (carriles 4 y 8).
El agrupamiento de estas respuestas permitió la diferenciación en tres grupos (Figura 7). El primero comprendió los tratamientos 1 (BP-UO+SCMV), 2 (BP-VC+SCMV) y 4 (control sano, no inoculado) aplicados al cultivar resistente (C323-68) y el tratamiento 1 aplicado al susceptible (SP70-1284). El grupo II estuvo integrado por los tratamientos 2 y 4 aplicados al cultivar susceptible y el tratamiento 3 (inoculado con SCMV) aplicado al cultivar resistente. El grupo III solo incluyó el cultivar SP70-1284 infectado con SCMV.
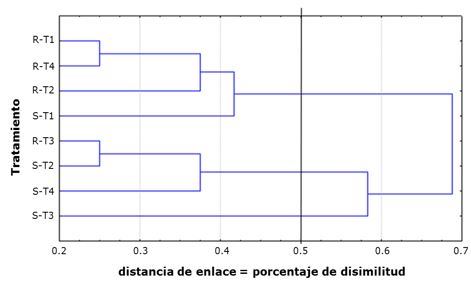
Figura 7. Agrupamiento entre la expresión de genes relacionados con la resistencia de los cultivares de caña de azúcar (Saccharum spp.) C323-68 (resistente al SCMV, “R”) y SP70-1284 (susceptible al SCMV, “S”) en respuesta a la aplicación de los tratamientos de inoculación con bioproductos: T1: BP-UO+SCMV; T2: BP-VC+SCMV; T3: inoculado con SCMV; T4: control sano no inoculado.
Los tres genes expresados diferencialmente (sa2-18, sa1-17, cu-29)codifican para proteínas vinculadas a respuestas defensivas de las plantas. De esta manera, el gen sa2-18 codifica una proteína homóloga a una proteína de dedos de zinc con dominios A20 y AN1, los que están asociados con la respuesta de las plantas al estrés biótico y abiótico (Vij y Tyagi, 2008). También, están involucradas en la señalización de ubiquitina, con evidencia para la actividad ubiquitina ligasa (Vij y Tyagi, 2008; Chang et al., 2018). Además, la inmunidad antiviral mediada por proteínas A20 / AN1 se conserva entre las plantas (Chang et al., 2018).
Por su parte, el gen sa1-17 codifica una proteína homóloga a una subunidad β perteneciente al complejo proteasomal. El proteasoma es un aparato destructor de proteínas involucrado en muchas funciones celulares esenciales, como la regulación del ciclo celular, las vías de transducción de señales, señalización de estrés, entre otras. Este es un componente esencial de la inmunidad desencadenada por patrones moleculares asociados a organismos patógenos y la resistencia sistémica adquirida (Üstün et al., 2016). Los proteasomas vegetales tienen actividad ARNasa que parece ser parte de un mecanismo de defensa contra los potyvirus vegetales como el Virus del mosaico del tabaco y el Virus del mosaico de la lechuga (Kurepa y Smalle, 2008).
De igual forma, el gen cu-29 codifica una proteína homóloga a una proteína de unión a ácido nucleico (RBP). Estas juegan papeles críticos en la regulación génica postranscripcional. Además, algunas RBP funcionan como chaperonas de ARN (Sung y Paek, 2013). Muchas son factores de transcripción, interactúan con secuencias de ADN específicas y regulan la expresión genética (Wang et al., 2018). Además, las RBP de las plantas están involucradas en la inmunidad innata de las plantas contra virus ARN (Sung y Paek, 2013).
Los resultados del agrupamiento indicaron que la aplicación de BP-UO en el cultivar susceptible produjo una activación de genes muy similar a la producida al aplicar ambos bioproductos en el cultivar resistente. Esto pudiera explicar el por qué esta preparación mostró una mayor efectividad para la protección ante la infección viral, lo que sugiere que los oligogalacturónidos producidos por la enzima endoPG contenida en los liposomas desencadenan una vía defensiva que imita a la del cultivar C323-68. Esto se pudo observar también con la acumulación de radicales O2·-, la cual se favoreció con la aplicación de este producto.
Por otra parte, la aplicación de BP-VC provocó en el cultivar susceptible una expresión diferencial de genes similar al control sin inocular (sano) y al resistente inoculado con SCMV. Además, con su aplicación no se observó una respuesta oxidativa apreciable. Estos resultados sugieren que el bioproducto desencadena otras vías defensivas ante la infección ocasionada por el SCMV, distintas a las que sigue el cultivar resistente C323-68, lo que podría atribuirse a los compuestos fenólicos que contiene el BP-VC.Al respecto, Arencibia et al. (2012) encontraron que durante la micropropagación en bioreactores de inmersión temporal del cultivar de caña de azúcar C86-56 sometidos a estrés oxidativo, se expresaron genes relacionados con las vías de la fotosíntesis, el etileno y las auxinas, además demostraron que las vías de los fenilpropanoides elicitan y mantienen mecanismos de respuestas defensivas. Esta hipótesis debe ser corroborada en estudios posteriores.
CONCLUSIONES
La aplicación de los bioproductos BP-UO, basado en la encapsulación de una enzima endopoligalacturonasa (endoPG) en liposomas, y BP-VC, constituido por compuestos fenólicos producidos por caña de azúcar en biorreactores de inmersión temporal, activan mecanismos de defensa en el cultivar de caña de azúcar SP70-1284, susceptible al SCMV, con una reducción de la severidad de la enfermedad y una inducción diferencial de genes de defensa. Este trabajo constituye un paso más en la búsqueda de nuevas estrategias para enfrentar los agentes patógenos que atacan al cultivo de la caña de azúcar. Futuros estudios validarán el uso de estos elicitores en otras especies vegetales de interés.
AGRADECIMIENTOS
Gracias a los revisores anónimos por sus comentarios y sugerencias. Este trabajo fue financiado por la Estación Territorial Oriente-Sur (ETICA Oriente Sur) del Instituto de Investigaciones de la Caña de Azúar (INICA) como parte del proyecto titulado "Actualización de procedimientos metodológicos para la evaluación de la resistencia a plagas en cultivares de caña de azúcar" (PROY- 0097-003-002-044). Los financistas no tuvieron participación en el diseño del estudio, la colecta y análisis de los datos, la decisión de publicar o la preparación del manuscrito.
Conflicto de interés
Los autores expresan que no hay conflictos de intereses en el manuscrito presentado.
Contribución de los autores
Conceptualización JDI, YPI, MLH, Análisis formal JDI y YPI, Investigación JDI y YPI, Metodología YPI, MLH, MZN, AAR, Recursos YPI, MLH y MSD, Supervisión YPI y MSD, Escritura: primera redacción de JDI, Escritura: revisión y edición JDI, YPI, MLH y MSD.
REFERENCIAS
Arencibia A, Bernal A, Yang L, Cortegaza L (2008) New role of phenylpropanoid compounds during sugarcane micropropagation in Temporary Inmersion Bioreactors (TIBs). Plant Science 175: 487-496; doi:10.1016/j.plantsci.2008.05.024
Arencibia A, Bernal A, Zayas C, Carmona E (2012) Hydrogen peroxide induced phenylpropanoids pathway eliciting a defensive response in plants micropropagated in Temporary Immersion Bioreactors (TIBs). Plant Science 195: 71-79; doi:10.1016/j.plantsci.2012.06.016
Ashwin NMR, Barnabas L, Sundar AR, Malathi P (2018) CfPDIP1, a novel secreted protein of Colletotrichum falcatum, elicits defense responses in sugarcane and triggers hypersensitive response in tobacco. Applied Microbiology and Biotechnology 102(14): 6001-6021; doi:10.1007/s00253-018-9009-2
Chalfoun NR, Durman SB, Budeguer F, Caro MdP, Bertani RP, Di Peto P, Stenglein SA, Filippone MP, Moretti ER, Díaz Ricci JC, Welin B, Castagnaro AP (2018) Development of PSP1, a Biostimulant Based on the Elicitor AsES for Disease Management in Monocot and Dicot Crops. Front Plant Sci 9: 844; doi:10.3389/fpls.2018.00844
Chang L, Chang HH, Chang JC, Lu HC, Wang TT, Hsu DW (2018) Plant A20/AN1 protein serves as the important hub to mediate antiviral immunity. PLoS Pathog 14(9): e1007288; doi:10.1371/journal.ppat.1007288
Chiu YS, Chen PY, Wang PC, Chen YJ, Yang YL (2018) A Polysaccharide Derived from a Trichosporon sp. Culture Strongly Primes Plant Resistance to Viruses. Mol Plant Microbe Interact 31(12):1257-1270; doi:10.1094/MPMI-01-18-0012-R
da Silva MF, Gonçalves MC, Pinto LR, Perecin D, Xavier MA, Landell MGA (2015) Evaluation of brazilian sugarcane genotypes for resistance to Sugarcane Mosaic Virus under greenhouse and field conditions. Crop Protection 70: 15-20
Dubrovina AS, Kiselev KV (2019) Exogenous RNAs for Gene Regulation and Plant Resistance. Int J Mol Sci 20: 2282; doi:10.3390/ijms20092282
Enríquez EA, Aispuro E, Vargas I, Martinez MA (2010) Oligosacarinas Derivadas de Pared Celular: Actividad Biológica y Participación en la Respuesta de Defensa de Plantas. Revista Mexicana de Fitopatología 28(2): 144-155
FAO (2019) New standards to curb the global spread of plant pests and diseases. Disponible en: http://www.fao.org/news/story/en/item/1187738/icode/. Consultado 13/01/20
Gan D, Zhang J, Jiang H, Jiang T (2010) Bacterially expressed dsRNA protects maize against SCMV infection. Plant Cell Rep 29: 1261-1268; doi:10.1007/s00299-010-0911-z
Guo J, Gao S, Lin Q, Wang H (2015) Transgenic Sugarcane Resistant to Sorghum mosaic virus Based on Coat Protein Gene Silencing by RNA Interference. BioMed Research International 2015: 861907; doi: 10.1155/2015/861907
Heinze BS, Thokoane LN, Williams CN, Barnes JM, Rutherford RS (2001) The smut-sugarcane interaction as a model system for the integration of marker discovery and gene isolation. Proceedings of the South African Sugar Technologists’ Association 75: 88-93
Hernández A, Pérez JM, Bosch D, Rivero L (1999) Nueva Versión de Clasificación Genética de los Suelos de Cuba. AGRINFOR, La Habana
Hou S, Liu Z, Shen H, Wu D (2019) Damage-Associated Molecular Pattern-Triggered Immunity in Plants. Frontiers in Plant Science 10: 646; doi:10.3389/fpls.2019.00646
Kurepa J, Smalle JA (2008) Structure, function and regulation of plant proteasomes. Biochimie 90: 324-335; doi:10.1016/j.biochi.2007.07.019
La O M, Arencibia A, Carmona ER, Acevedo R (2008) Differential expression analysis by cDNA-AFLP of Saccharum spp. after inoculation with the host pathogen Sporisorium scitamineum. Plant Cell Reports 27: 1103-1111; doi: 10.1007/s00299-008-0524-y
La O M, Mesa JM, Verdecia A, La O D, Montalván J, Carvajal O, Rodríguez J, Alfonso I, Zardón MA, Rivera MJ (2012) Software SC-RESIST Patente. Cuba 372-2012, 2012
La O M, Puchades Y, Zardón MA, Pérez J (2016) Detection of resistance-related genes in sugarcane cultivars inoculated with sugarcane mosaic virus. Proceedings of the International Society of Sugar Cane Technologists 29: 728-731
Mishra AK, Sharma K, Misra RS (2012) Elicitor recognition, signal transduction and induced resistance in plants. Journal of Plant Interactions 7(2): 95-120; doi:10.1080/17429145.2011.597517
Mittler R (2017) ROS are good. Trends Plant Sci 22(1): 11-19; doi: 10.1016/j.tplants.2016.08.002
Nafisi M (2015) Interplays between the cell wall and phytohormones in interaction between plants and necrotrophic pathogens. Phytochemistry 112: 63-71; doi: 10.1016/j.phytochem.2014.11.008
Nicaise V (2014) Crop immunity against viruses: outcomes and future challenges. Frontiers in Plant Sci 5: 1-18; doi:10.33389/fpls.2014.00660
Pavlopoulou A, Karaca E, Balestrazzi A, Georgakilas AG (2019) In Silico Phylogenetic and Structural Analyses of Plant Endogenous Danger Signaling Molecules upon Stress. Oxidative Medicine and Cellular Longevity 19: 8683054; doi:10.1155/2019/8683054
Puchades Y, La O M, Montalván J, Carvajal O, Martínez Y, Zardón MA (2016) Genetic and Symptomatic Characterization of Sugarcane mosaic virus (SCMV) in Cuba. Sugar Tech 18(2): 184-191; doi:10.1007/s12355-015-0375-0
Que Y, Lin J, Song X, Xu L, Chen R (2011) Differential gene expression in sugarcane in response to challenge by fungal pathogen Ustilago scitaminea revealed by cDNA-AFLP. Journal of Biomedicine and Biotechnology 2011(1): 160934; doi: 10.1155/2011/160934
Racedo J, Perera MF, Bertani R, Funes C (2016) Molecular Diagnostic of Both Brown and Orange Sugarcane Rust and Evaluation of Sugarcane Brown Rust Resistance in Tucuman, Argentina, Using Molecular Markers Associated with Bru1 a Broad-Range Resistance Allele. Sugar Tech 18: 414-419; doi: 10.1007/s12355-015-0404-z
Santana I, González M, Guillén S, Crespo R (2014) Instructivo Técnico para el Manejo de la Caña de Azúcar. Instituto de Investigaciones de la Caña de azúcar, La Habana; ISBN: 978-959-300-036-9
Serrat M, De la Fé JA, Puchades Y, La O M (2019) Development of a Bioproduct by Encapsulation of a Yeast Endopolygalacturonase in Liposomes. Agrica 8(2): 86-92; doi:10.5958/2394-448X.2019.00010.5
Sung UH, Paek KH (2013) Plant RNA binding proteins for control of RNA virus infection. Frontiers in Physiology 4: 397; doi:10.3389/fphys.2013.00397
Thokoane LN, Rutherford RS (2001) cDNA-AFLP differential display of sugarcane (Saccharum spp., hybrids) genes induced by challenge with the fungal pathogen Ustilago scitaminea (sugarcane smut). Proceedings of the South African Sugar Technologists’ Association 75: 104-107
Townsend GR, Heuberger JW (1943) Methods for estimating losses caused by diseases in fungicide experiments. The Plant Disease Reporter 27: 340-343
Üstün S, Sheikh A, Gimenez-Ibanez S, Jones A (2016) The Proteasome Acts as a Hub for Plant Immunity and Is Targeted by Pseudomonas Type III Effectors. Plant Physiol 172: 1941-1958
Vij S, Tyagi AK (2008) A20/AN1 zinc-finger domain-containing proteins in plants and animals represent common elements in stress response. Funct Integr Genomics 8: 301-307; doi:10.1007/s10142-008-0078-7
Wang L, Liu F, Zhang X, Wang W (2018) Expression Characteristics and Functional Analysis of the ScWRKY3 Gene from Sugarcane. Int J Mol Sci 19: 4059; doi: 10.3390/ijms19124059
Wohlgemuth H, Mittelstrass K, Kschieschan S, Bender J (2002) Activation of an oxidative burst is a general feature of sensitive plants exposed to the air pollutant ozone. Plant, Cell and Environment 25: 717-726
Yang L, Zambrano Y, Hu CJ, Carmona ER, Bernal A, Pérez A, Li YR, Guerra A, Santana I, Arencibia AD (2010) Sugarcane metabolites produced in CO2-rich Temporary Immersion Bioreactors (TIBs) induce tomato (Solanum lycopersicum) resistance against bacterial wilt (Ralstonia solanacearum). In Vitro Cellular and Developmental Biology Plant 46: 558-568; doi:10.1007/s11627-010-9312-9
Yao W, Ruan M, Qin L, Yang C, Chen R, Chen B, Zhang M (2017) Field Performance of Transgenic Sugarcane Lines Resistant to Sugarcane Mosaic Virus. Front Plant Sci 8: 104; doi:10.3389/fpls.2017.00104
Zvereva AS, Pooggin MM (2012) Silencing and innate immunity in plant defense against viral and non-viral pathogens. Viruses 4: 2578-2597
Recibido: 07-05-2020
Aceptado: 08-06-2020
Copyright (c) 2021 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
