Artículo original
Biotecnología Vegetal Vol. 20, No. 3: 225 - 235, julio - septiembre, 2020
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Primer retoño a partir de esquejes o vitroplantas libres de Xanthomonas albilineans puede utilizarse como semilla en la producción de caña de azúcar
First ratoon from cuttings or vitroplants free of Xanthomonas albilineans can be used as seed in sugarcane production
Héctor Jorge Suárez1https://orcid.org/0000-0002-8170-555X
Alberto González Marrero1https://orcid.org/0000-0002-5684-8110
Yosel Pérez Pérez1https://orcid.org/0000-0003-1705-9925
Oscar Suárez Benitez1https://orcid.org/0000-0001-6192-3288
Mario García Guzmán1https://orcid.org/0000-0002-1377-0704
Ismaray Morales Romero1https://orcid.org/0000-0002-0365-5892
José Angel Dranguet Isbert1https://orcid.org/0000-0001-6828-9603
1Instituto de Investigaciones de la Caña de Azúcar. Carretera CUJAE, km 1. Boyeros. La Habana. Cuba. CP 19390
*Autor para correspondencia e-mail: hector.jorge@inica.azcuba.cu
RESUMEN
Uno de los factores que limita la producción de caña de azúcar (Saccharum spp.) es el empleo de semilla de baja calidad. El trabajo tuvo como objetivo demostrar la factibilidad del uso del primer retoño procedente de plantas propagadas Xanthomonas albilineans, agente causal de la escaldadura foliar. Se emplearon dos cultivares (C1051-73 y C90-469) y tres tipos de material vegetal de plantación (esquejes de una yema, esquejes de tres yemas y vitroplantas). Las evaluaciones se realizaron a los 10 meses de cultivo en la cepa de caña planta y primer retoño. Las variables analizadas fueron diagnóstico serológico por UMELISA y tinción de los vasos del xilema para la presencia de X. albilineans, rendimiento agrícola y sus componentes. Además, fueron comparados los resultados de ambas cepas en las variables t caña ha-1, diagnóstico por UMELISA y por tinción de los vasos del xilema. Los resultados reflejaron que los cultivares y tratamientos no mostraron diferencias significativas en cuanto a los métodos de diagnóstico utilizados en las cepas evaluadas. El rendimiento agrícola (t caña ha-1) fue superior para el tratamiento con esquejes de tres yemas en caña planta y en retoño lo fue para las plantas reproducidas in vitro. El número de tallos en las dos cepas, se incrementó en la propagación con vitroplantas. En la comparación entre la cosecha de caña planta y primer retoño solo hubo diferencias significativas en el rendimiento agrícola y el porcentaje de vasos funcionales del xilema, las que estuvieron a favor del retoño. Se demostró la factibilidad del uso del primer retoño a partir de vitroplantas y esquejes, como semilla con calidad fitosanitaria con respecto a la presencia de X. albilineans.
Palabras clave: tratamiento hidrotérmico, diagnóstico, Saccharum, tinción, vasos del xilema
ABSTRACT
One of the factors that limits the production of sugarcane (Saccharum spp.) is the use of poor quality seed. The objective of the work was to demonstrate the feasibility of using the first ratoon from in vitro propagated plants or cuttings as seed with phytosanitary quality with respect to the presence of Xanthomonas albilineans, the causal agent of foliar scald. Two cultivars (C1051-73 and C90-469) and three types of planting plant material were used (one-bud cuttings, three-bud cuttings and vitroplants). The evaluations were carried out at 10 months of culture in the cane plant strain and first ratoon. The variables analyzed were serological diagnosis by UMELISA and staining of the xylem vessels for the presence of X. albilineans, agricultural yield and its components. In addition, the results of both strains were compared in the variables t cane ha-1, diagnosis by UMELISA and by staining of the xylem vessels. The results reflected that the cultivars and treatments did not show significant differences regarding the diagnostic methods used in the strains evaluated. The agricultural yield (t cane ha-1) was superior for the treatment with cuttings of three buds in cane plant and in ratoon it was for plants reproduced in vitro. The number of stems in the two strains increased in the propagation with vitroplants. In the comparison between the cane plant and first ratoon, there were only significant differences in agricultural yield and the percentage of functional vessels of the xylem, which were in favor of the ratoon. It was demonstrated the feasibility of using the first ratoon from vitroplants and cuttings, as seed with phytosanitary quality with respect to the presence of X. albilineans.
Keywords: diagnostic, hydrothermic treatment, Saccharum, xylem vessels staining
INTRODUCCIÓN
La multiplicación agámica de la caña de azúcar (Saccharum spp.) favorece la diseminación de enfermedades ocasionadas por organismos patógenos entre las que se destacan: el mosaico (Virus del mosaico de la caña de azúcar), la escaldadura foliar (Xanthomonas albilineans (Ashby) Dowson), el carbón (Ustilago scitaminea Sydow) y el raquitismo de los retoños (Leifsonia xyli subsp. xyli) (Glyn, 2005).
Uno de los factores que limita la producción de caña de azúcar es el empleo de semilla de baja calidad fitosanitaria, ya que en ocasiones se utilizan simientes de las áreas comerciales no procedente del encadenamiento del sistema de semilla (Básica, Registrada y Certificada), las que pueden presentar afectaciones por enfermedades.
Los métodos clásicos para la producción de semilla de caña de azúcar saneada, emplean los tratamientos con calor (agua o aire caliente) y la aplicación de productos químicos para la eliminación de los organismos patógenosque afectan el cultivo (Hoy y Flynn, 2001; Glyn, 2005). Además, las técnicas de cultivo de tejidos han permitido obtener semilla con elevada pureza genética, sanidad y vigor; razón por la cual, su uso se ha difundido en muchos países cañeros (Pérez-Ponce, 1998; Hoy y Flynn, 2001; Glyn, 2005; Guevara y Ovalle, 2005).
Diferentes autores concuerdan en que la semilla proveniente de micropropagación presenta en general mayor número de tallos, altura y peso de los tallos y mayor rendimiento cultural y de azúcar/parcela, que la semilla obtenida en forma convencional por estacas, con o sin termo tratamiento (Anderlini y Kotska, 1986; Jiménez et al., 1991; Santana et al., 1992; Pérez-Ponce, 1998; Comstock y Miller, 2004; Flynn et al., 2005). Sin embargo, existen pocas evidencias demostradas, hasta el presente, del estado fitosanitario de la semilla procedente por la vía biotecnológica comparada con la semilla procedente de la reproducción por vía agámica, usada esta última en forma de esquejes con diferentes longitudes (desde una yema hasta tres), con remojado previo, tratamiento hidrotérmico y tratamiento químico.
En adición, Jorge et al. (2016), señalaron que el uso de la soca o primer retoño como semilla categorizada ha sido un tema muy controversial en Cuba, pues como prevención se ha recomendado no usarla en la cadena de semilla, principalmente en los semilleros básicos y registrados. No obstante, el alto costo de la producción de semilla, aspecto señalado de forma reiterativa por los productores y la utilización de esta cepa en países como Colombia (Victoria y Calderón, 1995), Argentina (Villar, 2002; Digonzelli et al., 2009), Costa Rica (Chávez y Chavarría, 2011), evidencia la necesidad de hacer una revisión del tema con vistas a perfeccionar el Sistema Cubano de Semilla.
Atendiendo a lo anterior, el trabajo tuvo como objetivo demostrar la factibilidad del uso del primer retoño procedente de plantas propagadas in vitro o esquejes como semilla con calidad fitosanitaria con respecto a la presencia de Xanthomonas albilineans, agente causal de la escaldadura foliar.
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon esquejes de plantas cultivadas en campo y plantas propagadas in vitro por organogénesis (Jiménez et al., 1997) de los cultivares C1051-73 y C90-469.
Sitio y escenarios de los experimentos de campo
El trabajo se desarrolló en el Banco de Semilla Básica (BSB) de la provincia de Cienfuegos, ubicado en la localidad de Espartaco sobre suelos Pardos vérticos sin carbonato (Hernández et al., 2015), donde fue plantado un experimento en noviembre de 2017 y cosechado en septiembre de 2018 y julio de 2019, como caña planta y soca con 10 meses de cultivo, respectivamente.
Se estudiaron dos cultivares comerciales de caña de azúcar (C1051-73 y C90-469) y tres tratamientos relacionados con el material vegetal de plantación: 1. Esquejes de una yema, 2. Esquejes de tres yemas (ambos tratados térmicamente a 51°C, durante una hora, según Jorge et al., 2011), procedentes de la cadena de producción de semillas certificadas de caña de azúcarde la provincia de Cienfuegos y 3 plantas obtenidas in vitro (vitroplantas), procedentes de la biofábrica de la provincia de Villa Clara, del INICA (AZCUBA).
El área de las parcelas del experimento fue de 48 m2 (4 surcos de 7.5 m de largo a una distancia entre surcos de 1.60 m), de acuerdo con las Normas Metodológicas del Programa de MejoramientoGenético de la Caña de Azúcar en Cuba (Jorge et al., 2011). La cantidad de yemas por metro empleada en los esquejes de una y tres yemas fue 12 y las vitroplantas se plantaron a 0.50 metros entre plantas (para un total de 15 vitroplantas por surco y 60 por parcela).
Diseño experimental, repeticiones, variables evaluadas y análisis estadístico
Se empleó el diseño experimental de bloque al azar con tres repeticiones y se realizaron análisis de varianzas bifactoriales combinados con la comparación de medias mediante prueba Múltiple de Rangos, usando la dócima de Tukey (P<0.01 y P<0.05) y de t-student al 1 y 5% de significación entre las cepas de caña planta y primer retoño (soca), para todas las variables estudiadas.
En este análisis comparativo se utilizaron los valores de los dos cultivares estudiados, con los tres métodos de plantación y las tres repeticiones para un total de 18 muestras (n=18).
Las variables estudiadas en ambas cepas fueron: diagnóstico por UMELISA para la presencia de X. albilineans, tinción de los vasos del xilema (diagnóstico de oficio, TVX), rendimiento agrícola (t caña ha-1 o TCH) y sus componentes: longitud del tallo (cm), diámetro del tallo (cm) y número de tallos por metro.
Para el diagnóstico por UMELISA de X. albilineans se seleccionaron de forma aleatoria en cada parcela 25 hojas +3 (según la nomenclatura de Kwiiper, descrita por Dillewijn, 1975). Se empleó el kit AGDIA propuesto para micro ELISA y transferido a la tecnología ultra microanalítica (UMELISA) (Pérez, 2019).
La tinción de los vasos del xilema con safranina se realizó por parcela, donde se tomaron tres muestras y cada una estuvo integrada por tres tallos; también seleccionados al azar. Se empleó la metodología descrita por Chagas y Tokeshi (1994).
Para estimar el diámetro y la altura en cada parcela fueron elegidos al azar 20 tallos, mientras que la población se valoró con el conteo total de los tallos de los dos surcos centrales de cada parcela del experimento dividido entre el largo de surco (7.50 m).
Los datos originales de las variables estudiadas fueron evaluados respecto a su normalidad mediante la prueba de Chí cuadrado.La variable porcentaje de los vasos funcionales y los resultados del análisis por UMELISA (porcentaje de muestras con presencia de la bacteria X. albilineans) no cumplieron con esa exigencia, por lo que fue necesario utilizar en la primera la transformación de raíz cuadrada del arco seno de (x) dividido entre 100; mientras que en la segunda se empleó el coseno del valor de esta variable. El rendimiento agrícola fue estimado acorde con lo descrito por Martins y Landell (1995).
RESULTADOS Y DISCUSIÓN
Los resultados mostraron que no hubo diferencias significativas entre los factores independientes cultivares y tratamientos, así como tampoco en su interacción (Tabla 1).
Tabla 1. Anális de varianzas del diagnóstico de Xanthomonas albilineans mediante dos métodos en caña planta de dos cultivares de caña de azúcar.
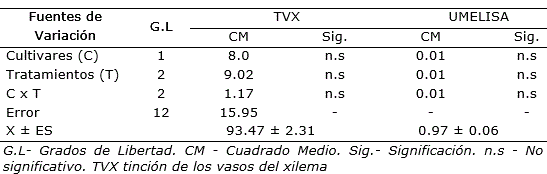
De 18 observaciones (Tabla 2), solo una fue positiva (presencia de la bacteria en las hojas), correspondiente al cultivar C90-469, propagado por cultivo de tejidos, que es un cultivar resistente a la escaldadura foliar (INICA, 2019). No obstante, el diagnóstico mediante la tinción de los vasos del xilema mostró más del 95% de funcionalidad (el mínimo permisible es de 85%), lo que ratifica la calidad de la simiente para su uso como material de plantación. El diagnóstico por UMELISA permite determinar la presencia o ausencia de la bacteria (Pérez, 2019), pero no define la aptitud de la semilla, por lo que es importante la combinación de los dos métodos de diagnóstico para la toma de decisiones.
Tabla 2. Resultados del diagnóstico de Xanthomonas albilineans por UMELISA y Tinción de los vasos funcionales del xilema en caña planta de dos cultivares.

La interacción cultivar x tratamiento solo fue significativa para el número de tallos m-1 y para la longitud. Los cultivares solo se diferenciaron en la longitud del tallo, mientras que en las variables diámetro y rendimiento agrícola (t caña ha-1), la disimilitud encontrada, fue entre los tratamientos (Tabla 3).
Tabla 3. Análisis de varianza para el rendimiento y sus componentes en caña planta de dos cultivares.

El mayor número de tallos se alcanzó para las vitroplantas en ambos cultivares (Figura 1). Este es un aspecto importante, que coincide con lo informado por Digonzelli et al. (2009), en estudios de semilla de caña de azúcar desarrollados en Argentina. Estos autores refirieron incrementos positivos en el número de tallos, cuando utilizaron vitroplantas como material de plantación, en comparación con la reproducción por esquejes.
En la longitud del tallo, los mejores resultados, fueron para el cultivar C90-469 con los tratamientos de plantación por esquejes.El diámetro fue mayor cuando se plantó con esquejes y en t caña ha-1 , el tratamiento de esquejes de tres yemas superó al de una yema, sin embargo no hubo diferencias entre ambos métodos de reproducción con esquejes respecto a las vitroplantas (Figura 2).

Figura 1. Número de tallos por metro y longitud del tallo en caña planta en dos cultivares de caña de azúcar con diferentes materiales de plantación. Esq 1: Esquejes de 1 yema, Esq 3: Esquejes de 3 yemas, Vit. Vitroplanta, ES error estándar.

Figura 2. Diámetro del tallo y t caña ha-1 en caña planta en el cultivar C90-469 de caña de azúcar con diferentes materiales de plantación. Esq 1: Esquejes de 1 yema, Esq 3: Esquejes de 3 yemas, Vit. Vitroplanta, ES error estándar.
Al respecto, Jorge et al. (2018), informaron una relación directa entre la longitud de los esquejes y la población, aspecto este, donde puede estar la causa que influyera en la menor producción cañera obtenida con el tratamiento de una yema (Esq.1) en el contexto de este estudio.
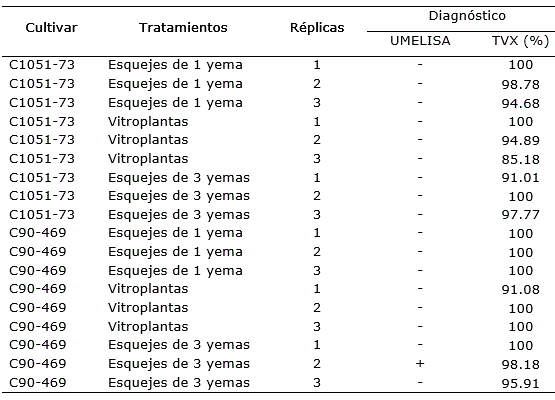
Para el primer retoño o soca no hubo diferencias significativas entre los factores independientes y la interacción para las dos variables analizadas (Tabla 4), aspecto que coincidió con los resultados de caña planta. De 18 observaciones (Tabla 5), solo una fue positiva, aportada por el cultivar C90-469 en el tratamiento de esquejes de tres yemas (réplica 2). Sin embargo, el diagnóstico por tinción de los vasos del xilema evidenció más de 98% de aptitud de los vasos del xilema, lo que reafirmó lo expresado anteriormente en la cepa de caña planta.
Tabla 4. Anális de varianza del diagnóstico de Xanthomonas albilineans por Tinción de los vasos funcionales del xilema y por UMELISA en primer retoño o soca en caña de azúcar.
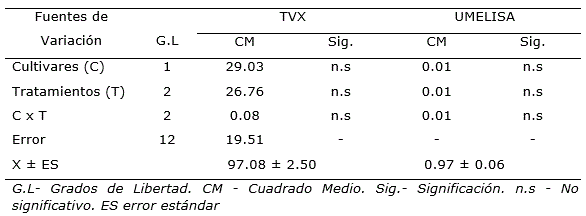
Tabla 5. Resultados del diagnóstico de Xanthomonas albilineans por UMELISA y Tinción de los vasos funcionales del xilema, en primer retoño o soca en caña de azúcar.
En el análisis de varianza de la cepa deprimer retoño (Tabla 6), solo hubo diferencias significativas entre los factores independientes. De ellos, los cultivares presentaron en las variables longitud del tallo y número de tallos y en los tratamientos en el diámetro, número de tallos y la producción de caña (t ha-1).
Tabla 6. Análisis de varianzas para el rendimiento y sus componentes en primer retoño o soca en dos cultivares de caña de azúcar.
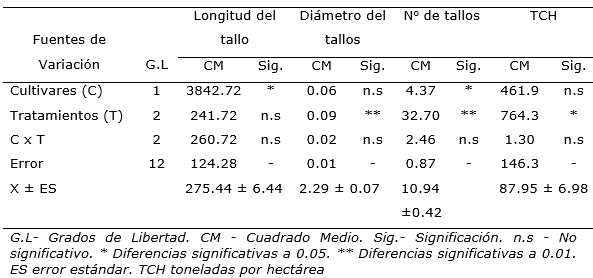
El cultivar C90-469 alcanzó una longitud del tallo superior al cultivar C1051-73 en la cepa de primer retoño, sin embargo, el número de tallos fue inferior (Figura 3). El conocimiento de estos resultados por cultivar en primer retoño es importante ya que permite trazar estrategias para su posible uso como semilla. La producción de simiente es un proceso costoso. Autores como Mariotti (1977) y Jorge et al. (1989) han destacado que tanto la longitud del tallo como el número de tallos son las variables que mayor influencia tienen en el rendimiento agrícola (t caña ha-1 )
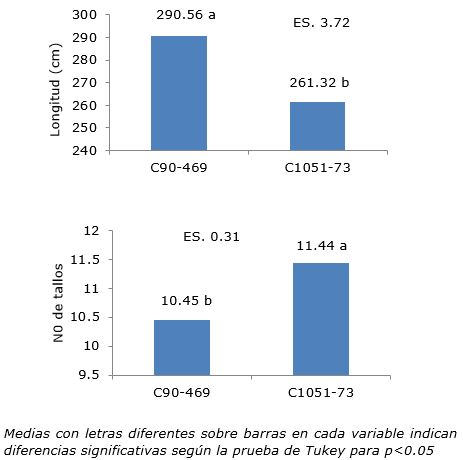
Figura 3. Longitud del tallo y número de tallos por metro en primer retoño o soca en dos cultivares de caña de azúcar.
Una comparación de los resultados entre los tratamientos evidenció diferencias entre ellos en cuanto a las variables evaluadas (Figura 4). Para el diámetro del tallo, el esqueje de tres yemas fue superior a las vitroplantas, mientras que el de una yema fue intermedio.
Sin embargo, el número de tallos de las plantas procedentes de vitroplantas fue superior a las de los esquejes y en t caña ha-1, también superaron significativamente a las reproducidas por esquejes de una yema.
Los resultados coincidieron con los informados por Digonzelli et al. (2009), quienes informaron que la semilla proveniente de micropropagación presentó una tendencia a un mayor número de tallos. Ello derivó en una mayor producción de caña, en las condiciones de Tucumán (Argentina), cuando trabajaron en la cepa de primer retoño (soca).
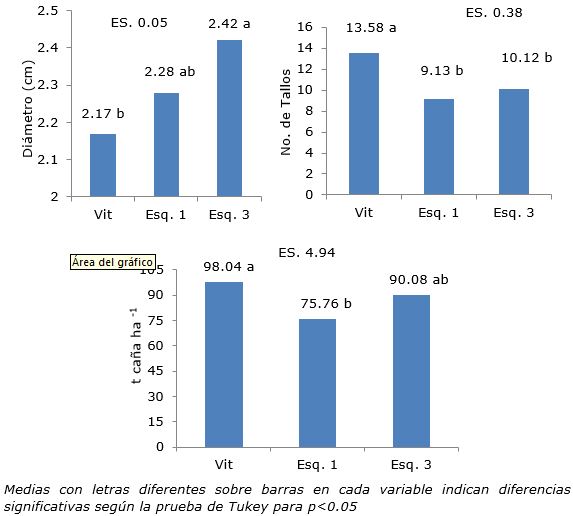
Figura 4. Diámetro del tallo, número de tallos por metro y rendimiento agrícola en primer retoño o soca de tres materiales de plantación en dos cultivares de caña de azúcar.
En la comparación delas cepas (Tabla 7), se observó que el primer retoño superó en t caña ha-1 y porcentaje de vasos funcionales del xilema del diagnóstico de oficio, a la caña planta y en el diagnóstico por UMELISA, se lograron resultados comparables. Delgado et al. (2016), plantearon como criterio práctico que la cepa de retoño antecede a la de caña planta en dos meses, aspecto que pudo influenciar el incremento de la producción de caña en este estudio.
El diagnóstico por UMELISA y la tinción de los vasos del xilema (diagnóstico de oficio), confirmaron la calidad de la simiente en las dos cepas estudiadas. Estos resultados corroboraron los referidos por Jorge et al. (2016), quienes realizaron estudios en semilleros comerciales del Ingenio Ofelina (República de Panamá), en 13 campos plantados con diez cultivares en cepas de caña planta, socas y segundo retoño; a las que se le realizó diagnóstico molecular por PCR para determinar la presencia de las enfermedades raquitismo de los retoños y escaldadura foliar; así como la tinción de los vasos vasculares del xilema para comprobar la calidad de la semilla disponible para las plantaciones comerciales. Estos autores, obtuvieron como resultado que el diagnóstico molecular presentó entre 49 y 6% de las muestras tomadas con la presencia de las bacterias Leifsonia xyli subsp. xyli y X. albilineans, respectivamente; mientras que el 92.7% del área evaluada mostró un valor superior al 85% de funcionalidad de los vasos del xilema.
De estos trabajos, se concluyó que la utilización de la soca como semilla, es una práctica común en diferentes países que cultivan la caña de azúcar, su uso está en dependencia de la efectividad de los tratamientos que se le dé a la simiente, a través del esquema de producción de semilla y de la resistencia del cultivar a emplear. Se recomendó además, ratificar la factibilidad de la tinción de los vasos vasculares, como método alternativo para evaluar la efectividad del tratamiento térmico, lo que se corroboró en este estudio.
Tabla 7. Resultados de la Prueba de t-student para las variables analizadas en la comparación de caña planta y retoño o soca en cuanto a la presencia de Xanthomonas albilineans en dos cultivares de caña de azúcar.

Los resultados alcanzados en los tres sistemas de reproducción agámica confirmaron la efectividad fitosanitaria, en cuanto a la presencia de Xanthomonas albilineans, de la producción de semilla por cultivo in vitro y por esquejes (de una y tres yemas), además de la factibilidad del uso de la soca como semilla, que permite disponer de material de reproducción de alta calidad.
El procedimiento metodológico desarrollado puede ser aplicado tanto en institutos de investigación de caña de azúcar, como en los ingenios azucareros que desarrollan el proceso de producción de semilla por ambos métodos.
CONCLUSIONES
La respuesta de dos cultivares evaluados en las cepas de caña planta y primer retoño o soca, confirma que los métodos de reproducción agámica por esquejes de una yema, esquejes de tres yemas y vitroplantas son efectivos y seguros desde el punto de vista fitosanitario para evitar la presencia de Xanthomonas albilineans.
El uso de la soca o primer retoño como semilla es posible siempre y cuando se trabaje con rigor en su producción ya que presenta resultados productivos superiores a la caña planta, garantía y calidad fitosanitaria demostrada con diagnóstico por UMELISA negativo en más del 94% de las muestras y un porcentaje de aptitud de los vasos del xilema superior al 91% para la presencia de Xanthomonas albilineans.
AGRADECIMIENTOS
Este trabajo fue financiado por un Proyecto Ramal de Investigaciones del Grupo Azucarero AZCUBA. Los financistas no tuvieron participación en el diseño del estudio, la colecta y análisis de los datos, la decisión de publicar o la preparación del manuscrito es de la institución y el colectivo de autores del proyecto.
Conflicto de interés
Los autores no declaran conflicto de intereses.
Contribución de los autores
Conceptualización HJS, Análisis formal AGM, Investigación HJS, YPP, OSB, MGG, IMR, JADI, Metodología YPP, Escritura: primera redacción HJS, Escritura: revisión y edición HJS, AGM.
REFERENCIAS
Anderlini TA, Kotska SJ (1986) Initial yield responses of Kleentek tissue culture produced seed cane in Louisiana. Proc ISSCT Congress 19: 391-401
Chagas RR, Tokeshi H (1994) Comparison between methods for diagnosis of RSD — I. Water flow, flow and staining, staining by transpiration. En: Rao GP, Gillaspie AG, Upadhyaya PP, Filho AB, Chen CT, Agnihotri VP (Eds). Current trends in sugarcane pathology, pp. 163-171. International Books and Periodicals Supply Service, Delhi
Chávez M, Chavarría E (2011) Programa Nacional para la Producción de Semilla Mejorada de Caña de Azúcar en Costa Rica. Liga Agrícola e Industrial de la Caña de Azúcar de Costa Rica, San José
Comstock JC, Miller JD (2004) Yield comparisons: disease-free tissue-culture versus bud-propagated sugarcane plants and healthy versus yellow leaf infected plants. J Am Soc of Sugar Cane Technology 24: 31-40
Delgado I, Jorge H, Vera A, Cornide MT, Díaz F, Gómez JR, Suárez O, Puchades Y (2016) Influencia de la edad y cultivar de caña de azúcar en el momento de la cosecha. Centro Agrícola 43(2): 59-65
Digonzelli PA, Romero ER, Scandaliaris J,Giardina J (2009) Comparación de la calidad de semilla de caña de azúcar en el segundo corte según el método de saneamiento. Rev Ind y Agríc de Tucumán Tomo 86(1): 1-8
Dillewijn V (1975) Botánica de la Caña de Azúcar. Instituto del Libro, La Habana
Flynn J, Powell G, Perdomo R, Montes G, Quebedeaux K, Comstock J (2005) Comparison of sugarcane disease incidence and yield of fieldrun, heat-treated, and tissue-culture based seedcane. J Am Soc Sugar Cane Technol 25: 88-100
Glyn L (2005) Pests and diseases of sugarcane. Sugar Cane Int 23(1): 3-14
>Guevara L, Ovalle W (2005) Effect of treatments to eliminate systemic pathogens from Sugarcane setts. Proc ISSCT Congress 25: 623-628
Hoy J, Flynn J (2001) Control of ratoon stunting disease of sugarcane in Louisiana with seedcane produced through micro propagation and resistant cultivars. Proc ISSCT Congress 24: 417-421
Hernández A, Pérez JM, Bosch D, Castro N (2015) Clasificación de los suelos de Cuba. Instituto de Suelos, La Habana
INICA (2019) Informe de la XXVI Reunión Nacional de Variedades, Semilla y Sanidad Vegetal. INICA, La Habana
Jiménez E, García L, Suárez M, Alvarado Y (1997) Instructivo técnico para la micropropagación de la caña de azúcar. Instituto de Biotecnología de las Plantas, Santa Clara
Jiménez E, Pérez-Ponce J, Martín D, García I (1991) Estudio de poblaciones de caña de azúcar (Saccharum spp.) obtenidas por micro propagación in vitro. Cent Agríc 18(2): 74-78
Jorge H, Delgado I, Vera A, Guillén S, Gómez JR, Suárez O (2016) Uso de la soca como semilla categorizada de caña de azúcar.Centro Agrícola 43(2): 66-75
Jorge H, García H, Jiménez N, Rodríguez E (1989) Asociación y repetibilidad en clones de caña de azúcar. Revista ATAC 6: 2-6
Jorge H, González A, Menéndez A, Vera A (2018) Influencia de la longitud de los esquejes y la cantidad de yemas por metro en la brotación y población del cultivo de la caña de azúcar. Revista ATAC 3: 9-12
Jorge H, Jorge I, Mesa JM, Bernal N (2011) Normas y Procedimientos del Programa de Mejoramiento Genético de la Caña de Azúcar en Cuba. PUBLINICA, La Habana
Mariotti JA (1977) Sugarcane clonal selection research in Argentina. A review of experimental results. Proc ISSCT 14: 89-95
Martins ALM, Landell GAI (1995) Conceitos e critérios para avaliação experimental em cana de açúcar utilizados no programa Cana IAC Instituto Agronômico, Pindorama
Pérez Y (2019) Contribución al Sistema Evaluativo de la Resistencia de Cultivares de Caña de Azúcar frente a la Escaldadura Foliar Xanthomonas albilineans Ashby Dowson en Cuba. Tesis en Opción al grado de Doctor en Ciencias Agrícolas, Universidad de Matanzas, Matanzas, Cuba
Pérez-Ponce JN (1998) Propagación y mejora genética de plantas por biotecnología. Instituto de Biotecnología de las Plantas, Santa Clara
Santana I, Nodarse O, Fernández Z (1992) Estudio comparativo de la propagación in vitro y por estacas en cuatro variedadesde caña de azúcar. Revista Científica Caña deAzúcar 10(2): 51-59
Victoria JL, Calderón H (1995) Establecimiento de Semilleros y Multiplicación de Variedades. En: Cassalett CD, Torres JS, Isaacs CH (Eds). El Cultivo de la Caña en la Zona Azucarera de Colombia, pp.115-129. Centro de Investigación de la Caña de Azúcar de Colombia, Cali
Villar L (2002) Caña de Azúcar Compilación 62. Ministerio de Agricultura y Ganadería, Buenos Aires
Recibido: 15-06-2020
Aceptado: 24-07-2020
Copyright (c) 2021 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
