Artículo original
Biotecnología Vegetal Vol. 21, No. 1: 00 - 00, enero - marzo, 2021
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Establecimiento de un banco de plantas madre de caña de azúcar en condiciones semicontroladas para la propagación in vitro
Establishment of sugarcane mother plant bank in semicontroled conditions for in vitro propagation
Aydiloide Bernal Villegas1https://orcid.org/0000-00017976-1993
Pablo Machado Armas1
Dunia Núñez Jaramillo1
Edel Alejandro Toledo Rodríguez122-7330" target="_blank">https://orcid.org/0000-0002-0522-7330
Rafael Gómez Kosky1https://orcid.org/0000-0003-3656-9824
Aldo Sergio Noguera2https://orcid.org/0000-0003-2768-5671
Atilio Pedro Castagnaro2https://orcid.org/0000-0002-1599-2255
1Estación Territorial de Investigaciones de la Caña de Azúcar (ETICA) Centro-Villa Clara. Autopista nacional km 246. Ranchuelo. Villa Clara. Cuba. CP 53100.
2Instituto de Tecnología Agroindustrial del Noroeste Argentino (ITANOA), Estación Experimental Agroindustrial Obispo Colombres (EEAOC) – Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). Tucumán. Argentina.
*Autora para correspondencia e-mail: aydiloide.bernal@inicavc.azcuba.cu
RESUMEN
La propagación de caña de caña de azúcar (Saccharum spp.) requiere de semilla con calidad fisiológica y fitosanitaria. El trabajo se realizó con el objetivo de establecer un banco de plantas madre de caña de azúcar en condiciones semicontroladas para garantizar la eficacia de la propagación in vitro con plantas libres de Xanthomonas albilineans. Se modificó una casa de cultivo y se remodeló la instalación, se colocó malla de sombra Sarán (50%) y un sistema de riego por aspersores. El cultivo de las plantas se realizó en recipientes de plástico (volumen de 20 m3) con una mezcla de compost de cachaza y zeolita 3:1. Tallos sin síntomas de escaldadura foliar y con seis meses de cultivo de los cultivares C98-357, C97-445, y C86-156 se cortaron en segmentos con una yema. Se aplicó tratamiento hidrotérmico y posteriormente el bioestimulante VIUSID Agro® (0.8 ml l-1) antes de la plantación de las yemas. A los tres meses de cultivo se realizó un diagnóstico serológico para detectar la presencia de X. albilineans. Las plantas negativas se trataron con productos bioestimulantes y se evaluó la respuesta del establecimiento in vitro. En las condiciones descritas se logró el crecimiento adecuado de las plantas. El establecimiento de un banco de plantas madre de caña de azúcar en condiciones semicontroladas y su manejo garantizaron que disminuyera la contaminación microbiana y la oxidación fenólica en la fase de establecimiento in vitro. La efectividad del tratamiento hidrotérmico combinado con las condiciones semicontroladas y el manejo de las plantas permiten disminuir la incidencia de X. albilineans.
Palabras clave: cultivo in vitro, escaldadura foliar, Xanthomonas albilineans
ABSTRACT
The propagation of sugarcane (Saccharum spp.) Requires seed with physiological and phytosanitary quality. The work was carried out with the objective of establishing a bank of sugarcane mother plants under semi-controlled conditions to guarantee the efficiency of in vitro propagation with plants free of Xanthomonas albilineans. A greenhouse was modified and the structure was remodeled, a Sarán shade mesh (50%) and a sprinkler irrigation system were placed. The plants were grown in plastic containers (20 m3 volume) with a mixture of cachaça compost and zeolite 3:1. Stems of cultivars C98-357, C97-445 and C86-156, without symptoms of leaf scald and with six months of culture, were cut into segments with a bud. Hydrothermal treatment was applied and subsequently the biostimulant VIUSID Agro® (0.8 ml l-1) before the buds planting. At three months of culture, a serological diagnosis was made to detect the presence of X. albilineans. The negative plants were treated with biostimulants and the response of the in vitro establishment was evaluated. Adequate plant growth was achieved under the conditions described. The establishment of a bank of sugarcane mother plants under semi-controlled conditions and its management guaranteed that microbial contamination and phenolic oxidation decreased in the in vitro establishment phase. The effectiveness of the hydrothermal treatment combined with the semi-controlled conditions and the management of the plants make it possible to reduce the incidence of X. albilineans.
Keywords: in vitro culture, foliar scald, Xanthomonas albilineans
INTRODUCCIÓN
El factor primario en la obtención de elevados y sostenidos rendimientos en la agricultura cañera es el empleo de semilla de alta calidad. En ausencia de cultivares de caña de azúcar (Saccharum spp.) resistentes, el método más efectivo y eficiente de reducir la incidencia de enfermedades es utilizar material vegetal inicial sano. De ahí la importancia de contar con métodos rápidos y seguros de propagación que permitan multiplicar en períodos cortos plantas libres de enfermedades en cultivares en explotación y/o introducción a través de la propagación por vía biotecnológica (Kavita y Saxena, 2016).
La combinación de métodos de propagación convencional con la micropropagación constituye una de las estrategias que se emplean en Cuba para obtener la semilla de caña de azúcar necesaria para dar respuesta a la demanda de los productores. Perfeccionar el proceso productivo y su escalado es primordial, para lo cual se hace necesario la integración de las diferentes fases de la propagación in vitro (Santana et al., 2011).
En los últimos años, una de las limitantes del proceso de propagación in vitro de este cultivo fue la presencia en plantas madre (donantes) de Xanthomonas albilineans (Ashby) Dawson, agente causal de la enfermedad escaldadura foliar, constatada mediante diagnóstico serológico (INICA, 2019). Además, durante la fase de establecimiento in vitro con material vegetal procedente de campo, las pérdidas por contaminación microbiana estaban entre 20.0 y 40.0% (Bermúdez, 2020, comunicación personal) y se apreciaba elevada presencia de fenoles (oxidación) que provocaba la muerte de los explantes. Esto hace que el proceso sea ineficiente e ineficaz biológica y económicamente. Ante esta problemática, cambios en el tratamiento de la planta donadora en la fase cero (preparativa) podrían contribuir a que las pérdidas se reduzcan (Bernal, 2018).
Según Rangel-Estrada et al. (2016) el banco de plantas donantes es el área destinada a conservar la semilla en su más alto grado de pureza. En estas condiciones, recibe atenciones culturales especiales durante su ciclo de desarrollo. Su objetivo es garantizar el material vegetal inicial del cual se partirá para la producción de semilla básica tradicional y para la propagación in vitro. Es recomendable mantener a las plantas madre, es decir la planta donadora de yemas, durante un período de tiempo que puede oscilar entre unas semanas o varios meses en una casa de cultivo bajo condiciones semicontroladas. Estas estructuras aíslan a las plantas total o parcialmente del medio ambiente que las rodea. Se cultivan en un ambiente protegido del ingreso de insectos vectores trasmisores de virus, además de otras plagas. De igual modo el uso de sustrato desinfectado permite una propagación libre de organismos patógenos y el uso de plántulas libres de virus procedentes del banco de semilla original (Noguera et al., 2013).
El presente trabajo tuvo como objetivo establecer un banco de plantas madre de caña de azúcar en condiciones semicontroladas para garantizar la eficacia del proceso de propagación in vitro con plantas libres de Xanthomonas albilineans.
MATERIALES Y MÉTODOS
La investigación se desarrolló en las áreas de la Estación Territorial de Investigaciones de la Caña de Azúcar (ETICA Centro-Villa Clara), perteneciente al Instituto de Investigaciones de la Caña de Azúcar (INICA); la cual está ubicada en la autopista Nacional, km 246 en el municipio de Ranchuelo, provincia Villa Clara.
Remodelación de la instalación para el banco de plantas donantes
Para establecer el banco de plantas donantes se realizó la adaptación de una casa de cultivo con ventanas de vidrio que existía en el centro. Los materiales utilizados para la remodelación fueron: 15 m manguera de ½”, 12 m de manguera de 3/4”, 40 m de alambre, 400 m de rafia o nylon cobertor, 140 m2 de malla antiáfidos, 324 m2 de malla sombra Sarán y 30 t de zeolita. Se eliminaron los canteros existentes y se rellenó con zeolita toda el área.
La estructura de la casa de cultivo se cubrió con malla de sombra Sarán (50%), se colocó cobertor antigoteo en el techo y las paredes laterales y la puerta se cubrieron con malla antiáfidos. También, se colocó un sistema de riego por aspersores para aplicar riego con una frecuencia de dos a tres veces por día, sobre todo en el horario del medio día y la tarde cuando las temperaturas son más altas.
Para el cultivo del material vegetal se emplearon recipientes de plástico con un volumen de 20 m3 con una capa de piedra en el fondo y posteriormente se rellenaron con una mezcla de compost de cachaza con zeolita 3:1 (v/v). Se colocaron 20 recipientes por cultivar. Además, la protección fitosanitaria incluyó badén para sumergir los pies y lavado de manos con soluciones desinfectantes (formol o hipoclorito de sodio al 0.2%).
Material vegetal
Para la plantación del material vegetal se realizó la selección de tallos de plantas de caña de azúcar sin síntomas de escaldadura foliar y con seis meses de cultivo de los cultivares: C98-357 Altamente Resistente (AR), C97-445 Resistente (R) y C86-156 Altamente Susceptible (AS), procedentes del Banco de Semilla Básica (BSB) de Cienfuegos.
En la selección del material vegetal se evaluaron las principales características agronómicas y botánicas que caracterizan cada cultivar, como son: aspecto del follaje, hábito de crecimiento, uniformidad de la cepa, color del tallo, diámetro, largo y forma del entrenudo, aurícula, forma de la yema y del dewlap. Los tallos seleccionados se cortaron en su parte media en segmentos de una yema que recibieron tratamiento hidrotérmico. Este consistió en remojarlos durante 24 horas en agua a temperatura ambiente y seguidamente se sometieron a un tratamiento a 51°C durante 20 minutos. A continuación, se enfrió en agua corriente a temperatura ambiente durante 5 minutos y se trató en una solución fungicida (Fundazol 1.0%, m/v) durante 15 minutos.
Posteriormente, se dejaron en reposo durante 24 horas a la oscuridad antes de efectuar la plantación. En este momento se aplicó el bioestimulante VIUSID Agro® (0.8 ml l-1) asperjado a la yema después de la termoterapia y antes de la plantación. Seguidamente los segmentos de tallos de una yema fueron colocados en los recipientes de plástico para garantizar su brotación (dos por recipiente). A los 15 días después de la plantación se dejó una yema por recipiente para establecer un plantón de caña de azúcar.
Las condiciones de cultivo fueron: Densidad de Flujo de Fotones Fotosintéticos (DFFF) en un rango de 209.4 a 1036 µmol m-2 s-1, medido con el auxilio de un luxómetro digital (modelo Multimetrix LM 76). Los valores de Humedad Relativa (HR) fueron una mínima de 49.5% y una máxima de 81.9%. La temperatura presentó valores entre 27.1 °C y 39 °C, que se registró por medio de un termohigrómetro (modelo Ebro Electronic® TFH 620).
Se garantizaron condiciones de limpieza y para la prevención de enfermedades que incluyeron que todas las herramientas y material de trabajo (machetes, cuchillos, rastrillo manual, regaderas, mochila de fumigación) fueron utilizados solo para esta área de trabajo y de esta forma evitar contaminación con microorganismos patógenos (virus y bacterias). En el momento de la toma de los tallos para el establecimiento in vitro posterior en el laboratorio se empleó un cuchillo o machete previamente desinfectado y antes de usarlo en la próxima planta se volvió a desinfectar con etanol al 70% (v/v) o hipoclorito de sodio al 0.1% (v/v). Semanalmente las hojas secas y restos de ellas fueron eliminados para garantizar una mayor sanidad.
Semanalmente se realizaron observaciones visuales a las plantas madre antes de la toma de muestras para evaluar el estado fitosanitario del material vegetal, previo al diagnóstico serológico.
Diagnóstico serológico
A los tres meses de cultivo se realizó un diagnóstico serológico al material vegetal existente en el Banco de Donantes en condiciones semicontroladas, con el objetivo de detectar la presencia de X. albilineans (Zardón et al., 2012).
Se colectaron 20 muestras al azar de tallos asintomáticos de cada cultivar existente en el Banco de Donante (una de cada recipiente de plástico), tomando el tercio medio de la hoja+3 para un total de 60 muestras, las cuales fueron llevadas al laboratorio, según refiere Jorge et al. (2020) para el diagnóstico por UMELISA de X. albilineans. Se empleó el kit AGDIA propuesto para micro ELISA y transferido a la tecnología ultra microanalítica (UMELISA) (Pérez, 2019).
Las muestras se maceraron y diluyeron en una solución tampón para su posterior incubación en cámara húmeda a 37 °C durante 20 horas y 30 minutos. A continuación, previos lavados con una solución de agua destilada y Tween 20, fue añadido un anticuerpo específico. Después, de 16 horas a 4 °C se realizó un nuevo lavado con la misma solución y se añadió un anticuerpo conjugado, para ser nuevamente incubadas a la temperatura mencionada anteriormente en un tiempo de tres horas. Finalmente se volvieron a lavar y se añadió un sustrato fluorogénico (4-metilumbeliferil fosfato) que desarrolla el color en la oscuridad. La intensidad de la fluorescencia emitida permitió detectar la presencia de la bacteria (García et al., 2001). Las muestran fueron clasificadas en positivas y negativas.
Con el objetivo de contar con un material vegetal con una mayor calidad sanitaria y fisiológica, y lograr una mejor respuesta en la fase de establecimiento in vitro, a las plantas que resultaron negativas al diagnóstico serológico se les realizó un tratamiento con diferentes productos bioestimulantes. Estos fueron FitoMas-E®, (ICIDCA, Cuba) 16 ml, fertilizante foliar Bayfolan forte®, (Bayer Crop Science, Alemania) 32 ml y fungicida sistémico Regnum 10 ml (Alfaagro, Alemania) por mochila, respectivamente. Una vez por semana, durante un mes le fueron aplicados con mochila de aspersión (Matabi, España) de 16 l de capacidad, con boquilla de inundación (flood–jet) Lurmark AN 2.5 con una presión de 1.5 a 2.0 bar, según los parámetros técnicos referidos por el fabricante.
Efecto de las condiciones semicontroladas de cultivo del material vegetal inicial en el establecimiento in vitro a partir de ápices
El objetivo de este experimento fue evaluar la respuesta del establecimiento in vitro con material vegetal procedente de plantas madre en condiciones semicontroladas de cultivo (banco de donantes semicontrolado) con el empleo de ápices caulinares. Se utilizaron cilindros de hojas jóvenes (10 cm) de la zona apical de caña de azúcar del cultivar C97-445. Tres días antes de la toma de los explantes se suspendió el riego.
Los cilindros se desinfectaron según se señaló anteriormente en procedimientos generales y se siguió el protocolo para el establecimiento in vitro de ápices de caña de azúcar de acuerdo con Jiménez et al. (1997). Los explantes se colocaron de forma invertida en tubos de cultivo de vidrio (16 x 2 cm), con 10 ml de medio de cultivo basal MS (Murashige y Skoog, 1962) con la adición de 0.3 mg l-1 de 6-bencilaminopurina (BAP).
Se emplearon 30 ápices de caña de azúcar. Las evaluaciones se realizaron a los 15 días de cultivo para las variables número de ápices contaminados (bacterias y hongos) y con oxidación fenólica o amarronamiento y a los 45 días de cultivo para las siguientes variables: número de ápices vivos, muertos y brotados. Los datos fueron convertidos a porcentajes.
RESULTADOS Y DISCUSIÓN
Establecimiento del banco de plantas donantes
Las condiciones semicontroladas de cultivo y el manejo de las plantas permitieron su crecimiento y desarrollo adecuado (Figura 1). Las características fenotípicas de los cultivares (follaje, hábito de crecimiento, color del tallo, diámetro, largo y forma del entrenudo, aurícula, forma de la yema y del dewlap) se correspondieron con las descritas por González (2019).
El cultivo de las plantas madre de caña de azúcar en recipientes de plástico independientes, el cobertor antigoteo en el techo, las paredes laterales y puerta cubierta con malla antiáfidos y sin contacto con el suelo, evitaron la infección por microorganismos patógenos y el desarrollo de enfermedades.

Figura 1. Estructura exterior del banco de donantes y plantas madres de caña de azúcar (Saccharum spp.) a los cuatro meses de cultivo utilizadas para el establecimiento in vitro.
La problemática abordada en este trabajo parte de que al trabajar con tejidos adultos de plantas provenientes de campo, el porcentaje de contaminación microbiana en este tipo de material vegetal es alto durante la fase de establecimiento in vitro. Al respecto, Ahloowalia et al. (2004) señalaron que en el cultivo in vitro de la caña de azúcar una etapa previa a la propagación requiere un mantenimiento adecuado de las plantas madre en el invernadero en condiciones libres de enfermedades e insectos con un mínimo de contaminantes. Antes de la selección de materiales vegetales para la propagación in vitro debe realizarse un pretratamiento con productos fungicidas y bactericidas para minimizar la contaminación microbiana en el cultivo in vitro (Cassells, 2012). Al respecto, también George y Debergh (2008) refirieron que durante la Fase 0 o preparativa se persigue garantizar material vegetal de partida de alta calidad genética y fitosanitaria, que permita disminuir los problemas de contaminación por microorganismos y lograr un esquema de propagación in vitro real y repetible.
Diagnóstico serológico
Como resultado del análisis de las 60 muestras de plantas asintomáticas analizadas por diagnóstico serológico de los tres cultivares evaluados, 58 resultaron negativas a la presencia de la bacteria patógena y dos positivas en el cultivar C86-156, altamente susceptible (Tabla 1). Todo esto demuestra la factibilidad del uso de estas condiciones de cultivo.
Tabla 1. Resultados del diagnóstico serológico mediante la técnica de UMELISA para la detección de Xanthomonas albilineans (Ashby) Dowson en tallos de tres cultivares de caña de azúcar (Saccharum spp.) asintomáticos cultivados durante cuatro meses en Banco de Donantes en condiciones semicontroladas.
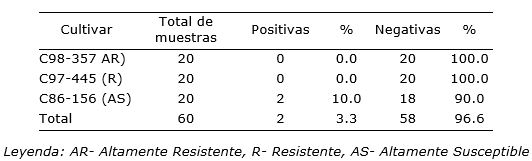
Las plantas madre que dieron positivas en el diagnóstico serológico a la bacteria (X. albilineans) fueron eliminadas del Banco de Donantes para de esta forma garantizar la calidad del material vegetal de partida y el incremento de la eficiencia al momento de la colecta para el establecimiento in vitro.
La disminución de la presencia de la bacteria (X. albilineans), agente causal de la escaldadura foliar, pudo ser debido a la combinación del tratamiento hidrotérmico de la semilla, las condiciones de cultivo de las plantas madre en el banco establecido en condiciones semicontroladas y la suspensión del riego tres días antes de la toma de los explantes.
Al respecto, Chinea et al. (2012) describieron las formas de transmisión de esta enfermedad, que puede ser fundamentalmente por los implementos de corte y por el empleo de semilla infectada. También, señalaron que existen otras vías de propagación del agente causal, entre ellas: el agua de lluvia, el suelo, exudados radicales por contactos entre plantas afectadas, daños mecánicos por el viento u otras causas, así como por algunos insectos y roedores. Con la utilización de las condiciones de cultivo desarrolladas en la presente investigación puede ser minimizada la incidencia de esta enfermedad lo cual corroboró los resultados de Noguera et al. (2013) quienes alcanzaron resultados satisfactorios al emplear un banco de donantes con condiciones de cultivo semicontrolado, para la toma del material vegetal para la propagación in vitro de la caña de azúcar. Además, señalaron un control efectivo de la escaldadura foliar con la combinación de estas condiciones de cultivo y el tratamiento hidrotérmico a las secciones de tallos de una y dos yemas en cultivares argentinos de caña de azúcar.
Estudios realizados en Cuba por Pérez (2019) con el empleo de diagnosticadores nacionales mostraron con DAS-UMELISA una sensibilidad del diagnóstico del 90.78% y una eficacia de 97.12%, similar a lo informado por Iglesias et al. (2009) de 96%, con un límite de detección de 105 células ml-1. Estos resultados confirman el valor del método empleado en el diagnóstico de X. albilineans.
Efecto de las condiciones semicontroladas de cultivo del material vegetal inicial en el establecimiento in vitro a partir de ápices
Los resultados obtenidos durante la fase de establecimiento in vitro del material vegetal en el cultivar C97-445de caña de azúcar mostraron que los 30 ápices obtenidos a partir de plantas madre, no presentaron pérdidas por contaminación microbiana, muy baja oxidación fenólica (3.5%) y muerte (3.3%) y se alcanzó el 95.6% de brotes establecidos in vitro con buena calidad fisiológica (Figura 2). Cuando los explantes son tomados de las plantas de campo tienen problemas de contaminación microbiana, ya que la desinfección total de estos es generalmente difícil (Rakesh et al.., 2011). Además, también su estado fisiológico influye en la respuesta in vitro (George y Debergh, 2008).

Figura 2. Plantas in vitro de caña de azúcar (Saccharum spp.) cv. C97-445 establecidas a partir de plantas madre cultivadas en banco de donantes en condiciones semicontroladas. (A) 7 días de cultivo en oscuridad. (B) 15 días de cultivo en cámara de crecimiento con luz solar.
Es importante señalar que la combinación de tallos jóvenes de plantas madre crecidos en condiciones semicontroladas de cultivo y malla sombra 50%, redujo la producción de fenoles. Esto permitió alcanzar un 95.6% de ápices del cultivar C97-445 brotados a los 45 días. Estos resultados coinciden con lo informado por Tiwari et al. (2012) que plantearon que los explantes de plantas cultivadas en invernadero muestran mejores resultados para la propagación in vitro, ya que la carga de contaminantes microbianos es mínima en comparación con los cultivados en condiciones de campo. Además, estos autores señalaron que existen variaciones con respecto a la respuesta de los explantes al cultivo in vitro tomados de plantas cultivadas en condiciones de campo y dependen de las condiciones climáticas durante el año. En relación con los anterior Lal et al. (2015) refirieron que este es uno de los problemas principales a resolver en el establecimiento in vitro de la caña de azúcar a nivel internacional.
El manejo de los factores que provocan la oxidación de los felones, fue muy importante en la durante la presente investigación porque evitó la muerte de los explantes y con ello una mayor regeneración (Guevara et al., 2016). Estos resultados coincidieron con los obtenidos por Bernal (2018) quien mostró que la combinación de brotes jóvenes de plantas crecidas en condiciones semicontroladas de cultivo con malla sombra del 50% y suspensión del riego, redujo la producción de fenoles por las plantas de caña de azúcar.
Sobre lo anterior, autores como Agramonte et al. (2001), Martínez-Ruiz et al. (2005) y Quiala et al. (2012) describieron en las metodologías desarrolladas para especies leñosas como eucalipto (Eucalyptus sp.), guayaba (Psidium guajava L.) y teca (Tectona grandis L.), la importancia del establecimiento de un banco de plantas donantes bajo condiciones de semicontroladas (invernadero o casa de cultivo). También la aplicación sistemática de fungicidas comerciales, con el fin de disminuir los porcentajes de contaminación microbiana en la fase de establecimiento in vitro.
Los resultados de la presente investigación permitieron emplear para el establecimiento in vitro de la caña de azúcar plantas madre libres de la bacteria agente causal de la enfermedad la escaldadura foliar, lo que redujo o eliminó tener que realizar en la Biofábrica la separación por líneas a partir de cada explante establecido. También disminuyó la fenolización durante esta fase, y aumentó la eficiencia del proceso. Además, de tener que realizar a una mayor cantidad de muestras el análisis serológico lo que incrementaría los costos.
CONCLUSIONES
El establecimiento del banco de plantas madre de caña de azúcar en condiciones semicontroladas y su manejo garantizan la eficiencia del proceso de propagación in vitro. Las condiciones semicontroladas de cultivo permiten disminuir la incidencia de Xanthomonas albilineans
AGRADECIMIENTOS
A la dirección el Instituto de Investigaciones de la Caña de Azúcar (INICA), de la Estación Territorial de Investigaciones de la Caña de Azúcar Centro-Villa Clara por asignar el presupuesto necesario para realizar la investigación. Al Instituto de Tecnología Agroindustrial del Noroeste Argentino (ITANOA), Estación Experimental Agroindustrial Obispo Colombres (EEAOC)-Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Tucumán, Argentina por su cooperación en la realización del trabajo. Los financistas no tuvieron participación en el diseño del estudio, la colecta y análisis de los datos. La decisión de publicar o la preparación del manuscrito es de la institución y el colectivo de autores del proyecto.
Conflicto de interés
No se declaran conflictos de intereses.
Contribución de los autores
Conceptualización ABV, Metodología ABV, PMA, EATR, ASN, Investigación ABV, PMA, DNJ, EATR, RGK, Análisis formal ABV, Escritura-primera revisión ABV, Escritura-revisión y edición ABV, RGK, ASN, APC.
REFERENCIAS
Agramonte D, Fernández LD, Boggiano AT, Pérez M, Ramírez D, Gutiérrez O (2001) Micropropagación del Eucalyptus grandis (Hill ex Maiden) a partir segmentos nodales. Biotecnología Vegetal 1(2): 109-114
Ahloowalia B, Savangikar V, Prakash J, Savangikar C (2004) Low cost options for tissue culture technology in developing countries. International Atomic Energy Agency 1384: 112
Bernal A (2018) Compuestos fenólicos de caña de azúcar (Saccharum spp.) obtenidos en Biorreactores de Inmersión Temporal con actividad protectora contra patógenos. Tesis presentada en Opción al Grado Científico de Doctor en Ciencias Agrícolas, Universidad Agraria de La Habana, La Habana, Cuba
Cassells AC (2012) Pathogen and Biological Contamination Management in Plant Tissue Culture: phytopathogens, vitro pathogens, and vitro pests. En: Loyola-Vargas V, Ochoa-Alejo N (eds). Plant Cell Culture Protocols Methods in Molecular Biology (Methods and Protocols), vol 877, pp. 57-80. Humana Press, Totowa; doi:10.1007/978-1-61779-818-4_6
Chinea A, Rodríguez E, Pérez G, Chinea Horta A, Pérez Y (2012) Actualización del inventario de enfermedades de la caña de azúcar detectadas en Cuba. Revista ATAC 73(1): 33-37
García MA, Pinilla A, Fernández JL, Rodríguez A, Horta T (2001) Fluorímetro-Fotómetro Multicanal para Inmunoensayos. Tecnosuma Internacional SA, La Habana
George EF, Debergh PC (2008) Micropropagation: uses and methods. En: George EF, Hall MA, De Klerck J (eds). Plant Propagation by Tissue Culture Vol 1 The Background, pp. 29-64. Springer, Dordrecht
González RM (2019) Variedades de caña de azúcar cultivadas en Cuba Cronología, legislación, metodologías y conceptos relacionados. Editorial ICIDCA, La Habana; ISBN: 978-959-7165-58-3
Guevara L, Arencibia Padilla JA, Sala S, Aguilar A, Tirado F, Gómez-Kosky R (2016) Establecimiento in vitro del portainjertos híbrido ‘Garfi x Nemared’ para durazno. Biotecnología Vegetal 16(2): 73 -82
Iglesias A, Díaz M, Álvarez E, Arocha Y (2009) Diagnóstico de enfermedades bacterianas de la Caña de Azúcar en Cuba. Fitosanidad 13(1): 38-39
INICA (2019) Informe a la Reunión Nacional de Variedades y Semillas. PUBLINICA, La Habana
Jiménez E, García L, Suárez M, Alvarado Y (1997) Instructivo técnico para la micropropagación de la caña de azúcar. Instituto de Biotecnología de las Plantas UCLV, Santa Clara
Jorge H, González A, Pérez Y, Suárez OJ (2020) Influence of hydrothermal treatment time on the percentage of sprouting, cane production and control of seed diseases propagated by cuttings. Centro Agrícola 47(3): 33-42
Kavita ML, Saxena S (2016) Propagating sugarcane in vitro: an opportunity for indian sugar industry. Indian Journals Agric 5: 7-19
Lal M, Tiwari AK, Gupta G N (2015) Commercial scale micropropagation of sugarcane: Constraints and remedies. Sugar Tech 17(4): 339-347
Martínez-Ruiz R, Aspiroz-Rivero HS, Rodríguez-De la O JL, Cetina-Alcalá V, Gutiérrez-Espinosa MA (2005) Aclimatación de plantas obtenidas in vitro de Eucalytus urophilla S.T. Blake y Eucaliptus grandis Hill Ex Maiden. Ra Ximhai 1(3): 591-597
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant 15: 473-497
Noguera AS, Paz, N V, Díaz ME, Perera, MF, Díaz- Romero C, García MB, Filippone MP, Welin B, Cuenya MI, Digonzelli PA, Castagnaro AP (2013) Production of healthy seed cane in Tucumán, Argentina. Revista Industrial y Agrícola de Tucumán 91(1): 37-41
Pérez YP (2019) Contribución al sistema evaluativo de la resistencia de cultivares de caña de azúcar frente a escaldadura foliar (Xanthomonas albilineans (Ashby) Dowson) en Cuba. Tesis presentada en opción al Grado Científico de Doctor en Ciencias Agrícolas, Universidad Agraria de La Habana, Mayabeque, Cuba
Quiala E, Cañal MJ, Meijón M, Rodríguez R, Chávez M, Valledor L, de Feria M, Barbón R (2012) Morphological and physiological responses of proliferating shoots of teak to temporary immersion and BA treatments. Plant Cell, Tissue and Organ Culture 109(2): 223-234
Rakesh S, Kaur S, Garg S (2011) Role of tissue culture technique in high sugarcane production. International Research Journal Life Science Leaflets 21(2): 1008-1017
Rangel-Estrada SE, Hernández-Meneses E, Hernández-Arenas M (2016) Micropropagation of sugarcane varieties grown in México. Revista Fitotecnia Mexicana 39(3): 225 – 231
Santana I, Nodarse O, Arencibia AD, Montes de Oca JL, Bernal A, Machado P, Occeguera Z, Jiménez M, Cortegaza L, Carmona E R, Zayas C M, Capote M (2011) Biotecnología. En: Jorge H, Jorge I, Mesa JM (eds). Normas y Procedimientos del Programa de Fitomejoramiento de la Caña de azúcar en Cuba, INICA, La Habana
Tiwari A, Tripathi S, Lal M, Mishra S (2012) Screening of some chemical disinfectants for media sterilization during in vitro micro propagation of sugarcane. Sugar Tech 14(4): 364-369
Zardón MA, Gallo A, Mesa JM, Arencibia A, Zamora L, Martínez Y, Sautié M, Casas M, LaO M (2012) Detección de infecciones mixtas en genotipos de caña de azúcar en Cuba. Prot Veg 27(2): 77-84
Recibido: 10-12-2020
Aceptado: 01-02-2021
Copyright (c) 2021 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
