ARTÍCULO ORIGINAL
Biotecnología Vegetal Vol. 14, No. 3: 155 - 162, julio - septiembre,
2014
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
Instituto de Biotecnología de las Plantas. UCLV. MES.
Respuesta fisiológica al estrés hídrico de plantas de banano cv. `Pineo gigante' (Musa AAA) regeneradas a partir de yemas irradiadas
Physiological response to hydric stress of banana plants cv. `Pineo Gigante' (Musa AAA) regenerated from irradiated buds
Efraín Salazar1*, Iselen Trujillo2, Mercedes Pérez Macías3, María Angélica Gutiérrez3, Luis Castro1, Elba Vallejo1, María Torrealba1. *Autor para correspondencia
1Centro
Nacional de Investigaciones Agropecuarias (INIA-CENIAP). Unidad de Biotecnología.
Campo experimental CENIAP. Edificio 09. Zona universitaria vía El Limón.
Maracay 2105. Venezuela. e-mail: efra63@gmail.com
2Universidad
Nacional Experimental Simón Rodríguez (UNESR). Instituto de Desarrollo
Científico y Tecnológico (IDECYT). Laboratorio de Biotecnología
Agrícola. Altos de El Cují. Calle Mara. Carretera la Mariposa.
San Antonio, Estado Miranda. Venezuela
3Laboratorio de Fisiología Vegetal y Microclima. Centro Nacional de Investigaciones Agropecuarias (INIA-CENIAP). Edificio 07. Zona universitaria vía El Limón. Maracay 2105. Estado Aragua. Venezuela
RESUMEN
La sequía ha incidido negativamente en la agricultura, especialmente en aquellos cultivos con alta demanda hídrica como las musáceas. Por ello, se trabaja en la búsqueda de materiales vegetales con tolerancia. El objetivo del presente trabajo fue caracterizar la respuesta fisiológica de plantas de banano cv. `Pineo gigante' (Musa AAA) regeneradas in vitro a partir de yemas irradiadas con rayos X, al estrés hídrico en casa de cultivo. Se midieron las tasas de fotosíntesis neta, la tasa de transpiración, la conductancia estomática y se determinó el contenido de clorofila a y clorofila b, en plantas sometidas a 0, 24, 48, 72 y 96 horas sin riego. Las plantas provenientes de yemas irradiadas tuvieron un comportamiento fisiológico diferencial tendiente a un mejor manejo del agua y el mantenimiento de las actividades fotosintéticas en condiciones de estrés hídrico simulado.
Palabras clave: fisiología vegetal, fotosíntesis, mutaciones, tolerancia a sequía
ABSTRACT
Drought has adversely affected agriculture, especially in those crops with high water demand such as Musa. Therefore, finding tolerant plant materials it is required. The aim of this study was to characterize the physiological response of banana plants cv. `Pineo gigante' (Musa AAA), in vitro regenerated from buds irradiated with X-rays, to water stress at greenhouse. In plants subjected to 0, 24, 48, 72 and 96 hours without irrigation, rate of net photosynthesis, transpiration rate and stomatal conductance were measured. Besides, the content of chlorophyll a and chlorophyll b was determined. Plants from irradiated buds had a differential physiological behaviour tending to a better water management and to the maintenance of photosynthetic activity under simulated water stress.
Key words: drought tolerance, mutations, plant physiology, photosynthesis
INTRODUCCION
En Venezuela, el
cultivo de bananos y plátanos (Musa spp.) representa el principal
rubro frutal. En el último censo agrícola nacional se registraron
20 503 unidades de producción agrícola en el país que involucran
a 21 940 familias productoras de bananos. Estos datos ratifican la importancia
social del cultivo, sobre todo si se toma en cuenta que las unidades de
producción oscilaron entre 3 y 60 hectáreas, con un promedio de
aproximadamente 11 hectáreas. Ello evidencia que en el caso de bananos,
en su mayoría se trata de pequeños y medianos agricultores (MPPAT,
2010).
Por otro lado, el déficit hídrico es un proceso complejo y generalmente poco entendido, que afecta a una alta proporción de la población y ha presentado una tendencia a incrementarse de manera irregular a través del tiempo, con efectos acumulativos y residuales. La sequía ha incidido negativamente en la agricultura, especialmente en aquellos cultivos con alta demanda hídrica como las musáceas.
En este sentido, es importante señalar que la temperatura y la humedad relativa del aire, pueden tener un efecto directo e indirecto sobre el crecimiento de las plantas. Dado que la condición de sequía, generalmente viene asociada a temperaturas altas, puede ser significativo el efecto negativo sobre procesos fisiológicos como la respiración, la transpiración, la división celular y la fotosíntesis (Cunha et al., 2009). La baja disponibilidad de agua, en las musáceas puede conducir a un retardo y disminución en la floración, para garantizar el mantenimiento del crecimiento vegetativo. En este sentido, Akinro et al. (2012) establecieron la alta susceptibilidad de las musáceas ante el déficit hídrico durante todas las fases del crecimiento, y confirmaron la necesidad de suministro constante de agua a las musáceas comestibles.
El banano cv. `Pineo Gigante' (Musa AAA) se cultiva en las zonas productoras del centro de Venezuela (MPPAT, 2010), y se ha caracterizado por una alta susceptibilidad al estrés hídrico. Dada la alta demanda hídrica, ya establecida para las musáceas, el cultivo de estos materiales vegetales ha requerido la implementación de riego. Esto afecta a los pequeños y medianos productores, los cuales, ante la imposibilidad de hacer frente a estos costos de producción, migran hacia otros cultivos o abandonan la actividad agrícola.
Ante lo anteriormente
expuesto, es prioritario desarrollar materiales vegetales de banano con tolerancia
a estrés hídrico, a fin de favorecer a los pequeños y medianos
productores nacionales. Sin embargo, no se encuentra tolerancia natural entre
los materiales de banano disponibles comercialmente. Si se toma que en cuenta
que la mayoría de los cultivares utilizados son estériles, cualquier
estrategia de mejoramiento genético deberá basarse en métodos
no tradicionales. En este sentido, desde la década de los 90 en el siglo
XX, se estableció la posibilidad de inducir mutaciones en banano utilizando
radiación ionizante (Novak et al., 1990). De igual modo,
Bidabadi et al. (2012) informaron del uso de mutagénesis química
para la obtención de materiales vegetales triploides de Musa tolerantes
a estrés hídrico.
En estudios previos se obtuvieron plantas de banano cv. `Pineo Gigante' (Musa AAA), regeneradas in vitro a partir de yemas irradiadas, las cuales crecieron en casa de cultivo sometidas a condiciones simuladas de estrés hídrico (Salazar, 2014). El objetivo del presente trabajo fue caracterizar la respuesta fisiológica de estos materiales vegetales bajo condiciones simuladas de estrés hídrico.
MATERIALES Y MÉTODOS
Material vegetal
Se trabajó con 25 plantas de banano cv. `Pineo Gigante' (Musa AAA) regeneradas in vitro a partir de yemas irradiadas con 30Gy de Rayos X (Salazar, 2014) y seleccionadas por su tolerancia a condiciones simuladas de estrés hídrico (mutantes). Se compararon con 25 plantas del mismo cv. regeneradas in vitro a partir de yemas no irradiadas (plantas control).
Caracterización de la respuesta fisiológica
Las plantas crecieron en condiciones de casa de cultivo en bolsas de polietileno negro de 1 kg de capacidad con un sustrato compuesto por tierra: arena (1:3), a fin de garantizar el rápido drenaje del agua para la simulación de las condiciones de estrés hídrico.
Las plantas se mantuvieron en casa de cultivo (32 ± 2°C y 70% de humedad relativa). Después de un último riego a los 0, 1, 2 ,3 y 4 días de condiciones de estrés hídrico se realizaron mediciones de la tasa de fotosíntesis neta, así como del contenido de clorofila, la tasa de transpiración foliar y la conductancia estomática. Para tal fin se utilizó un equipo portátil de medición de fotosíntesis marca CID modelo CI-340. Las mediciones se realizaron en la tercera hoja, y se tomaron tres medidas de cada variable siempre a las 10 de la mañana.
Además, se cuantificó el contenido de pigmentos fotosintéticos (clorofila a y clorofila b) y para ello se colocaron 100 mg de tejido foliar en un tubo de ensayo, se agregaron 10 ml de etanol 80% y se marcó el nivel del líquido en el tubo. Se colocaron los tubos a hervir durante 10 minutos, y se completó nuevamente el volumen perdido con etanol 80%. Se eliminó el tejido, y el líquido fue analizado espectrofotométricamente a 645 y 663 nm respectivamente. Se usó etanol 80% como blanco. Las concentraciones de clorofila a y clorofila b se estimaron de acuerdo con las ecuaciones propuestas por Bruinsma (1963), donde se establece que:
Clorofila a= 12.7 x A663 - 2.69 x A645
Clorofila b= 22.9 x A645 4.68 X A663
Como control de la uniformidad de las condiciones hídricas ambientales se estimó la demanda evaporativa ambiental mediante el uso de un atmómetro de Piché. Se midió el volumen de humedad evaporada en mililitros. A fin de garantizar la condición de estrés hídrico en el suelo, se midió su contenido de humedad mediante el uso de sensores de humedad de matriz porosa en cada recipiente de cultivo. Durante todo el eexperimento se garantizaron las condiciones simuladas de estrés hídrico (Salazar, 2014).
Los ensayos se realizaron bajo un diseño completamente al azar y los resultados se analizaron mediante un Análisis de Varianza, previa confirmación de la distribución normal de los datos mediante la prueba de normalidad de Shapiro-Wilks y la prueba de homocedasticidad de las varianzas de Levene. Se utilizaron 10 plantas de cada uno de los dos grupos evaluados (irradiados y no irradiados) para 0 y 5 días bajo estrés.
RESULTADOS Y DISCUSIÓN
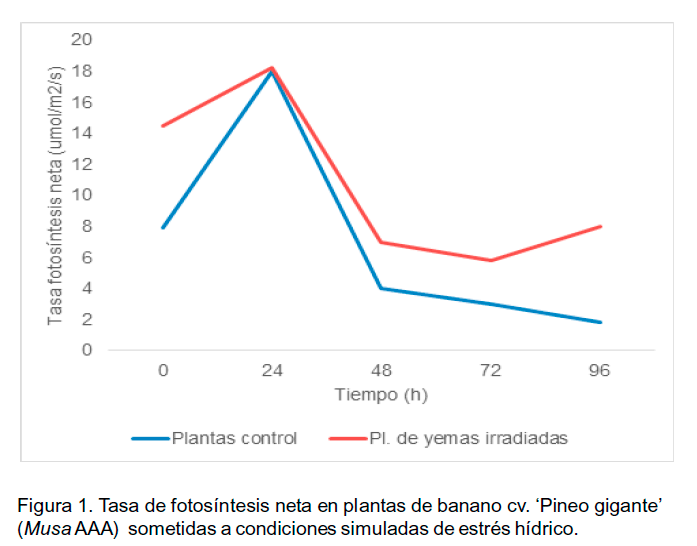
Se comprobó que la tasa de fotosíntesis neta de las plantas obtenidas de yemas irradiadas fue superior a la exhibida por las plantas control. En ambos tratamientos se observó un incremento en la tasa de fotosíntesis neta las primeras 24 h posteriores a la supresión del riego, lo cual se interpreta como una respuesta adaptativa inicial ante las condiciones de estrés oxidativo que se desencadenan por la falta de agua. Las plantas control sufrieron a partir de este momento un descenso brusco en la tasa de fotosíntesis neta, la cual continuó decreciendo durante todo el experimento (Figura 1).
En las plantas provenientes de yemas irradiadas, de igual forma, se observó una disminución en la tasa de fotosíntesis neta hasta las 48 h, menos drástica hasta las 72 h y posteriormente exhibieron un aumento en esta variable. El efecto se caracterizó por una declinación rápida de la tasa de fotosíntesis en las primeras horas bajo estrés. Esta disminución pudo estar relacionada con pérdida de actividad de RuBisCo y de la eficiencia cuántica del fotosistema II de la fotosíntesis. Del mismo modo, aspectos metabólicos que ocasionaron daños oxidativos a los cloroplastos pudieran vincularese con esta pérdida de la capacidad fotosintética. Otros autores han informado resultados similares en otros cultivos. Por ejemplo, Rzigui et al. (2013) establecieron que bajo condiciones de estrés hídrico, mutantes de Nicotiana sylvestris Speg. & Come presentaron mayores tasas fotosintéticas que los individuos silvestres de la misma especie. En cualquiera de los dos casos, la tendencia general fue a disminuir los valores de las tasas de fotosíntesis neta.
Por otra parte, la recuperación en la tasa de fotosíntesis neta después de 72 horas podría deberse a que la tasa de recuperación de la actividad fotosintética es más lenta que la de la actividad respiratoria. Esta última se recupera casi instantáneamente mientras que la actividad fotosintética se recupera lenta y gradualmente, sobre todo por la alta sensibilidad del aparato fotosintético ante los estímulos externos. Estos procesos de reparación de los fotosistemas pudiesen estar implicados en la elevación de la tasa de fotosíntesis neta posterior a las 72 horas bajo estrés hídrico.
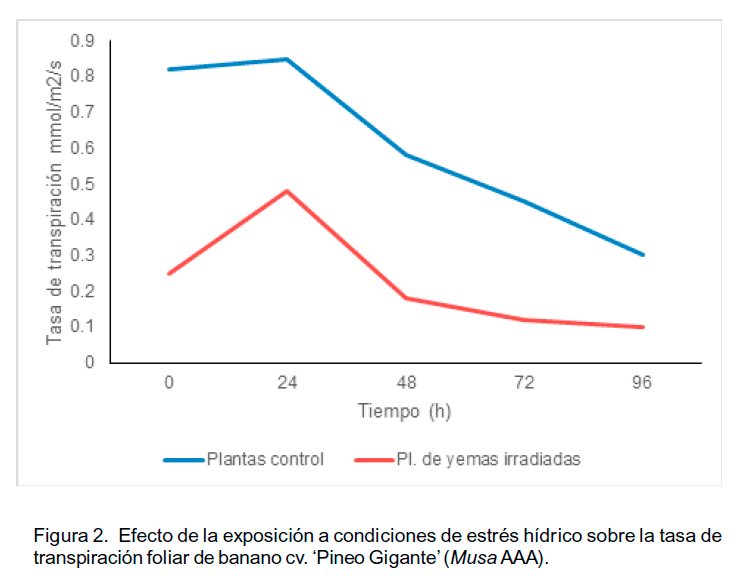
La tendencia en las plantas control fue a incrementar levemente la tasa de transpiración durante las primeras 24 h, y luego se presentó una disminución en este parámetro similar al observado en la tasa fotosintética neta (Figura 2). Las plantas regeneradas a partir de yemas irradiadas presentaron valores de transpiración menores que el control. El comportamiento fue similar al observado para la tasa de fotosíntesis neta, sin embargo, no se notó un incremento de la transpiración posterior a 72 h. Los valores se mantuvieron bajos, con una tasa de transpiración foliar relativamente constante a partir de las 72 horas de exposición al estrés hídrico.
Del mismo modo
que las plantas control del presente estudio, se ha referido por Gupta y Berkowitz
(1987) que plantas de diferentes genotipos de Musa (AAA) redujeron drásticamente
la tasa de transpiración cuando fueron sometidas a condiciones de estrés
hídrico. Los menores valores observados en las plantas provenientes de
yemas irradiadas pueden estar relacionados con una menor pérdida de agua,
como
estrategia adaptativa al estrés hídrico. Las plantas control,
a pesar que redujeron su tasa de transpiración, estaban perdiendo cantidades
de agua mucho mayores que las eliminadas por las plantas provenientes de yemas
irradiadas, indicativo de mayor susceptibilidad a las condiciones de estrés
hídrico. Este aumento en la tasa de transpiración se tradujo en
una disminución de la tasa neta de fotosíntesis.
En este sentido, Siddique et al. (2000) indicaron que la exposición de plantas de musáceas a condiciones de estrés hídrico, reducían drásticamente la tasa de transpiración foliar, con un consecuente incremento sobre la temperatura foliar. Sin embargo, Masle et al. (2005) establecieron que existía un control genético específico para las respuestas transpiratorias de las plantas. Por lo tanto, el comportamiento diferencial observado entre las respuestas de las plantas provenientes de yemas irradiadas y las de las plantas control podría deberse a expresión de genes específicos para el control de la transpiración, tales como el gen MusaWRKY71, el cual media los procesos de respuesta adaptativa de plantas de banano hacia el estrés oxidativo o la tolerancia de estrés abiótico. Este tipo de interacción podría explicar el hecho de que a pesar de tener menor tasa de transpiración, y por ende de intercambio gaseoso, las plantas provenientes de yemas irradiadas, tuvieran una mayor tasa de fotosíntesis. Este aspecto requiere de mayor profundización en estudios posteriores.
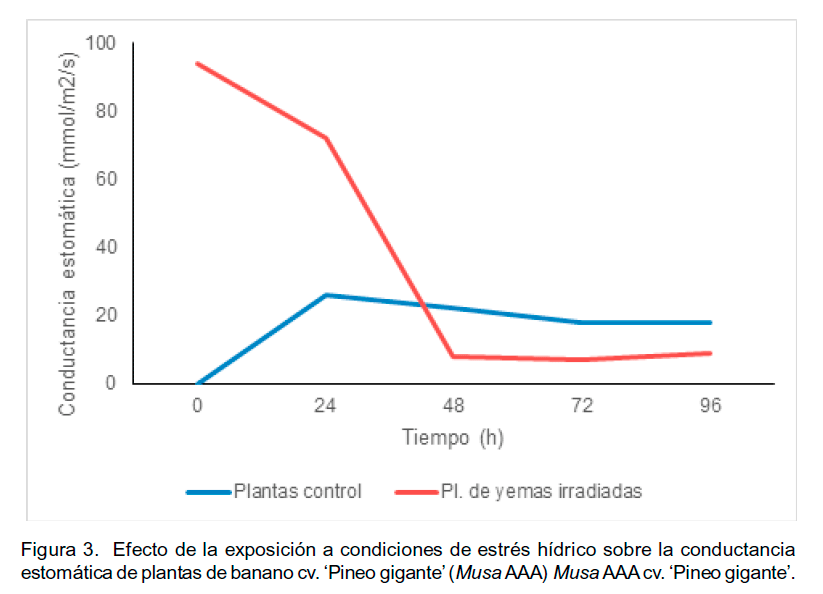
Se observó que las plantas control tuvieron una tendencia a incrementar la conductancia estomática de manera inmediata a la inducción de la condición de estrés hídrico para luego tener una ligera disminución a las 48 horas. Por otro lado, en las plantas provenientes de yemas irradiadas se observó una disminución de la conductancia estomática a las 24 horas, y una reducción drástica hacia las 48 horas bajo estrés (Figura 3). Se ha demostrado que las condiciones de estrés hídrico tienden a inducir una disminución en los parámetros de intercambio gaseoso, como estrategia de disminución de la pérdida de agua, y por consecuencia se afecta la fotosíntesis (Lawlor y Cornic, 2002).
Se ha establecido por diferentes autores que la disminución de la conductancia estomática conduce a una disminución en la fotosíntesis neta, pero que dependiendo de la condición de estrés y de la concentración atmosférica del dióxido de carbono (CO2), factores metabólicos podrían ejercer su efecto haciendo más compleja la interpretación del comportamiento fisiológico de las plantas. Entre las rutas metabólicas que pueden intervenir en este proceso, la biosíntesis de á-tocoferoles, entre otros isoprenoides plastídicos, parece jugar un papel importante en la respuesta adaptativa al estrés (Loyola et al., 2012).
En opinión de Ravi et al. (2013), la tolerancia al estrés hídrico dependería de la capacidad que tengan los genotipos de mantener las funciones vitales en las condiciones de baja disponibilidad de agua e intercambio gaseoso. En este sentido, se ha considerado fundamental la recuperación de la hidratación de las células y de las plantas en condiciones de bajos potenciales hídricos. Al comparar las tres variables anteriores (Figuras 1-3), se observa que las plantas provenientes de yemas irradiadas, redujeron la capacidad de pérdida de agua, pero fueron capaces de mantener una tasa de fotosíntesis neta mayor que las plantas control. Al final del período de estudio bajo condiciones de estrés, se observó una recuperación tanto de la fotosíntesis neta como de la conductancia estomática, lo que pudiera explicar la tolerancia a estrés hídrico, observada en estas plantas, desde el punto de vista fotosintético.
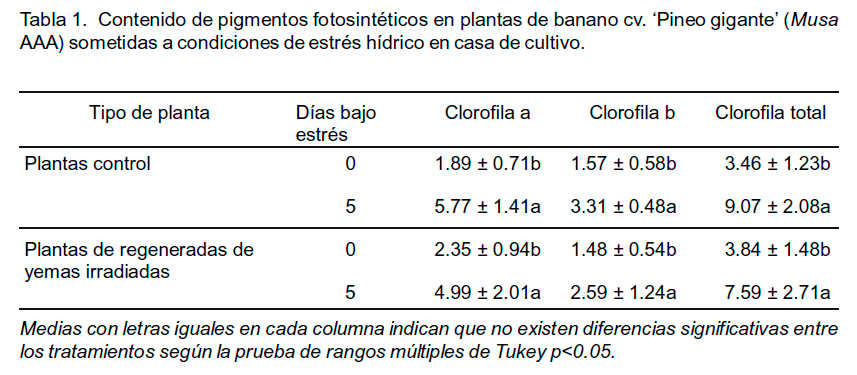
De igual modo, se apreció que el comportamiento de la tasa de fotosíntesis neta, parece estar más influenciada por la tasa de transpiración, y por ende del intercambio gaseoso, que por el comportamiento de la conductancia estomática. Lo anterior, se hace más evidente en las plantas control que en las provenientes de yemas irradiadas. Otro aspecto de importancia fue el manejo de los pigmentos fotosintéticos durante el estrés (Tabla 1).
El análisis Shapiro-wilks arrojó un valor W de 0.90, 0.94 y 0.91 para clorofila a, clorofila b y clorofila total respectivamente, demostrándose la distribución normal de los resultados. El análisis de varianza demostró que no existieron diferencias significativas entre los tratamientos, pero que sí en el contenido de las tres variables analizadas para el caso de los días bajo estrés hídrico. Sin embargo, es importante recalcar que en el caso del presente experimento las diferencias observadas en los valores obtenidos para los dos días analizados pudiesen deberse a diferencias en el tiempo de incubación de las muestras.
Olivares (2005) indicó un incremento en los valores de pigmentos clorofílicos de Nothofagus dombeyi (Mirb.) Oerst por efecto del estrés hídrico, comportamiento similar al exhibido por los dos tipos de plantas de Musa en el presente estudio. Sin embargo, no se encontraron cambios en la relación clorofila a/clorofila b en N. dombeyi, mientras que en el caso de Musa la relación entre los dos pigmentos aumentó de manera significativa y se favoreció la concentración de la clorofila a. Esto parece indicar, que se favorece la producción de pigmentos captadores de la energía fotónica, por encima de los pigmentos encargados de la fotoprotección, quizás como estrategia de mantenimiento de la fotosíntesis en condiciones limitadas de agua y de intercambio gaseoso. En estas condiciones lo que se favorece generalmente es el transporte cíclico de electrones para seguir produciendo ATP y equivalentes reductivos.
También muchos carotenoides pasan a convertirse en xantofilas para protegerse de la fotoxidación. Del mismo modo, parece ser un índice indirecto de una baja fotooxidación de los pigmentos, razón por la cual se piensa que las alteraciones fotosintéticas no se deben a problemas con la síntesis de los pigmentos. Por otro lado, al comparar las proporciones de los dos tipos de clorofila analizadas, se comprobó que las plantas control incrementaron el contenido de clorofila a en aproximadamente 10%, mientras que las plantas provenientes de yemas irradiadas modificaron el contenido de clorofila a en 4.5%. No obstante, la proporción de clorofila a/clorofila b siempre fue superior en el caso del material vegetal irradiado. Se espera que ante condiciones de estrés hídrico severas, los niveles de los pigmentos fotosintéticos disminuyan (Yong et al., 2012); sin embargo, en la presente investigación el contenido de clorofila a se incrementó.
Dalal y Tripathy (2012) establecieron que el estrés hídrico influía en la expresión de genes relacionados con la biosíntesis de las clorofilas, y es posible los niveles de irradiación utilizados estimulen la formación de los pigmentos fotosintéticos, y no favorezcan su fotoxidación. El mantenimiento de la concentración de los pigmentos fotosintéticos parece indicar que las modificaciones en el proceso de fotosíntesis, se deben a factores metabólicos relacionados con la fisiología del proceso. El estrés hídrico en los genotipos susceptibles implica una mayor permeabilidad del O2 hacia el interior de las células vegetales, por ello, en los cloroplastos el entorno de la Rubisco puede tener una mayor concentración de O2 en lugar de CO2 y con ello se favorece la actividad oxigenasa en lugar de la actividad carboxilasa.
CONCLUSIONES
Los materiales
vegetales tolerantes procedentes de yemas irradiadas se caracterizaron por una
mayor tasa de fotosíntesis neta que las plantas control provenientes
de yemas no irradiadas. Además, presentaron una disminución drástica
de la misma en las primeras 48 horas bajo estrés. A partir de las 72
horas se comenzó a notar un incremento en la tasa de fotosíntesis
neta de los tolerantes
(irradiados), no así en las plantas susceptibles procedentes de yemas
no irradiadas. Este comportamiento parece estar asociado a daños en el
fotosistema II el cual parece tener la capacidad de recuperación a partir
de las 72 horas, exclusivamente en las plantas irradiadas. De igual modo, las
plantas mutantes tuvieron menor tasa de transpiración que las no irradiadas,
y el comportamiento de la conductancia estomática fue similar al de la
tasa fotosintética en los mutantes tolerantes, mientras que las plantas
provenientes de yemas no irradiadas tuvieron un comportamiento completamente
diferente en este último parámetro.
REFERENCIAS
Akinro AO, Olufayo AA, Oguntunde PG (2012) Crop Water Productivity of Plantain (Musa spp.) in a Humid Tropical Environment. Journal of Engineering Science and Technology Review 5(1): 19-25
Bidabadi S, Maziah M, Baninasab B, Ghobadi C (2012) Influence of salicylic acid on morphological and physiological responses of banana (Musa acuminate cv. `Berangan', AAA) shoot tips to in vitro water stress induced by polyethylene glycol. POJ 5(1):33-39
Bruinsma J (1963) The quantitative analysis of chlorophylls a and b in plant extracts. Photochem Photobiol 2: 241-249
Cunha AC, Paiva HN, Leite HG, Barros NF, Leite FP (2009) Relações entre variáveis climáticas com produção e enraizamento de miniestacas de eucalipto. Revista Árvore 33 (02): 195-203
Dalal VK, Tripathy BC (2012) Modulation of chlorophyll biosynthesis by water stress in rice seedlings during chloroplast biogenesis. Plant, Cell & Environment 35: 16851703
Gupta SA, Berkowitz GA (1987) Osmotic adjustment, symplast volume and nonstomatlly mediated water stress inhibition of photosynthesis in wheat. Plant Physiol 85: 1040-1047
Lawlor D, Cornic G (2002) Photosynthetic carbon assimilation and associated metabolism in relation to water deficits in higher plants. Plant, Cell and Environment 25: 275-294
Loyola J, Verdugo I, González E, Casaretto JA, Ruiz-Lara S (2012) Plastidic isoprenoid biosynthesis in tomato: physiological and molecular analysis in genotypes resistant and sensitive to drought stress. Plant Biology 14 (1): 149156
Masle J, Gilmore SR, Farquhar GD (2005) The ERECTA gene regulates plant transpiration efficiency in Arabidopsis. Nature 436: 866-870
MPPAT (2010) Ministerio del Poder Popular de Agricultura y Tierras, República Bolivariana de Venezuela VII Censo agrícola Nacional [En línea] En: http://censo.mat.gob.ve/. Consultado 12 diciembre de 2013
Novak FJ (1990) In vitro mutation system for crop improvement. Contribution of plant mutation breeding to crop improvement. IAEA. Vienna
Olivares EO (2005) Efecto de la sequía sobre la eficiencia fotoquímica del psii en N. dombeyi (Mirb.) Oerst. Trabajo presentado para optar al título de Licenciado en Ciencias Biológicas. Instituto de Botánica, Facultad de Ciencias, Universidad Austral de Chile. Valdivia
Ravi I, Uma S, Vagana MM, Mustafa M M (2013) Phenotyping bananas for drought resistance. Frontiers in Physiology. 4(9): 1-15
Rzigui T, De Paepe
R, Cornic G, Streb P (2013) In the mitochondrial CMSII mutant of Nicotiana
sylvestris
photosynthetic activity remains higher than in the WT under persisting mild
water stress. Plant Science 205206: 2028
Salazar, E (2014) Radiaciones ionizantes en Musa AAA para Inducción de mutaciones hacia la tolerancia a estrés hídrico. Tesis Doctoral presentada como requisito final para la obtención del grado de Doctor en Biotecnología Agrícola Mención Vegetal. Escuela Socialista de Agricultura Tropical (ESAT). Maracay
Siddique MRB, Hamid A, Islam MS (2000) Drought stress effects on water relation of wheat, Bot. Bull. Acad. Sin. 41(1): 35-39
Yong Z, Hou N, Wang Q, Yang J-T, Yang X-T, Fan W (2012) Responses of chlorophyll content and fluorescence to water stress in Vitex negundo var. Heterophylla: take hilly area of Taihang Mountain in Henan for example. International Conference on Biomedical Engineering and Biotechnology (ICBEB), pp.1656 -1659. IEEE. Macau
Recibido: 05-12-13
Aceptado: 16-07-14
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.