ARTÍCULO ORIGINAL
Biotecnología
Vegetal Vol. 14, No. 3: 163 - 168, julio - septiembre, 2014
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
Instituto de Biotecnología de las Plantas. UCLV. MES.
Efecto de la desecación sobre la germinación
de embriones somáticos de plátano cv. `FHIA-21' (Musa AAAB)
Effect of desiccation on plantain cv. `FHIA-21' (Musa AAAB) somatic embryos germination
Harol González Gallardo, Leyanis García-Águila*, Alexis Rodríguez, Blanca Pérez, Eloísa Rodríguez *Autora para correspondencia
Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas, Carretera a Camajuaní km 5.5. Santa Clara, Villa Clara. Cuba. CP 54 830. e-mail: leyanis@ibp.co.cu
RESUMEN
Los aspectos relacionados con el desarrollo del embrión somático, su maduración, germinación y conversión en plantas, son necesarios para la eficaz propagación masiva de bananos y plátanos por embriogénesis somática. Es por ello, que esta investigación tuvo como objetivo determinar el efecto de la desecación sobre la germinación de embriones somáticos de plátano cv. `FHIA-21' (Musa AAAB). Los embriones se expusieron a la desecación rápida por exposición al aire de la cabina de flujo laminar, durante 5, 10 y 15 minutos. Además, se aplicó una estrategia de desecación gradual en placas de Petri sin medio de cultivo a 4 y 27ºC, durante 48 horas. En ambos casos después de la desecación, los embriones fueron transferidos a medio de cultivo semisólido y después de 20 días se colocaron a germinar en un nuevo medio de cultivo. Después de 45 días de cultivo, se cuantificó el número de embriones germinados. Los resultados mostraron que la desecación rápida de los embriones somáticos durante 5 minutos incrementó el número de embriones germinados. De forma similar, la desecación gradual a las dos temperaturas ensayadas produjo un incremento en el número de embriones somáticos germinados.
Palabras clave: embriogénesis somática, morfología, temperatura
ABSTRACT
The aspects related to the development of somatic embryo maturation, germination and conversion in plants are necessary for effective mass propagation of bananas and plantains by somatic embryogenesis. For this reason, the aim of the paper was to determine the effect of desiccation on germination of somatic embryos of banana cv. `FHIA-21' (Musa AAAB). The embryos were exposed to rapid desiccation by exposure to air of the laminar flow cabinet for 5, 10 and 15 minutes. In addition, a gradual drying strategy applied to the embryos in Petri dishes without culture medium at 4 and 27ºC, for 48 hours. In both cases, after desiccation, the embryos were transferred to semisolid medium and after 20 days, it were placed to germinate in a new culture medium. After 45 days of culture, the number of germinated embryos were quantified. The results showed that rapid desiccation of somatic embryos for 5 minutes increased the number of germinated embryos. Similarly, both the gradual desiccation temperatures tested was an increase in the number of somatic embryos germinated.
Key works: morphology, somatic embryogenesis, temperature
INTRODUCCIÓN
En Musa spp. la propagación masiva de plantas por embriogénesis somática precisa de un gran número de embriones somáticos con altos porcentajes de conversión en plantas. Sin embargo, la asincronía, el bajo número de embriones germinados, la larga duración del periodo de tiempo para lograr su germinación y el alto grado de dependencia del genotipo se encuentran entre las principales limitantes (Suarez-Castellá et al., 2012). A pesar de ello, sigue siendo la embriogénesis somática un sistema de propagación más eficiente que la micropropagación convencional a través del cultivo de ápices meristemáticos (Remakanthan et al., 2014).
En muchas especies de plantas, el bajo número de embriones germinados se debe a su pobre desarrollo y a las condiciones de cultivo (Souza et al., 2011).
Una alternativa para mejorar la acumulación de reservas en embriones somáticos es la adquisición de tolerancia a la desecación durante el proceso de maduración (Bapat y Rao, 1992). En este sentido, se han descrito resultados satisfactorios de su uso en la regeneración de plantas por embriogénesis somática en trigo (Triticum aestivum L.) (Carman, 1988), maíz (Zea mays L.) (Wen y Song, 2007), arroz (Oryza sativa L.) (Haq et al., 2009) y caña de azúcar (Saccharum spp.) (Kaur y Gosal, 2009).
Además, se refieren otros tratamientos de estrés para incrementar las tasas de inducción, maduración y germinación de embriones somáticos entre los que se encuentran la adición de reguladores del crecimiento como el ácido abcísico (ABA), sustancias osmóticas como el polietilenglicol y la sacarosa (Lecouteux et al., 1993; Srinivas et al., 2006). Sin embargo, las referencias científicas sobre el empleo de tratamientos para incrementar el número de ES germinados en Musa spp. son escasas.
Mediante embriogénesis somática se ha logrado propagar plátano cv. `FHIA-21', no obstante, el número de embriones germinados por gramo de masa fresca es bajo (García-Águila et al., 2007). Por ello, se requiere buscar alternativas que permitan emplear este sistema de regeneración para la propagación masiva de dicho cultivar.
Teniendo en cuenta los aspectos anteriormente descritos, esta investigación tuvo como objetivo determinar el efecto de la desecación sobre la germinación de embriones somáticos de plátano cv. `FHIA-21' (Musa AAAB).
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon embriones somáticos (ES) de plátano cv. `FHIA-21' obtenidos a partir de suspensiones celulares embriogénicas de seis meses de cultivo que se colocaron en medio de cultivo propuesto por Dhed'a et al. (1991) según lo descrito por Daniels et al. (2002).
Efecto de la desecación en la germinación de los embriones somáticos
Para desecación de los embriones somáticos se ensayaron dos procedimientos: uno mediante la exposición a la corriente de aire de la cabina de flujo laminar (desecación rápida) y otro en condiciones de almacenamiento (desecación gradual).
Desecación rápida de los embriones somáticos
Los ES formados que se encontraban sobre sobre mallas de tela en el medio de cultivo propuesto por Dhed'a et al. (1991) se colocaron sobre papel de filtro estéril en platos metálicos (Figura 1) y se expusieron al aire de la cabina de flujo laminar (velocidad del aire de ~0.48 m s-1).
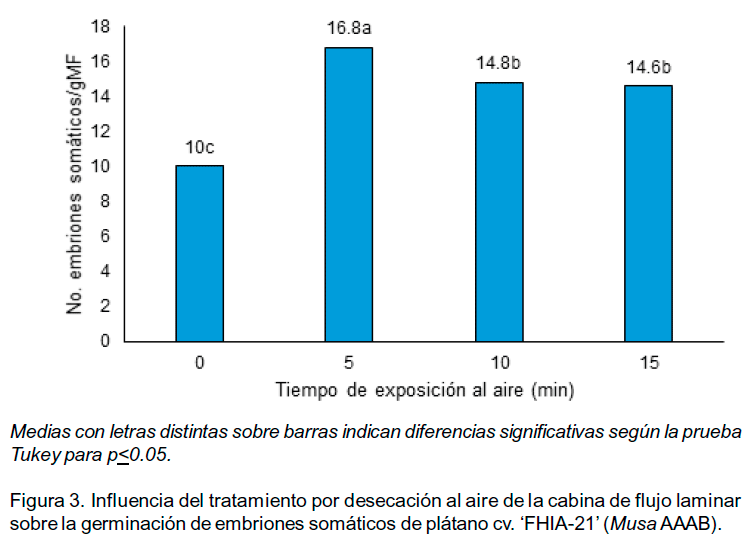
En este experimento los ES se expusieron al aire de la cabina de flujo laminar durante 5, 10 y 15 minutos (tratamientos) y como tratamiento control se emplearon ES que no se sometieron a estas condiciones.
En recipientes de cultivo de 500 ml de capacidad se colocaron 0.4 gramos de masa fresca (gMF) de ES en un medio de cultivo compuesto por el 100% de las sales propuestas por Murashige y Skoog (1962) (MS) (DUCHEFA), 0.2 mg l-1 de 6 bencilaminopurina (6-BAP), 0.5 mg l-1 de ácido indol-3-acético (AIA), 100 mg l-1 de mio-inositol, 30 g l-1 de sacarosa y 3.0 g l-1 de Gelrite®.
Cada recipiente de cultivo constituyó una réplica. Se empleó un diseño experimental completamente aleatorizado, donde se establecieron 30 réplicas por cada tratamiento.
Desecación gradual de los embriones somáticos
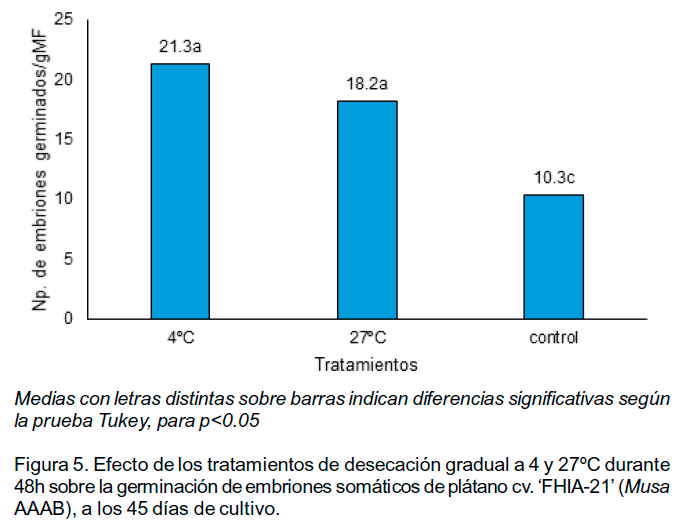
Se colocaron cuatro mallas con embriones somáticos, formados en medio de cultivo propuesto por Dhed'a et al. (1991), dentro de placas de Petri estériles de 150 mm de diámetro, sin medio de cultivo. Estas fueron selladas con Parafilm® y se ubicaron en condiciones de oscuridad total durante 48 horas a dos temperaturas (tratamientos): 4±2ºC en un refrigerador doméstico o 27±2ºC en cámara de cultivo. Como tratamiento control se utilizaron embriones somáticos que no fueron expuestos a la desecación gradual. Cada tratamiento incluyó cuatro placas de Petri.
Seguidamente, por cada tratamiento se transfirieron 0.4 gMF de los ES a recipientes de cultivo de 500 ml de capacidad con similar medio de cultivo al descrito anteriormente. Cada recipiente de cultivo constituyó una réplica. Se empleó un diseño experimental completamente aleatorizado, donde se establecieron 30 réplicas por cada tratamiento.


Los ES sometidos a ambos procedimientos de desecación permanecieron en ese medio de cultivo durante 20 días a 27±2.0ºC, en cámara de crecimiento con luz artificial (tubos fluorescentes de luz blanca) con fotoperíodo de 16 horas de luz/ 8 horas de oscuridad (densidad de flujo de fotones fotosintéticos de 62-68 µmol m-2s-1).
Posteriormente,
para lograr su germinación fueron transferidos al medio de cultivo propuesto
por Kosky et al. (2000) modificado sin Biobrás-6 y con 30 g l-1
de sacarosa. En cada recipiente de cultivo de 500 ml de capacidad se colocó
1.0 gMF de embriones somáticos y esto constituyó una réplica.
Se empleó un diseño experimental completamente
aleatorizado, donde se establecieron 30 réplicas por cada tratamiento
de los dos procedimientos utilizados. Las condiciones en la cámara de
crecimiento fueron las descritas anteriormente donde permanecieron durante 45
días. Al final de este periodo se cuantificó el número
de embriones germinados por gMF en cada tratamiento y se describieron las características
morfológicas mediante observación al microscopio estereoscópico.
El análisis estadístico se realizó con el paquete computacional Stat Graphics versión 5.0 sobre Windows. Inicialmente, se efectuó la comprobación de los supuestos de distribución normal y homogeneidad de varianzas. Los datos se analizaron por la prueba de Tukey con un nivel de significación de 0.05.
RESULTADOS
Desecación rápida de los embriones somáticos
Los embriones somáticos expuestos al aire de la cabina de flujo laminar cuando se transfirieron al medio de cultivo para su germinación mostraron cambios de coloración. Mediante observaciones al microscopio estereoscopio (aumento 60x) se apreciaron daños en la epidermis tales como hendiduras superficiales con bordes fenolizados. Además, se observaron ES necrosados y oscurecimiento del medio de cultivo como consecuencia de la exudación de compuestos fenólicos y su posterior oxidación. Estos daños no se presentaron en el tratamiento control.
Sin embargo, en todos los tratamientos se observó la presencia de embriones somáticos germinados (Figura 2) con valores superiores en el tratamiento con menor tiempo de desecación (5 minutos) (Figura 3).
Desecación gradual de los embriones somáticos
A diferencia de los resultados anteriores, los ES sometidos a desecación gradual no mostraron daños en la epidermis. Se observaron embriones con exposición de la plúmula, otros adquirieron una textura compacta de color blanco opaco y además se apreciaron embriones con apariencia translúcida asociados a la presencia de nuevos embriones debido a multiplicación secundaria (Figura 4 A, B y C). De manera general, estas características se observaron en los dos tratamientos.
El número de embriones somáticos germinados mostró un incremento, con diferencias significativas, entre los tratamientos de desecación y el control (Figura 5). A los 45 días de cultivo predominaban los embriones que solo mostraban elongación del ápice meristemático sin la extensión de las hojas en todos los tratamientos (Figura 5).
DISCUSIÓN
Los resultados mostraron que tanto por desecación rápida por el aire de la cabina de flujo laminar, como al colocar los ES en placas de Petri sin medio de cultivo, previo al subcultivo para inducir su maduración, se puede incrementar significativamente el número de ES germinados por gMF. Estos procedimientos son sencillos y podrían facilitar estrategias de manejo de los ES de plátano cv. `FHIA-21' en la propagación masiva de plantas por esta vía.
Los daños en la epidermis de los ES sometidos a desecación rápida pudieron estar ocasionados por deshidratación de las células epidérmicas por el flujo de aire continuo en la cabina de flujo laminar. En algunos casos, incluso, afectaron la viabilidad de ES en los cuales se observó necrosis. No obstante, e independientemente del tiempo de exposición, el número de ES germinados fue superior al control.
Por otra parte, la desecación gradual en placas de Petri sin medio de cultivo permitió incrementar, aproximadamente, el doble del número de ES germinados. Especialmente, el resultado con 4ºC tiene como valor adicional que sienta las bases para otros estudios que permitan conservar los ES formados por periodos de tiempo prolongados a baja temperatura.
Aunque existen pocos antecedentes en Musa spp. que aborden el uso de la desecación para la maduración y germinación de embriones somáticos, se han obtenido resultados favorables en otros cultivares. Por ejemplo, Srinivas et al. (2006) demostraron que el tratamiento combinado de ABA y desecación incrementaba el porcentaje de conversión en plantas de embriones somáticos de banano cv. `Rasthali' (Musa AAB).
Según Malabadi et al. (2004) la desecación promueve el desarrollo del embrión somático y maduración de líneas celulares embriogénicas. Los tratamientos de desecación por bajas temperaturas han sido referidos por ser beneficiosos para la embriogénesis y la regeneración de plantas en Camellia (Janeiro et al., 1995), Astragalus adsurgens Pall (Luo et al., 2003). De igual forma, la desecación se ha utilizado para promover la embriogénesis somática en diferentes especies de plantas (Corredoira et al., 2008; Haq et al., 2009; Kaur et al., 2009). Según Márquez-Martína et al. (2011), la reducida disponibilidad de agua es el factor más importante, ya que, un porcentaje bajo de humedad estimula la acumulación de hidratos de carbono, lípidos y proteínas en el cultivo de células. En los ES de plátano sometidos a los tratamientos de desecación empleados en este trabajo se observaron cambios morfológicos pero se requieren otros estudios para dilucidar las transformaciones a nivel fisiológico y bioquímico que favorecen el incremento del número de ES germinados.
CONCLUSIONES
Los tratamientos de desecación rápida por exposición al flujo de aire de la cabina de flujo laminar o gradual en placas de Petri sin medio de cultivo favorecen el incremento del número de ES germinados en plátano cv. `FHIA-21'.
REFERENCIAS
Bapat, VA, Rao PS (1992) Plantlet regeneration from encapsulated and non-encapsulated desiccated somatic embryos of a forest tree: Sandalwood (Santalum album L.). J Plant Biochem Biotechnol 6: 109-113
Corredoira E, Valladares S, Vieitez AM, Ballester A (2008) Improved germination of somatic embryos and plant recovery of European chestnut. In Vitro Cellular & Development Biology-Plant 44: 307-315
Dhed'a D, Dumortier F, Panis B, Vuylsteke D, DeLanghe (1991) Plant regeneration in cell suspension culture of the cooking banana cultivar `Bluggoe' (Musa spp. ABB group). Fruits 46: 125-135
Daniels D, Kosky R, Vega M (2002) Plant regeneration system via somatic embryogenesis in the hybrid cultivar FHIA 21 (Musa spp. AAAB). In vitro Cell. Dev. Biol. 38: 330-333
García Águila L, Gómez Kosky R, Albany NR, Vilchez JA, Alvarado Y, Reyes M (2007) Influencia de las condiciones de iluminación en la germinación de embriones somáticos del cultivar híbrido de plátano `FHIA-21'. Rev. Fac. Agron. (LUZ) 24: 679-689
Haq, IU, Xing ZC, Mukhtar Z, Jaleel CA, Azooz MM (2009) Effect of physical desiccation on plant regeneration efficiency in rice (Oryza sativa L.) variety super basmati. Journal of Plant Physiology 166: 1568-1575
Janeiro, LV, Ballester A, Vieitez AM (1995) Effect of cold storage on somatic embryogenesis systems of Camellia. Journal of Horticultural Science 70: 665-672
Kaur, A, Gosal SS (2009) Desiccation of callus enhances somatic embryogenesis and subsequent shoot regeneration in sugarcane. Indian Journal of Biotechnology 8: 332-334
Lecouteux, C, Lai F M, McKersie B D (1993) Maturation of alfalfa (Medicago sativa L.) somatic embryos by abscisic acid, sucrose and chilling stress. Plant Sci 94 207-213
Luo, JP, Jiang S, Pan LJ (2003) Cold-enhanced somatic embryogenesis in cell suspension cultures of Astragalus adsurgens Pall.: relationship with exogenous calcium during cold pre-treatment. Plant Growth Regulation 40: 171-177
Malabadi RB, Choudury H, Tandon P (2004) Initiation, maintenance and maturation of somatic embryos from thin apical dome sections in Pinus kesiya (Royle ex. Gord) promoted by partial desiccation and gellan gum. Scientia Horticulturae. 2004; 102: 449459
Márquez-Martína BR, Sesmeroa MA, Quesadab F, Alfaroc P, Sánchez-Romerob C (2011) Water relations in culture media influence maturation of avocado somatic embryos. Journal of Plant Physiology 168: 2028-2034
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15: 473-497
Remakanthan, A, Tara G, Menon EV (2014) Somatic embryogenesis in banana (Musa acuminata AAA cv. Grande Naine): effect of explant and culture conditions. In Vitro Cellular & Developmental Biology-Plant 50(1): 127-136
Souza, JMM, Tomaz ML, Arruda SCC, Demetrio CGB, Venables WN, Martinelli AP (2011) Callus sieving is effective in improving synchronization and frequency of somatic embryogenesis in Citrus sinensis. Biologia Plantarum 55: 703-707
Suárez-Castellá, M, Kosky R, Chong-Pérez B, Reyes M, García-Águila L, Sarría Z, Orellana P, Rodríguez A, Triana R, Pérez Z, González M, León M, Pérez B (2012) Estrategia de innovación tecnológica para el empleo de embriogénesis somática en medios de cultivo semisólido en Musa spp. y su impacto económico. Biotecnología Vegetal 12(1): 41-48
Srinivas L, Ganapathi TR¸ Suprasanna P, Bapat VA (2006) Desiccation and ABA treatment improves conversion of somatic embryos to plantlets in banana (Musa spp.) cv. Rasthali (AAB). Indian Journal of Biotechnology 5: 521-526
Recibido: 08-04-2014
Aceptado: 01-07-2014
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.

