RESEÑA
BIBLIOGRÁFICA
Biotecnología
Vegetal Vol. 14, No. 4: 195 - 202, octubre - diciembre, 2014
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
Instituto de Biotecnología de las Plantas. UCLV. MES.
Herramientas biotecnológicas para el combate de la raza 4 Tropical de Fusarium oxysporum f. sp. cubense en Musa spp.
Biotechnological tools against Fusarium oxysporum f. sp. cubense Tropical race 4 in Musa spp.
Idalmis Bermúdez-Caraballoso. *Autora para correspondencia
Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuní km 5.5, Santa Clara, Villa Clara. Cuba. CP 54 830. e-mail: idalmis@ibp.co.cu
RESUMEN
El Mal de Panamá causado por Fusarium oxysporum f. sp. cubense (Foc) es una de las enfermedades más nocivas que ataca a las musáceas a nivel mundial. La raza 1 causó una epifitia que destruyó la industria de exportación bananera basada en el cv. `Gros Michel' (Musa AAA) en América, así como la desaparición del cultivo comercial del cv. `Manzano' (Musa AAB) en Cuba. La raza 4 Tropical de Foc (TR4) se reconoció por primera vez en 1990 en Taiwán, donde causó serios daños en los estándares para la exportación en los cultivos del subgrupo Cavendish en varios países del Sudeste de Asia. Lo más preocupante es que más del 80% de los cultivares de banano que se producen a nivel mundial son susceptibles a esta raza, por lo que representa una amenaza potencial para los países productores de América Latina y el Caribe donde aún no ha llegado el patógeno. La presente revisión se realizó con el objetivo de presentar las posibles implicaciones de la entrada a Cuba de la raza 4 Tropical de Foc y las estrategias para prevenir futuras afectaciones ocasionadas por la enfermedad. Incluye aspectos relacionados con la sintomatología de la enfermedad, mecanismos de infección, complejidad patogénica y dispersión del patógeno así como varias herramientas biotecnológicas para el combate de la enfermedad entre las que se destacan: resistencia varietal, inductores de resistencia y el desarrollo de cultivares tolerantes.
Palabras clave: bananos, enfermedades fúngicas, Fusarium oxysporum, plátanos, resistencia varietal
ABSTRACT
Panama disease caused by Fusarium oxysporum f. sp. cubense (Foc) is one of the most damaging diseases attacking Musa worldwide. Race 1 caused an epidemic that destroyed the banana export industry based cultivar `Gros Michel' (Musa AAA) in America as well as the disappearance of commercial production of cultivar `Manzano' (Musa AAB) in Cuba. The Foc tropical race 4 (TR4) was first recognized in 1990 in Taiwan, causing serious damage to the standards for the export crops sub Cavendish group in several countries in Southeast Asia. Most troubling is that over 80% banana cultivars produced worldwide are susceptibles to this race, and thus represents a potential risk for producing countries of Latin America and the Caribbean where threat has not yet reached the pathogen. This review was conducted with the aim of presenting the possible implications of the entry into Cuba of tropical race 4 of Panama disease and strategies to prevent future damages caused by the disease. Include aspects of the symptomatology of the disease, mechanisms of infection, pathogenic complexity and dispersion of the pathogen as well as several biotechnological tools against the disease among which are: varietal resistance, resistance inducers and development of tolerant cultivars.
Key words: bananas, fungi disease, Fusarium oxysporum, plantains, varietal resistance
CONTENIDO
INTRODUCCIÓN
SINTOMATOLOGÍA DE LA ENFERMEDAD
AGENTE CAUSAL
Mecanismo de infección
Complejidad patogénica del hongo
Dispersión del patógeno
ESTRATEGIAS PARA EL COMBATE DE LA RAZA 4 TROPICAL DE Foc
Resistencia varietal en Musa spp. a Foc
Inductores de resistencia
Herramientas biotecnológicas en el desarrollo de cultivares tolerantes a Foc TR4
CONCLUSIONES
INTRODUCCIÓN
La marchitez por Fusarium o Mal de Panamá causado por Fusarium oxysporum f. sp. cubense (Foc) es una de las enfermedades más ampliamente distribuidas e históricamente importantes de los bananos y plátanos a nivel mundial. El patógeno tuvo su origen en el sudeste asiático, aunque la enfermedad había sido reconocida por primera vez en otros lugares, y ha co-evolucionado junto a las musáceas en su centro de origen (Bentley et al., 1998). Se calcula en más de 80 000 ha de cultivo del cultivar `Gros Michel' (Musa AAA) destruidos por la raza 1 entre 1890 y mediados de la década de los cincuenta del pasado siglo, solo en las grandes empresas exportadoras (Ploetz, 2005), lo que determinó su sustitución por cultivares del subgrupo Cavendish (Musa AAA).
Pérez-Vicente et al. (2009), refieren que el primer informe oficial en Cuba sobre la marchitez por Fusarium fue en 1910; sin embargo, señalaron que desde el 1915 se informó que el cultivar `Gros Michel' (AAA) y el `Manzano' (subgrupo Silk, AAB) se encontraban severamente afectados antes de 1910. Estos investigadores comentaron la existencia de antecedentes de incidencia de la enfermedad en el cultivar `Manzano' desde finales del siglo XIX.
En aquel momento, la única medida practicada para el control y manejo de la enfermedad consistía en la destrucción de las plantas afectadas y la quema de sus residuos, hasta que comenzó su sustitución paulatina por el cultivar `Robusta' (subgrupo Cavendish, Musa AAA), al que localmente se nombró Inmune por su resistencia al Mal de Panamá. A partir de la sustitución del `Gros Michel' por cultivares del subgrupo Cavendish y el cultivo masivo de cultivares de plátanos AAB, la marchitez por Foc perdió su importancia económica en Cuba, y quedó confinada a las pequeñas parcelas de agricultores y jardines de viviendas, donde Foc se mantenía sobre plantas de los cultivares `Burro Criollo' (`Bluggoe', Musa ABB) y `Manzano' (Musa AAB).
La confianza en que el Mal de Panamá no afectaría a las cultivares Cavendish fue descartada a principio de los años 90 (Ploetz, 2004; Ploetz, 2005). Nuevas plantaciones de Cavendish comenzaron a mostrar severas afectaciones en Asia Sur-Oriental, el centro de origen de los bananos. Esta fue la primera vez que el daño a los cultivares de Cavendish fue observado en las zonas tropicales en la ausencia de factores de predisposición (Ploetz, 2006).
Los cultivares del grupo Cavendish eran afectados principalmente en la región este del subtrópico (Ploetz, 1990). Por décadas, las pérdidas han ocurrido en Australia subtropical (Nuevo Gales del Sur y Queensland), las Islas Canarias y de Madeira, y Suráfrica (Natal y Transvaal). Se llegó a afirmar que los cultivares Cavendish eran afectados por la enfermedad cuando las plantas eran predispuestas, por bajas temperaturas en el subtrópico o por factores edáficos en las zonas tropicales. En suelos fértiles de las zonas tropicales occidentales los Cavendish continuaron bien por más de cuatro décadas después de substituir al `Gros Michel'. Puesto que muchos de estos suelos estaban infestados con las poblaciones de Foc que habían destruido el `Gros Michel', se pensó que Foc era incapaz de transformarse para ser virulento en el grupo Cavendish.
La primera epifitia de Foc que afectaba a plantaciones de plátano Cavendish en Taiwán fue divulgada en 1967 y la declinación de la industria comenzó en 1970 (Molina, 2009). Este autor señala, además, que los primeros informes de daños en otros países en Cavendish se originaron en Indonesia y Malasia en 1992, Australia en 1993, en el Sur de China desde 1996 y en Filipinas en 2008.
La raza 4 tropical de Foc (TR4) se reconoció por primera vez en 1990 en Taiwán. Causó serios daños en los estándares actuales para la exportación, en los cultivos del subgrupo Cavendish en varios países del Sudeste de Asia. Un brote de la enfermedad fue informado recientemente en Jordania y Mozambique, lo cual resulta una seria amenaza para su propagación hasta América Latina y el Caribe (Butler, 2013). TR4 tiene una amplia tasa de hospederos. Más del 80% de los cultivares de banano que se producen a nivel mundial son susceptibles, incluyendo el subgrupo de plátano (Musa AAB), importantes bananos de cocción AAA y ABB, y diversos tipos AA, AB, AAA, así como los bananos de postre tipo AAB (Ploetz, 2009).
Hasta el momento TR4 no ha sido informada en América, pero se especula que su llegada tendría un impacto comparable a los causados por la raza 1 en la primera mitad del siglo pasado (Dita et al., 2009).
La desaparición del `Gros Michel' en Centro América debido al Mal de Panamá, es una experiencia a seguir como alerta sobre la amenaza potencial de la TR4. Aunque se reconoce que el Foc, particularmente la TR4 es una amenaza real y significativa para la industria bananera, particularmente para el sistema de monocultivo de la industria comercial del Cavendish, la situación es ahora muy diferente comparada con la era del Mal de Panamá. Un punto principal de preocupación es la capacidad del patógeno Foc para sobrevivir en el suelo por un largo período de tiempo y la ausencia de un tratamiento efectivo para destruirlo. Hoy en día, contrario a la era de `Gros Michel', no existen en los países bananeros suficientes áreas nuevas para establecer nuevas plantaciones (OIRSA, 2009).
Por otra parte, con la aparición de la TR4 de Fusarium, que es capaz de atacar los cultivares del subgrupo Cavendish representa una seria amenaza para la industria bananera de la región, ya que casi el 100% de las exportaciones se basa en el subgrupo Cavendish. En la actualidad la TR4 de Foc con los grupos de compatibilidad vegetativa (VCG 01213-01216), se ha diseminado rápidamente en Asia-Pacífico, con fuerte impacto en la producción de Cavendish; además afecta a genotipos que representan a más del 80% de la producción de musáceas en América Latina y el Caribe. La entrada potencial de este patógeno más algunos factores que determinaron la epifitia de Raza 1 de Foc están aún presentes, por lo que su entrada en América puede tener un gran impacto económico y social para la industria de musáceas en la región (Pocasangre y Pérez-Vicente, 2009).
El presente trabajo se realizó con el objetivo de presentar una revisión de literatura científica relacionada con la amenaza potencial que representa la entrada a Cuba de la raza 4 tropical de Foc y las estrategias para prevenir futuras afectaciones ocasionadas por el patógeno. Incluye varios aspectos relacionados con la sintomatología de la enfermedad, mecanismos de infección, complejidad patogénica y dispersión del patógeno así como varias estrategias para el combate de la enfermedad.
SINTOMATOLOGÍA DE LA ENFERMEDAD
El Mal de Panamá es considerado como una enfermedad clásica de marchitamiento vascular, al causar la disrupción del sistema de translocación de agua, provocar síntomas foliares sistémicos y el colapso final de las plantas afectadas. La infección inicial ocurre cuando el patógeno invade el tejido vascular (xilema) de las plantas a través de las raíces y provoca su decoloración y marchitamiento (Ploetz, 2005).
Los síntomas típicos en las plantas afectadas se caracterizan por presentar externamente una coloración ligeramente amarillenta en las hojas más viejas de la planta, con mayor grado en los márgenes de estas, la cual se convierte en una necrosis. Se puede observar también, el desarrollo de una rajadura longitudinal de la porción más baja de las vainas foliares del pseudotallo. A medida que la enfermedad va aumentando en intensidad, las hojas más jóvenes se tornan también amarillas y mueren. Las hojas colapsan de forma gradual en la unión del pecíolo con el pseudotallo, quedando colgadas a su alrededor en forma de falda. En su interior las plantas afectadas presentan inicialmente síntomas en los vasos del xilema de las raíces y el rizoma, estos se tornan de color café rojizo a marrón a medida que el patógeno se va desarrollando a través de los tejidos, llegando a observarse también en el pseudotallo esta misma decoloración en los vasos afectados. En el caso del fruto, no se han observado síntomas típicos de la enfermedad. Es necesario mencionar que los hijuelos de banano menores de tres meses, no desarrollan síntomas visibles de marchitamiento por Foc y este es un factor que ha contribuido a la diseminación del patógeno hacia otras regiones, cuando estos materiales asintomáticos han sido utilizados como material vegetal de siembra (Sotomayor, 2012).
De acuerdo con Dita et al. (2013) no existen diferencias en la sintomatología que ocasionan las diferentes razas de Foc en Musa. Este es otro problema que se adiciona al no poder distinguir entre las razas 1 y 2 que afectan al `Gros Michel' (Musa AAA), `Manzano' (Musa AAB), `Pome' (Musa AAB), `Pisang awak' (Musa ABB) y `Bluggoe' (Musa ABB) respectivamente, de la raza 4 que afecta además al subgrupo Cavendish (Musa AAA) (Pérez Vicente et al., 2014). AGENTE CAUSAL
Mecanismo de infección
Las esporas de Foc pueden persistir en el suelo por largos períodos de tiempo, germinar y crecer en las raíces de las plantas hospederas. La infección inicial ocurre en los pelos radicales procedentes de la raíz más larga y vía cortex llega hasta los vasos del xilema (Ploetz, 2005). El micelio se ramifica y produce microconidios, los cuales germinan y penetran a través de las perforaciones del xilema, invaden los vasos cercanos y prosiguen con la infección. La planta produce geles y tilosa como un mecanismo de defensa para prevenir la infección, entran al rizoma, lo cual provoca un bloqueo y déficit en el suministro de agua a las hojas y tallos de la planta (Swarupa et al., 2014).
Complejidad patogénica del hongo
La variabilidad de las poblaciones de Foc ha sido diferenciada en base a su patogenicidad (han sido descritas tres razas de Foc que afectan Musa spp.), grupos de compatibilidad vegetativa (21 VCGs) y patrones de RFLP (nueve linajes o familias de VCG). La raza 1 afecta al `Gros Michel' y `Manzano', la raza 2, ataca más intensamente el `Bluggoe' y la raza 4 afecta al Subgrupo Cavendish, así como también a muchos otros cultivares susceptibles y resistentes a las razas 1 y 2.
Los aislados tropicales,
Cavendish-competentes pertenecen al grupo de compatibilidad vegetativa 01213-01216,
los
cuales fueron originalmente identificados en Taiwán y son ahora también
conocidos en Australia (Territorio del Norte), las islas en Indonesia (Halmahera,
Irian Jaya, Java, Sulawesi y Sumatra), y en Malasia peninsular (Ploetz, 2005).
El rol que juegan los VCG 01213-01216 en las epifitias en Taiwán no ha sido bien determinado ya que otros tres grupos existen allí, VCGs 0120-01215, 0121, y 0123. Sin embargo, el clima tropical en Taiwán y la importancia de la enfermedad en los Cavendish sugieren que VCG 01213-01216 pueda ser el más significativo. Una revisión más cercana sobre la situación respecto a la resistencia que se ha desarrollado en Taiwán en las variantes somaclonales del `Cavendish Gigante', obtenidas por cultivo de tejidos denominadas GCTCVs. Hasta la fecha, no se sabe qué VCGs predomina en el Cavendish en Taiwán, o qué VCGs impacta a las variantes somaclonales GCTCVs (Ploetz, 2006).
Las poblaciones del patógeno en Cuba corresponden a los GCV 01210 pertenecientes a la raza 1 y están presentes en `Manzano' y `Gros Michel', y los GCV 0124, 0124-0125 y 0128, corresponden a la raza 2 (Batle y Pérez, 2001) y están presentes en `Burro Criollo' (Musa ABB), `FHIA 03' (Musa AABB) y `Pisang Awak' (Musa ABB).
En un estudio reciente desarrollado en China por Fang (2013), se informa sobre el ordenamiento y análisis del genoma del hongo Fusarium oxysporum f. sp. cubense en las razas 1 y TR4. Este investigador informa del análisis comparativo de la genómica de estas dos razas de Foc con el F. oxysporum f. sp. lycopersici (Fol) y el ensayo de una lista de genes caracterizando la diferencia entre Foc raza 1 y Foc raza 4, lo cual muestra una asociación potencial con patogenicidad cultivar-específica que puede ser la base del amplio rango de hospederos de la raza 4. Se indica que en un futuro cercano se investigarán los perfiles de la expresión del transcriptoma de Foc raza 1 y Foc raza 4 antes y después de infectar las variedades de tipo Cavendish, para descubrir la base genética de la especificidad del hospedero (formas especiales) y de la especificidad del cultivar (razas patogénicas) de Foc.
Dispersión del patógeno
Fusarium oxysporum f. sp. cubense puede ser diseminado a grandes distancias a través de rizomas e hijuelos infectados, cuando son utilizados como material vegetal de siembra para el establecimiento de nuevas plantaciones. Los hijuelos infectados a menudo no exhiben síntomas de marchitamiento, son asintomáticos. De esta manera, el uso de plántulas propagadas por cultivo de tejidos provenientes de una fuente certificada, garantizará el uso de material vegetal de siembra libre de esta y otras enfermedades (Sotomayor, 2012).
El patógeno puede también ser diseminado en forma eficiente a grandes distancias, a través de suelo adherido a llantas de vehículos o zapatos. De esta manera, también existiría la posibilidad de que pueda diseminarse a cortas distancias a través de implementos y maquinarias agrícolas, entrecruzamiento de raíces y en el agua superficial. En el suelo, el patógeno tiene la capacidad de producir las clamidosporas y persistir por un tiempo mayor de 30 años. Existe también la posibilidad de que el hongo pueda sobrevivir en forma no patogénica en hospederos alternativos (malezas) (Schippers y Van Eck, 1981).
Se requieren esfuerzos coordinados entre los sistemas de sanidad vegetal, instituciones de investigación y productores para mantener la raza 4 Tropical Foc fuera de la región y preparar las condiciones para su eventual detección, limitación de la diseminación y manejo (Pocasangre y Pérez-Vicente, 2009, Pérez-Vicente et al., 2014). ESTRATEGIAS PARA EL COMBATE DE LA RAZA 4 TROPICAL DE Foc
Resistencia varietal en Musa spp. a Foc
Con el conocimiento y la tecnología disponibles, hoy es más fácil y efectivo implementar políticas cuarentenarias e impedir así la diseminación de patógenos, aunque siempre es más seguro disponer de variedades resistentes y una política varietal al respecto. La prevención exitosa del Foc TR4 y su diseminación en Australia fue efectiva debido a su fuerte voluntad política para implementar medidas cuarentenarias y a la disponibilidad de tecnologías de diagnóstico y cultivo de tejidos. En Taiwán, el cultivo anual del banano ha sido posible al usar plantas de cultivo de tejidos y ha probado ser efectiva para reducir el potencial de la enfermedad (OIRSA, 2009).
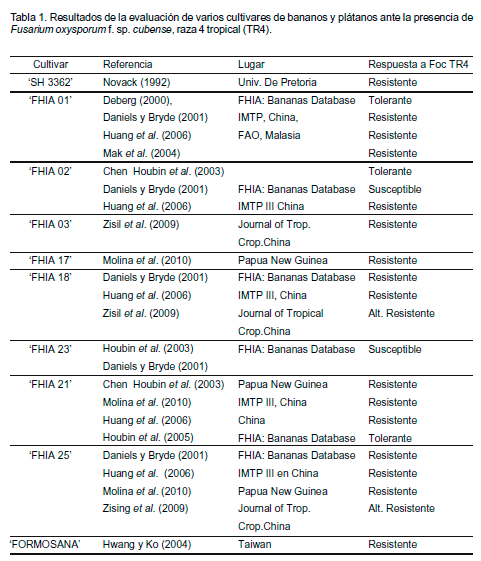
La tabla 1 muestra algunos cultivares de bananos y plátanos y las variantes somaclonales de Cavendish proporcionadas por el Instituto de Investigación del Plátano de Taiwán que son tolerantes a Foc TR4 (Huang et al., 2005).
La respuesta de resistencia en bananos está basada en la capacidad de las plantas tolerantes o resistentes para producir fenoles, depósitos de lignina y el aumento de las enzimas implicadas en la consolidación de la pared celular. Los compuestos fenólicos juegan un importante rol en los procesos de resistencia contra enfermedades vasculares, algodón (Gossypium hirsutum L.) y papa (Solanum tuberosum L.) y actúan activando las enzimas hidrolíticas del patógeno. Foc infesta tanto cultivares resistentes como tolerantes y la resistencia es solamente expresada después de iniciada la infección (Beckman, 1990).
Inductores de resistencia
En los últimos años, existe un consenso general de que la única forma de control efectiva y sostenible tanto económica como ambiental para esta enfermedad es la resistencia del hospedero (Dita et al., 2010). La aplicación de inductores de resistencia sistémica en cultivos de interés agrícola se ha convertido en los últimos años en una herramienta estratégica en el manejo de las enfermedades en los cultivos; capaz de acelerar la respuesta de defensa de la planta al ataque del patógeno; así como proporcionar una protección de larga duración, y disminuir la aplicación de plaguicidas químicos en el control de agentes causantes de enfermedades, entre otras ventajas (Shahini et al., 2010). En este sentido, se han desarrollado productos que son compatibles con el ambiente e inducen a la planta a activar sus mecanismos de defensa contra las enfermedades. Algunos de estos productos se han comercializado. Entre ellos están el acibenzolar- metil, la menadiona bisulfito de sodio, los fosfitos entre otros (Méndez et al., 2010).
Diferentes grupos de investigadores han demostrado que el producto Bion 50 SC (acibenzolar-S-metil) induce resistencia sistémica en numerosos hospedantes frente a un amplio rango de patógenos. Como ejemplos pueden citarse las interacciones siguientes: banano - Radopholus similis (Corrales et al., 2002), plátano - Mycosphaerella fijensis Morelet (Márquez et al., 2007). También en este sentido, existen reguladores de crecimiento de generación más reciente donde se destaca el grupo de jasmonatos que actúan principalmente como moléculas señalizadoras de respuestas en plantas a numerosas situaciones de estrés y promotor de defensa en plantas (Schilmiller y Howe, 2005). El ácido jasmónico demostró acciones de defensa en varias especies ante patógenos (Berrocal-Lobo y Molina, 2004). Otro ejemplo de alternativa para el control de esta enfermedad se encuentra en Cuba con el uso del biocontrol mediante Trichoderma harzianum en combinación con la plantación de plantas sanas con buenos resultados a escala comercial por tres años. Aunque los esfuerzos en este sentido han sido insuficientes, y de resultados contradictorios entre la investigación de laboratorio y el uso a nivel comercial (Pérez-Vicente et al., 2004).
Herramientas biotecnológicas en el desarrollo de cultivares tolerantes a Foc TR4
La estrategia de identificación de genes dominantes y recesivos para resistencia al marchitamiento por Fusarium y sus implicaciones en los híbridos mejorados obtenidos ha sido estudiado en varios cultivos. Marcadores del tipo SCAR asociados con resistencia a Foc TR4 fueron desarrollados por Wang et al. (2010) para banano, denominados ScaU1001 y ScaS0901, los cuales amplificaron para genotipos de banano resistentes a Foc TR4 y no en los genotipos susceptibles evaluados. La herencia para la resistencia en Musa a Foc raza 1 ha sido investigada y se ha referido que la resistencia al Marchitamiento por Fusarium en un híbrido diploide de Musa está condicionada por un simple gen recesivo denominado panama disease 1 (Pd1) que puede ser empleada como una estrategia en programas de mejoramiento por selección (Ssali et al., 2013). La identificación de marcadores del tipo SCAR y QTLs vinculados a la resistencia a Foc en su mayoría se corresponden con genes de resistencia que tienen un rol importante en el reconocimiento. Desde que la secuencia del genoma está disponible, se pueden llevar adelante estudios para caracterizar los genes involucrados en las vías y mecanismos de defensa (Swarupa et al., 2014).
Algunos híbridos de banano de consumo fresco, que han sido desarrollados por la Fundación Hondureña de Investigaciones (FHIA) a través de Programas de Mejoramiento Convencional y han demostrado ser resistentes a Foc ya están disponibles. Entre ellos `FHIA-01' (AAB Tipo Pome) y `FHIA-17' (AAAA) banano de postre del tipo `Gros Michel' que se han estado promoviendo para su cultivo a gran escala. Además, otros híbridos desarrollados por otros centros como el Instituto Internacional de Agricultura Tropical (IITA), Centro de Investigación de Agricultura de Francia de Desarrollo Internacional (CIRAD) y el Instituto Indio de Investigaciones Hortícolas (IIHR) con resistencia a Foc están disponibles (Swarupa et al., 2014).
Otra estrategia
eficiente es el uso de la variación somaclonal la cual ha sido
empleada para el mejoramiento genético de varios caracteres agronómicos.
GCTCV-218 es una variante somaclonal obtenida a partir del `Cavendish gigante'
que muestra resistencia a Foc, la cual ha sido registrada con el nombre
comercial de FORMOSOMA (Hwang, 2002). Otras variantes somaclonales del Cavendish
denominada GCTCV-53 y GCTCV-119 han mostrado resistencia al marchitamiento por
Fusarium (Hwang y Ko, 2004). Con el conocimiento de estas técnicas
se espera mejorar este cultivo mucho más rápido que por técnicas
de mejoramiento convencionales.
La mutagénesis ha sido establecida como una herramienta muy eficiente para utilizar en el mejoramiento genético de plantas (Ahloowalia et al., 2004; Henikoff et al., 2004). Sin embargo, este es un proceso complejo para emplear en plantas propagadas vegetativamente. El equipo de Jankowicz-Cieslak et al. (2012) ha desarrollado un método para el tratamiento de ápices meristemáticos en yemas de banano con un mutágeno químico, el Etil-Metano-Sulfonato (EMS) y recuperar altas densidades de mutaciones de GC-AT mostrando que el genotipo de los mutantes es estable en generaciones sucesivas. Además, cinco líneas de banano resistentes al marchitamiento por Fusarium fueron obtenidas en Brazil e identificadas por evaluaciones en campo después del tratamiento mutagénico in vitro con EMS (Chen et al., 2013). De aquí que es posible adoptar diferentes técnicas para el Mejoramiento Genético del banano y obtener resistencia a Fusarium oxysporum.
El empleo de la transgénesis es otra estrategia para el desarrollo de resistencia a hongos en cultivos económicamente importante como el banano. La mayoría de los cultivos transgénicos se han basado en el uso de proteínas antimicrobianas para bacterias y hongos (Collinge et al., 2010). Sin embargo, un intento para desarrollar cultivares genéticamente modificados resistentes a Foc se ha iniciado recientemente. Varios genes han sido utilizados para combatir este patógeno (Swarupa et al., 2014). Se han empleado defensinas de flores de petunia (Petunia hybrida) (PhDef1 y PhDef2), que han sido sobreexpresadas en plantas de banano usando
como explante suspensiones celulares embriogénicas y como sistema de transformación el empleo de Agrobacterium tumefaciens. Altos niveles de expresión constitutiva de estas defensinas en plantas élites de banano cv. `Rasthali' (Musa AAB), mostraron resistencia contra la infección de Foc en estudios tanto in vitro como in vivo (Ghag et al., 2012). En otro estudio, Mahdavi et al. (2012) demostraron la expresión de genes de taumatina de arroz (Oriza sativa L.) en plantas transgénicas de banano con resistencia a Foc TR4. Posteriormente, genes obtenidos de cebolla (Allium cepa L.), codificantes para una proteína antimicrobiana (Ace-AMP1) fueron introducidos y expresados en bananos transgénicos (Mohandas et al., 2013).
De igual forma, fueron ensayados en el cultivar de banano `Lady Finger' (AA), los genes llamados Bcl-xl, Ced-9 y Bcl-2 3' UTR. Entre estos genes, se logró la sobreexpresión del Bcl-2 3' UTR en líneas que mostraron resistencia a Foc (Paul et al., 2011). Se observó cómo característico la apoptosis en plantas hospederas contra patógenos necrotróficos, donde el patógeno provocó la muerte del tejido e incrementó su potencial de crecimiento más rápido. Se encontró que la expresión en transgénicos de genes animales relacionados con la apoptosis, tuvo una regulación negativa.
Otra estrategia que ha sido utilizada se ha basado en el RNAi usando dsRNAs de adenilato ciclasa, DNA polimerasa subunidades alfa y beta contra esporas de Foc in vitro, que ha demostrado variaciones en los grados de inhibición de la germinación de las esporas (Mumbanza et al., 2013). Esta estrategia de RNAi puede ser desarrollada para generar plantas transgénicas de banano resistentes a Foc (Swarupa et al., 2014).
La cisgénesis
puede ser otra alternativa estratégica la cual involucra el uso de genes
solamente de la misma especie o su pariente más cercano con el cual está
cruzado. La cisgénesis es un método muy eficiente para cruzar-fertilizar
plantas heterocigóticas que se propagan vegetativamente como el banano.
El mejoramiento convencional además de introducir nuevos genes se pueden
transferir rasgos no deseados. Por lo tanto, la cisgénesis puede hacer
los
cultivos genéticamente modificados más aceptables al público
(Swarupa et al., 2014).
Para proteger a los cultivos contra Foc, los investigadores han iniciado la exploración de las ventajas de la cisgénesis para transferir genes de resistencia desde bananos de cocción a bananos de postre (EFSA, 2012). Se conoce que las plantas tienen cientos de genes R (Sanseverino et al., 2010). La caracterización molecular de estos genes en diferentes especies ha revelado su especificidad, lo cual puede ser utilizado para el mejoramiento genético de cultivos a través de la cisgénesis. Especies silvestres de banano (Musa balbisiana) se han encontrado resistentes a Foc y a estreses abióticos. Los genes identificados por QTLs pueden ser compatibles con los de los cultivares existentes. Esto puede proporcionar un carácter deseable adicional como la tolerancia a estreses bióticos y abióticos. Esta última estrategia podría proteger el cultivo de banano de la marchitez por Fusarium y superar las limitaciones de las medidas de protección química (Swarupa et al., 2014).
CONCLUSIONES
Los resultados presentados en esta revisión de la literatura científica brindan información para el manejo y control de Foc TR4. Se relacionan estrategias para el combate de la enfermedad donde se incluye la resistencia varietal, el uso de inductores de resistencia así como la aplicación de herramientas biotecnológicas para la obtención de genotipos resistentes o tolerantes. Finalmente, se demuestra que una estrategia bien diseñada que tenga en cuenta el conocimiento actual de la patogenicidad, mecanismos de acción, la interacción hospedante-patógeno, la influencia del medio ambiente sobre el mismo así como el empleo de varias estrategias que incluya herramientas biotecnológicas posibilitará reducir los riesgos de las afectaciones que pudiera causar el patógeno de producirse su entrada al país por alguna vía.
REFERENCIAS
Ahloowalia, BS,
Maluszynski M, Nichterlein K (2004) Global impact of mutation-derived varieties.
Euphytica 135:187-204
Batle AL, Pérez-Vicente L (2001) Population Biology of Fusarium oxysporum
f. sp. cubense of Banana and Plantains in Cuba: Vegetative Compatibility
Groups, Abstracts of Papers. Annual Meeting APS Caribbean Division, June 11-15,
2001-Havana
Beckman, CH (1990) Host responses to infection. En: Ploetz, RC. (Ed.) Fusarium wilt of banana, pp. 93-105. APS. Minnesota
Bentley S, Pegg KG, Moore NY, Davis DR, Buddenhagen IW (1998) Genetic variation among vegetative compatibility groups of Fusarium oxysporum f. sp. cubense analyzed by DNA fingerprinting. Phytopathology 88: 1283-1293
Berrocal-Lobo, M, Molina A, Solano R (2002) Constitutive expression of ETHYLENE-RESPONSE-FACTOR1 in Arabidopsis confers resistance to several necrotrophic fungi. Plant J. 29: 23-32
Borges AA, Borges-Pérez A, Fernández-Falcón M (2004) Induced resistance to Fusarium wilt of banana by menadione sodium bisulphite treatments. Crop Protection 23: 1245-1247
Butler D (2013) Fungus threatens top banana. Nature 504: 195
Chen YF, Chen W, Huang X, Hu X, Zhao JT, Gong Q, Li XJ, Huang XL (2013) Fusarium wilt-resistant lines of Brazil banana (Musa spp., AAA) obtained by EMS-induced mutation in a microcrossection cultural system. Plant Pathol 62:112-1190
Collinge DB, Jorgesen HJ, Lund OS, Lyngkjaer MF (2010) Engineering pathogen resistance in crop plants: current trends and future. Annu Rev Phytopathol 48: 269-291
Corrales O, Knight S, Madrigal A (2002) Manejo de Sigatoka negra (Mycosphaerella fijiensis Morelet) y el nemátodo barrenador (Radopholus similis COBB) en banano, usando el activador de resistencia Boost 50 SC dentro de un programa de fitoprotección basado en menos uso de agroquímicos. XV Reunión Internacional ACORBAT, pp. 143-147. ACORBAT. Cartagena
Dita MA, Waalwijkb C, Buddenhagenc IW, Souza JM, Kema GH (2010) A molecular diagnostic for tropical race 4 of the banana Fusarium wilt pathogen. Plant Pathology 59: 348-357
Dita MA, Echegoyen PE, Pérez-Vicente L (2013) Plan de contingencia ante un brote de la raza 4 tropical de Fusarium oxysporum f. sp. cubense en un país de la región del OIRSA. Organismo Internacional Regional de Sanidad Agropecuaria OIRSA. San Salvador
EFSA (Scientific Panel on Genetically Modified Organisms) (2012) Scientific opinion addressing the safety assessment of plants developed through cisgenesis and intragenesis. EFSA J 10(2): 2561
Fernández-Falcón M, Alvarez CE, Gorrín R, Hernández MM, Borges AA (2009) Influence of a menadione derivative on banana panama disease development and yield enhancement. Open Horticulture Journal 2: 49-53
Ghag SB, Shekhawat UK, Ganapathi TR (2012) Petunia floral defensins with unique prodomains as novel candidates for development of Fusarium wilt resistance in transgenic banana plants. PLoS ONE 7(6): e39557
Henikoff S, Till BJ, Comai L (2004) TILLING. Traditional mutagenesis meets functional genomics. Plant Physiol 135: 630-636
Hwang SC (2002) FORMOSANA: a new Cavendish variety with super high yield and Fusarium wilt resistance selected by somaclonal variation. TBRI. Taipéi
Hwang SC, Ko WH (2004) Cavendish banana cultivars resistant to Fusarium wilt acquired through somacultivaral variation in Taiwan. Plant Dis 88:580-588
Huang BZ, Xu LB, Molina AB (2005) Preliminary evaluation of IMTP-III varieties and local cultivars against Fusarium wilt disease in southern China. En: Molina AB, Roa VN, Van den Bergh I, Borromeo KH (Eds.) Advancing Banana and Plantain R&D in Asia and the Pacific Vol. 13, pp.187-191. Proceedings of the 3rd BAPNET Steering Committee Meeting held in Jakarta, Indonesia, 6-9 October 2003. INIBAP. Los Baños
Jankowicz-Cieslak J, Huyhh OA, Brozynska M, Nakitandwe J, Till BJ (2012) Induction, rapid fixation and retention of mutations in vegetatively propagated banana. Plant Biotechnol J 10: 1056-1066
Mahdavi F, Sariah M, Maziah M (2012) Expression of rice thaumatin-like protein gene in transgenic banana plants enhances resistance to Fusarium wilt. Appl Biochem Biotechnol 166: 1008-1019
Márquez LJ, Zapata JC (2007) Inducción de resistencia a Sigatokas en plántulas de plátano Dominico Hartón. Agronomía 15(2): 49-57
Mohandas S, Sowmya HD, Saxena AK, Meenakshia S, Thilaka RR, Mohmood Riaz (2013) Transgenic banana cv. `Rasthali' (AAB, Silk gp) harbouring Ace-AMP1 gene imparts enhanced resistance to Fusarium oxysporum f. sp. cubense race 1. Sci Hortic 164:392-399
Molina, AB (2009) Estado de la Incidencia en Asia del marchitamiento por Raza Tropical 4 de Fusarium en el cultivo del banano. Reunión de grupos de interés sobre los riesgos de la raza Tropical 4 de Fusarium, BBTV y otras plagas de musáceas para la región del OIRSA, America Latina y el Caribe. OIRSA San Salvador
Mumbanza FM, Kiggundu A, Tusiime G, Tushemereirwe WK, Niblett C, Bailey A (2013) In vitro antifungal activity of synthetic dsRNA molecules against two pathogens of banana, Fusarium oxysporum f. sp. cubense and Mycosphaerella fijiensis. Pest Manag Sci 69:1155-1162
OIRSA (Organismo Internacional Regional de Sanidad Agropecuaria) (2009) América Latina discute programa para la protección del cultivo del banano y plátano. Mirador Agrosanitario. No. 3. Septiembre 2009. San Salvador
Paul JY, Becker DK, Dickman MB, Harding RM, Khanna HK, Dale JL (2011) Apoptosis-related genes confer resistance to Fusarium wilt in transgenic `Lady Finger' bananas. Plant Biotechnol J 9:1141-1148
Pérez-Vicente, L, Batlle A, Fonseca J, Montenegro V (2004) Reaction of FHIA hybrids and landraces cultivars to Fusarium wilt caused by Fusarium oxysporum f.sp. cubense, pp. 6-9. Abstracts of The International Congress on Banana: harnessing research to improve the livelihoods. INIVAP. Penang
Pérez-Vicente, L, Batlle AL, Chacón JB, Montenegro VM (2009) Reaction of natural and hybrids cultivars of FHIA Bananas and Plantains to Cuban Fusarium oxysporum f . sp. cubense Populations, causal agent of Fusarium Wilt or Panama Disease. Fitosanidad 13(4): 237-241
Pérez-Vicente L, Dita MR, Martínez- de la Parte E (2014) Prevention and diagnostic of Fusarium Wilt (Panama disease) of banana caused by Fusarium oxysporum f. sp. cubense Tropical Race 4 (TR4). Technical Manual. FAO. Roma
Ploetz RC (1990) Variability in Fusarium oxysporum f. sp. cubense. Can. J. Botany 68:1357-1363
Ploetz, RC (2005) Panama Disease: An Old Nemesis Rears its Ugly Head. Part 1: The Beginnings of the Banana Export Trades. Plant Health Progress. APS. Minnesota
Ploetz, RC (2006) Fusarium wilt of Banana is caused by several pathogens referred to as Fusarium oxysporum f. sp. cubense. Phytopathology 96: 653-656
Pocasangre LE, Pérez-Vicente L (2009) Impacto potencial de la entrada de la raza tropical 4 del Mal de Panamá (Fusarium oxysporum f. sp. cubense) en la industria bananera y platanera de América Latina y el Caribe. Reunión de grupos de interés sobre los riesgos de la raza tropical 4 de Fusarium, BBTV y otras plagas de musáceas para la región de OIRSA, América Latina y el Caribe. Documentos de programa y resúmenes de la reunión de OIRSA sede central. OIRSA. San Salvador
Sanseverino W, Roma G, De Simone M, Faino L, Melito S, Stupka E, Frusciante L, Ercolano MR (2010) PRGdb: a bioinformatics platform for plant resistance gene analysis. Nucleic Acids Res 38:814-821
Schilmiller AL, Howe GA (2005) Systemic signalling in the wound response. Current Opinion in Plant Biology 4 (8): 369-377
Schippers B, Van Eck WH (1981) Formation and survival of chlamydospores in Fusarium. En: Nelson Pe, Tousson TA, Cook RJ (Eds) Fusarium: disease, biology, and taxonomy, pp. 250-260. Penn State University Press. Pensylvania
Sotomayor IH (2012) La raza tropical 4 del Mal de Panamá: amenaza potencial para la industria bananera y platanera del Ecuador. Instituto Nacional Autónomo de Investigaciones Agropecuarias. Estación Experimental Tropical Pichilingue. Quevedo. Ecuador. Boletin Divulgativo 418: 42
Ssali RT, Kiggundu A, Lorenzen J, Karamura E, Tushemereirwe W, Viljoen A (2013) Inheritance of resistance to Fusarium oxysporum f. sp. cubense race 1 in bananas. Euphytica 194:425-430
Swarupa V, Ravishankar KV, Rekha A (2014) Plant defense response against Fusarium oxysporum and strategies to develop tolerant genotypes in banana. Planta 239:735-751
Wang W, Hu Y, Sun D, Staehelin C, Xin D, Xie J (2010) Identification and evaluation of two diagnostic markers linked to Fusarium wilt resistance (race 4) in banana (Musa spp.). Mol Biol Rep 39:451-459
Xiaodong Fang (2013) Genome Sequencing and Comparative Transcriptomics of Race1 and Race 4 of Banana pathogen: F. oxysporum f.sp. cubense. Banana and animal genoma, Asia Congress. Singapore
Recibido: 12-07-2014
Aceptado:
17-09-2014
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.