ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
ISSN
1609-1841, RNPS: 0397 (Versión impresa)
Efecto de la posición del brote floral masculino sobre la formación de callos y establecimiento de suspensiones celulares embriogénicas de plátano cv. `FHIA-21' (Musa AAAB)
Effect the position of the male flower bud on callus formation and embryogenic cell suspensions establishment of plantain cv. `FHIA-21' (Musa AAAB)
Leyanis García-Águila*, Zoe Sarría, Maritza Reyes, Rafael G. Kosky, Blanca Pérez, Alexis Concepción. *Autora para correspondencia.
Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas, Carretera a Camajuaní km 5.5. Santa Clara, Villa Clara. Cuba. CP 54 830. e-mail: leyanis@ibp.co.cu
RESUMEN
La fase de desarrollo fisiológico de la planta donadora se encuentra estrechamente relacionada con la respuesta embriogénica de los explantes. Es por ello, que esta investigación tuvo como objetivo determinar el efecto de la posición del brote floral masculino sobre la formación de callos y establecimiento de suspensiones celulares embriogénicas de plátano cv. `FHIA-21' (Musa AAAB). Para este estudio, se establecieron cuatro tratamientos a partir de la longitud del raquis floral de la planta donante. El primer tratamiento se correspondió con la longitud 0, posición más cercada a la última flor femenina y los tratamientos restantes a los 10, 20 y 30 cm de longitud del raquis. Posteriormente, se extrajeron un total de 490, 442, 267 y 306 flores masculinas inmaduras en cada tratamiento, respectivamente. A las 20 semanas de cultivo se cuantificó el número de callos y se caracterizaron según el desarrollo de sus estructuras embriogénicas. Además, se determinó el efecto del tipo de callo en el establecimiento de suspensiones celulares embriogénicas. Los resultados mostraron una mayor formación de callos con estructuras embriogénicas (8.77%) cuando el brote floral masculino se encontraba en la posición más cercana a la última flor femenina. Además, se precisó que callos con estructuras embriogénicas compuestas por masas de proembriones y embriones somáticos en etapas tempranas de desarrollo ontogénico proporcionaron el mayor volumen de agregados celulares sedimentados, con el establecimiento del 85.0% de las suspensiones celulares embriogénicas. Ambos aspectos son importantes para la posterior formación de embriones somáticos y obtención de plantas a través de este sistema regeneración.
Palabras clave: embriones somáticos, callo embriogénico, flores masculinas, proembriones
ABSTRACT
The somatic embryogenesis response is close linked with the development phase of the explant donor plant. Therefore, the objective of this work was to determine the effect of male flower position in the plant on the embryogenic responses in plantain cv. `FHIA-21' (Musa AAAB). In this study male flower were collected at 0, 10, 20 and 30 cm from the last female flower. After 20 weeks on culture, the number of callus with somatic structures was evaluated. Thereafter, the effect of the callus morphology in the establishment of embryogenic cell suspensions was assessed. The results showed that the development phase of immature male flower (measured by the distance to the last female flower) was an important factor on the embryogenic callus induction. The best response on embryogenic callus formation (8.77%) was obtained with explants collected just after the last female flower (0 cm). Although, it was possible to assess that 85.0% of the callus composed by pro-embryogenic masses and somatic embryos in the early stage of its ontogeny development, resulted in embryogenic cell suspensions with the major volume of settled cell aggregated. As a result, it was possible to conclude that the age of the male flower play an important role on the somatic embryogenic process in plantain cv. `FHIA-21'.
Keywords: somatic embryos, embryogenic callus, male flowers, proembryos
INTRODUCCIÓN
La embriogénesis somática es un proceso biológico que se desarrolla sobre la base de la totipotencia celular de las plantas superiores (von Arnold et al., 2002). Durante este proceso las células somáticas se diferencian en embriones somáticos, y conservan íntegramente el genotipo de la planta donante (von Arnold, 2008).
En plátanos y bananos, la inducción de la embriogénesis somática se ha efectuado a partir de diferentes tipos de explantes. Entre ellos se encuentran los embriones cigóticos inmaduros (Marroquin et al., 1993;), tejido foliar y rizoma (Novak et al., 1989), meristemos proliferantes (Strosse et al., 2004), flores masculinas inmaduras (Escalant et al., 1994; Daniels et al., 2002), flores femeninas (Grapin et al., 2000) y domos meristemáticos de brotes axilares (López et al., 2006).
La embriogénesis somática en Musa spp. se presenta de forma indirecta, inicialmente se observa la formación de un tejido desdiferenciado (callo) sobre el cual se desarrollan estructuras embriogénicas (Escalant et al., 1994). Con frecuencia, la gran mayoría de los callos son no embriogénicos y sólo un pequeño porcentaje muestran masas de proembriogénicas y embriones somáticos sobre determinadas regiones (Strosse et al., 2003). Las secciones del callo que posee estructuras embriogénicas son utilizadas en el establecimiento de suspensiones celulares embriogénicas. Hasta el momento, el bajo porcentaje de callos con estructuras embriogénicas es uno de los principales obstáculos para la regeneración de plantas por embriogénesis somática (Daniels et al., 2002; Strosse et al., 2006).
Teniendo en cuenta
que la inducción de la respuesta embriogénica está epigenéticamente
determinada por la etapa de desarrollo de la planta donadora u órganos
que se utilizan
como fuente de explante (Fehér, 2008), los estudios relacionados con
la selección del explante inicial podrían contribuir a incrementar
el porcentaje de callos con estructuras embriogénicas y con ello el establecimiento
de suspensiones celulares embriogénicas.
Con base en lo anterior, esta investigación tuvo como objetivo determinar el efecto de la posición del brote floral masculino en la planta donadora, sobre la formación de callos y establecimiento de suspensiones celulares embriogénicas de plátano cv. `FHIA-21' (Musa AAAB).
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon brotes florales masculinos colectados de plantas de plátano cv. `FHIA-21' de 10 meses de cultivo en campo.
Formación de callos con estructuras embriogénicas
Para la formación de callos con estructuras embriogénicas se establecieron cuatro tratamientos a partir de la longitud del raquis floral de la planta donante. La longitud se midió después de emitida la última flor femenina (fruto) hasta la inserción del brote floral masculino. El primer tratamiento se correspondió con la longitud 0, o sea la posición más cercada a la última flor femenina (Fig. 1 A) y los tratamientos restantes a los 10, 20 y 30 cm de longitud del raquis (Fig. 1 B). Este experimento fue repetido tres veces en el tiempo, con diseño completamente al azar.

Las condiciones de cultivos fueron en oscuridad total a 27±2.0ºC y los Erlenmeyers se colocaron en un agitador orbital (INFORS modelo HT) a 90 rpm. Se renovó un 50% del medio de cultivo cada siete días durante las primeras cuatro semanas y cada 15 días durante las siguientes semanas de cultivo (Strosse et al., 2003).
A los 10 días se efectuó el tamizado de las suspensiones celulares, con filtros de malla metálica de 500 µm de diámetro de poro (Daniels et al., 2002). En la medida que se liberaba agregados embriogénicos y ocurría su multiplicación se hicieron transferencias a Erlenmeyers de mayor capacidad siguiendo el procedimiento descrito en la Guía técnica del INIBAP para el establecimiento de suspensiones celulares de banano (Strosse et al., 2003).
Para evaluar el establecimiento de las suspensiones celulares embriogénicas, a las 4, 8, 12 y 16 semanas de cultivo se midió el volumen de células y agregados celulares embriogénicos sedimentados. Este consistió en la transferencia del contenido filtrado a tubos de ensayo cónicos estériles de 15 ml y la determinación del volumen que ocupan los agregados celulares embriogénicos después de dos minutos de sedimentación. Para la comparación de los valores correspondientes al volumen de células sedimentadas se aplicó la prueba t-Student. Además se realizaron observaciones al microscópico óptico (AXIOSKOP DP-70) para describir las características de su composición.
A los 6 meses de cultivo se cuantificó el número de suspensiones celulares embriogénicas establecidas. Se consideró como criterio de evaluación las siguientes variables: tasa de multiplicación entre 1.5 y 2.0 ml de volumen de células sedimentadas en dos semanas de cultivo (Strosse et al., 2003) y viabilidad de los agregados celulares embriogénicos superior al 80%. La vitalidad se determinó con el uso de diacetato de fluoresceína (FDA).
Para la extracción de las flores masculinas se redujo a 3.0cm de longitud el brote floral masculino para su desinfección superficial con solución de etanol al 70% (v/v), durante 15 minutos. En condiciones asépticas se extrajeron las flores masculinas con la ayuda de un microscopio estereoscópico (OLYMPUS). Un total de 490, 442, 267 y 306 flores masculinas inmaduras se utilizaron en cada uno de los cuatro tratamientos, respectivamente.
Las flores masculinas inmaduras (cinco) se colocaron en frascos de vidrio de 250 ml de capacidad sobre 30 ml del medio de cultivo propuesto por Daniels et al. (2002). Los frascos de cultivo permanecieron durante 20 semanas en oscuridad total a 27±2.0ºC.
Las evaluaciones se realizaron cada siete días con observaciones del desarrollo de las flores masculinas inmaduras hasta la formación de los callos con estructuras embriogénicas. A las 20 semanas de cultivo, se cuantificó el número de flores masculinas con respuesta embriogénica, o sea con formación de callos con estructuras embriogénicas. Los callos se clasificaron de acuerdo con las características de sus estructuras embriogénicas (masa fresca y desarrollo ontogénico de las estructuras embriogénicas). Las observaciones se realizaron con el empleo de un microscopio estereoscopio (OLYMPUS) y la masa fresca (mgMF) se determinó con una balanza analítica (SARTORIUS). Estas operaciones se efectuaron dentro de la cámara de flujo laminar.
Establecimiento de suspensiones celulares embriogénicas
El establecimiento
de las suspensiones se inició a partir de 150 mgMF de estructuras embriogénicas
procedentes de dos tipos de callos que se seleccionaron en el experimento anterior.
Se utilizaron Erlenmeyers de 25 ml de volumen total que contenían 3.0
ml de medio del cultivo líquido propuesto por Daniels et al. (2002)
para `FHIA-21', el cual estaba compuesto por sales y vitaminas de Murashige
y Skoog (1962) al 100%, 0.5 mg l-1 de biotina, 100 mg l-1
de L-glutamina, 100 mg l-1 de extracto de malta, 3.0 mg l-1
2,4-D y 45 g l-1 de sacarosa. El pH fue ajustado a
5.3 previo a los 15 minutos de esterilización. Se establecieron 10 réplicas
por cada tratamiento (tipo de callo/ Erlenmeyers).
Análisis estadístico
Para el análisis estadístico se utilizó el paquete computacional SPSS (del inglés, Statistical Package for the Social Sciences) versión 18.0 sobre Windows. A los datos experimentales se les comprobó los supuestos de distribución normal y homogeneidad de varianzas. La comparación de los valores medios correspondientes al número de callos con estructuras embriogénicas se realizó mediante la prueba de Kruskal Wallis y los valores correspondientes al establecimiento de de suspensiones celulares embriogénicas se compararon mediante la prueba Mann Whitney. Ambas pruebas se efectuaron con un nivel de significación del 0.05% y se especifican en cada experimento.
RESULTADOS Y DISCUSIÓN
Formación de callos con estructuras embriogénicas
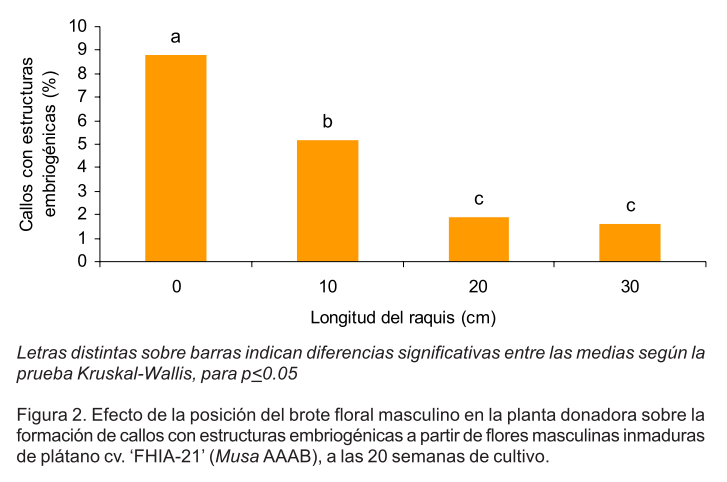
Los resultados mostraron que la selección del explante inicial, dado por la posición del brote floral masculino en la planta donadora, influyó en el número de callos con estructuras embriogénicas formados a partir de flores masculinas inmaduras. El mayor porcentaje se logró cuando las flores masculinas se extrajeron de brotes florales masculinos que se ubicaban después de emitida la última flor femenina. Con este tipo de explante se obtuvo un 8.77% de callos con estructuras embriogénicas, a las 20 semanas de cultivo, con diferencias significativas con el resto de los tratamientos evaluados (Fig 2).
Es de señalar, que cuando el brote floral masculino se encontraba a mayor distancia de la última flor femenina (10, 20 y 30 cm de longitud del raquis) se redujo la formación de callos con estructuras embriogénicas a partir de las flores masculinas inmaduras (Fig. 2). Cuando esto ocurre la edad ontogénica del brote masculino y de la planta donadora es mayor con respecto a la posición más próxima a la flor femenina. Estas diferencias en la edad ontogénica se corresponden con diferencias morfologías del brote floral masculino, por ejemplo su longitud disminuye con el aumento del eje de la inflorescencia (López, 1989).
Entre los factores asociados con la adquisición de la respuesta embriogénica se encuentran la edad y la etapa de desarrollo de la planta donadora u órganos que se utilizan como fuente de explante (Fehér, 2008). Aunque la edad ontogénica de las flores florales masculinas inmaduras es idéntica para los distintos brotes masculinos estudiados, las diferencias se encuentren en los tejidos donde se originan, lo cual pudiera estar relacionado con el contenido endógeno de fitohormonas, aminoácidos y minerales; aspectos no probados en este estudio y que podrían ser abordados en futuras investigaciones.
La composición de aminoácidos y minerales presentes en las flores masculinas fueron determinados por Sheng et al. (2010), los cuales encontraron 17 tipos de aminoácidos y un predominio en el contenido de calcio, magnesio, hierro, cobre y potasio. Sin embargo, estos resultados revelaron una amplia variación en su composición cuantitativa debido a condiciones ambientales, etapa de desarrollo de las plantas y aspectos genéticos de cada cultivar.
El nivel de fitohormonas endógenas es considerado como otro de los factores críticos que influyen en potencial embriogénico de los explantes (Jiménez, 2005). Los requerimientos de auxinas u otros reguladores del crecimiento para el inicio de la embriogénesis somática están en gran parte determinados por el nivel de desarrollo de los tejidos del explante (von Arnold, 2008).
En este estudio la iniciación de callos con estructuras embriogénicas se desarrolló de forma similar en los diferentes explantes iniciales. A las cuatro semanas de cultivo, se observó un crecimiento desordenado con la formación de estructuras globulares de color amarillo y una tonalidad marrón en la base de los explantes por la oxidación fenólica. Esta ocurre por acción de enzimas de tipo polifenoloxidasas y tirosinasas que se liberan o sintetizan cuando los tejidos sufren heridas, como las ocasionadas a los explantes durante su iniciación in vitro (Villegas et al., 2008).
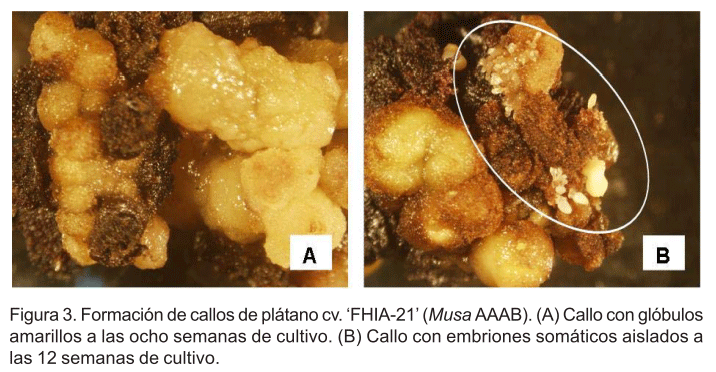
A las ocho semanas de cultivo, se observó la oxidación y muerte de los primeros tejidos desarrollados y la formación de nuevas estructuras globulares de color amarillo (Fig. 3 A). La oxidación fenólica no constituyó un factor inhibitorio en la inducción de la embriogénesis somática. Este aspecto, también fue observado por Villegas et al. (2008) donde la oxidación no afectó la formación de embriones somáticos a partir de flores masculinas inmaduras del cv. `Grande Naine' (Musa AAA).
Las primeras estructuras embriogénicas se apreciaron a las 12 semanas de cultivo sobre los glóbulos amarillos y el tejido necrótico de los explantes. Los callos con estructuras embriogénicas contenían pequeños grupos de embriones somáticos y algunos aislados (Fig. 3 B). Sin embargo, el mayor número de callos con presencia de estructuras embriogénicas se observó a las 16 y 20 semanas de cultivo (datos no mostrados).
Al finalizar el período de cultivo (20 semanas), se observó un predominio de callos no embriogénicos, donde solo se observaban glóbulos amarillos y tejidos necróticos y en menor cuantía callos con estructuras embriogénicas. Estos últimos mostraron diferencias en cuanto a la masa fresca y desarrollo de las estructuras embriogénicas. Por ejemplo, se observaron callos con menos de 150 mg de masa fresca (MF) de estructuras embriogénicas con pequeños grupos aislados de embriones somáticos y callos con más de 150 mgMF de estructuras embriogénicas, que variaron desde proembriones hasta embriones somáticos en etapas avanzadas de desarrollo ontogénico. Teniendo en cuenta las observaciones realizadas, los callos con estructuras embriogénicas se clasificaron en tres tipos (Tabla 1).
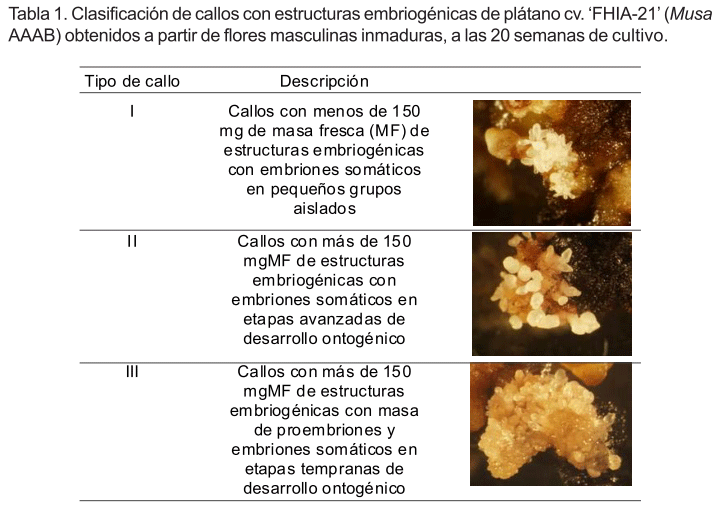
Esta clasificación tiene gran importancia para el establecimiento de suspensiones celulares embriogénicas porque podría contribuir a la eficiencia de esta fase del proceso embriogénico. Según Strosse et al. (2003), una observación cuidadosa del callo es necesaria para seleccionar callos embriogénicos donde estén en correcto equilibrio la cantidad y etapa de desarrollo de las estructuras embriogénicas.
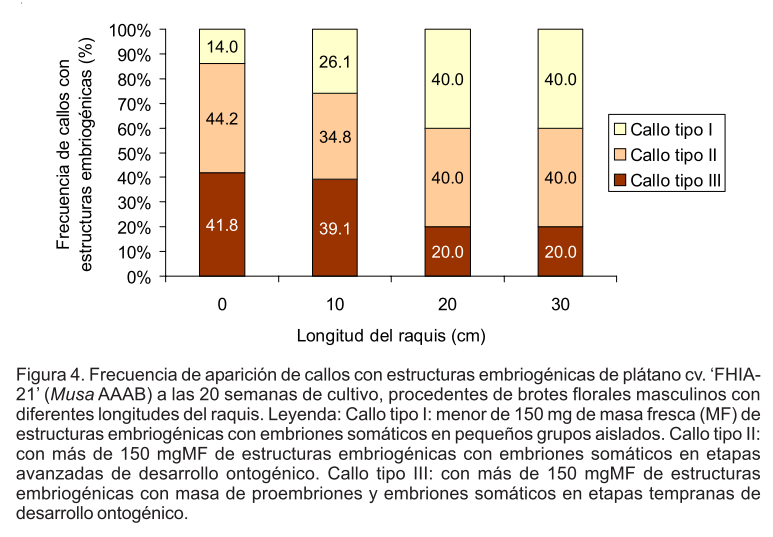
Los tres tipos de callos con estructuras embriogénicas fueron identificados en los cuatro tratamientos. Sin embargo, al analizar su frecuencia de aparición se observó en los resultados la influencia de la edad ontogénica del brote floral masculino portador de los explantes iniciales.
Cuando se emplearon flores masculinas inmaduras procedentes de los brotes florales masculinos más jóvenes (menor de 10 cm de longitud del raquis) se obtuvo una mayor frecuencia de callos de tipo II y III. Sin embargo, cuando las flores masculinas inmaduras se extrajeron de brotes florales masculinos con mayor edad ontogénica (20 y 30 cm de longitud del raquis) disminuyó la frecuencia de aparición de los callos con masas de proembriones y embriones somáticos traslúcidos en etapas tempranas de desarrollo ontogénico (tipo III) (Fig. 4).
Aunque, en plátanos y bananos, las flores masculinas y femeninas inmaduras se han convertido en los explantes más utilizados para la formación de callos con estructuras embriogénicas (Escalant et al., 1994; Grapin et al., 2000; Dai et al., 2010), el bajo porcentaje de formación de estos sigue siendo uno de los principales obstáculos para el proceso de embriogénesis somática en las musáceas.
Las investigaciones científicas se han dirigido principalmente a determinar la concentración óptima de 2,4-D en el medio de cultivo para la formación de callos con estructuras embriogénicas y se han obviado aspectos como la selección del explante inicial y las características de los callos con estructuras embriogénicas.
Por ejemplo, Escalant et al. (1994) lograron una mejor respuesta embriogénica a partir flores masculinas inmaduras del cv. `Grande Naine' (Musa AAA) cuando utilizaron una concentración de 4.0 mg l-1 de 2,4-D; pero esta no fue superior al 5.0%. Sin embargo, Grapin et al. (2000) con esta misma concentración señalaron valores de 1.9% y 2.9% en dos cultivares de plátano vianda `Curaré Enano' (AAB) y `Curaré' (AAB) respectivamente, con el empleo de flores femeninas como explante inicial.
En `FHIA-21', Daniels et al. (2002) también estudiaron el efecto de la concentración de 2,4-D y la posición de las flores masculinas en el eje floral (eligiendo el meristemo floral como posición 0) sobre la formación de callos con estructuras embriogénicas. Estos autores lograron una respuesta embriogénicas de 6.52% con 4.0 mg l-1 de 2,4-D a partir de flores masculinas situadas en la posición 5-9 y observaron una menor formación de callos con estructuras embriogénicas en las flores masculinas más diferenciadas (10-14). Al respecto, Youssef et al. (2010) sugieren que la respuesta embriogénica de flores masculinas de `Williams' (Musa AAA) y `Grande Naine' (Musa AAA) son atribuibles al estado juvenil del brote masculino y al genotipo, y no a los efectos derivados de la posición de las flores masculinas en el eje floral.
Con esta investigación, se demostró que la formación de callos con estructuras embriogénicas y la frecuencia de aparición de cada tipo de callo presentan estrecha relación con el estado juvenil del brote floral masculino de plátano cv. `FHIA-21'. Las flores masculinas inmaduras procedentes de brotes florales masculinos jóvenes originaron mayor número de callos con estructuras embriogénicas con más de 150 mgMF (tipo II y III), los cuales fueron utilizados para el establecimiento de suspensiones celulares embriogénicas.
Establecimiento de suspensiones celulares embriogénicas
Los resultados mostraron el efecto del tipo de callo con estructuras embriogénicas sobre el establecimiento de suspensiones celulares embriogénicas. El mayor volumen de agregados celulares sedimentados se logró a partir de callos con estructuras embriogénicas en etapas tempranas de desarrollo ontogénico (tipo III). Esta respuesta se observó a las 4, 8, 12 y 16 semanas de cultivo durante la fase de establecimiento de las suspensiones celulares, con diferencias significativas respecto a los callos de tipo II compuestos por embriones somáticos en etapas avanzadas de desarrollo (Tabla 2).
Acorde a los estudios histológicos realizados por Navarro et al. (1997), los callos compuestos por masas de proembriones y embriones somáticos en etapa globular se caracterizan por la presencia de células proembriogénicas y por masas de proembriones. Estas características pudieran ser la causa de la elevada liberación de agregados celulares embriogénicos, de los callos de tipo III, al medio de cultivo líquido.
Las suspensiones celulares embriogénicas obtenidas a partir de ambos tipos de callos mostraron similares características. A las cuatro semanas de cultivo presentaron una composición muy heterogénea constituida por células aisladas y pequeños agregados celulares embriogénicos. En menor cuantía se observaron células parenquimatosas. Los agregados celulares embriogénicos mostraron una forma irregular, algunos de apariencia traslúcida y otros no traslúcidos (compactos) formados por gran número de células embriogénicas en activa división (Fig. 5 A).

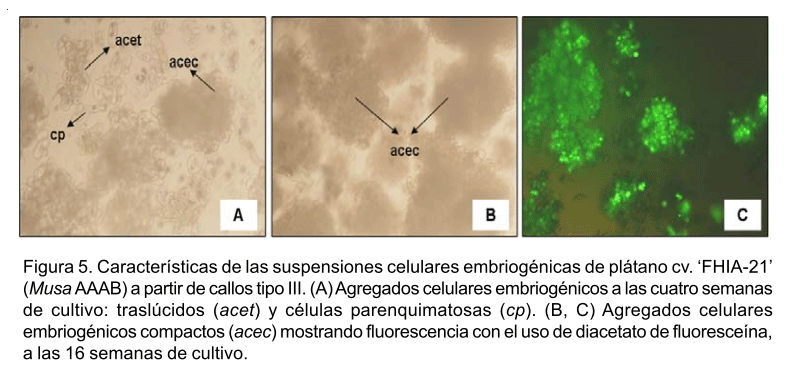
A las 16 semanas, se evidenció un predominio de agregados celulares embriogénicos compactos (Fig. 5 B) en las suspensiones celulares establecidas a partir de ambos tipos de callos. Estos agregados embriogénicos mostraron una elevada vitalidad (Fig. 5 C) con valores que oscilaron entre 87.0 y 95.0% y su diámetro varió entre 80-400 µm después del tamizado con filtros de malla metálica de 500 µm de diámetro del poro.
A los 6 meses de cultivo, el mayor número de suspensiones celulares embriogénicas establecidas se cuantificó a partir de los callos de tipo III, con diferencias significativas respecto a los callos de tipo II (Fig. 6). Estas suspensiones se caracterizaron por presentar agregados de celulares embriogénicos con rápida sedimentación (un minuto), viabilidad superior al 80.0% y una tasa de multiplicación entre 1.5 y 2.0 ml de volumen de células sedimentadas en dos semanas de cultivo, según los criterios de selección establecidos por Strosse et al. (2003).
La caracterización celular del establecimiento de suspensiones de células embriogénicas en las musáceas, ha sido descrita por diferentes autores. Por ejemplo, Escalant et al. (1994), establecieron suspensiones celulares a partir de callos obtenidos de flores masculinas de banano cv. `Grande Naine' (Musa AAA), compuestas por gran cantidad de agregados celulares y proembriones.
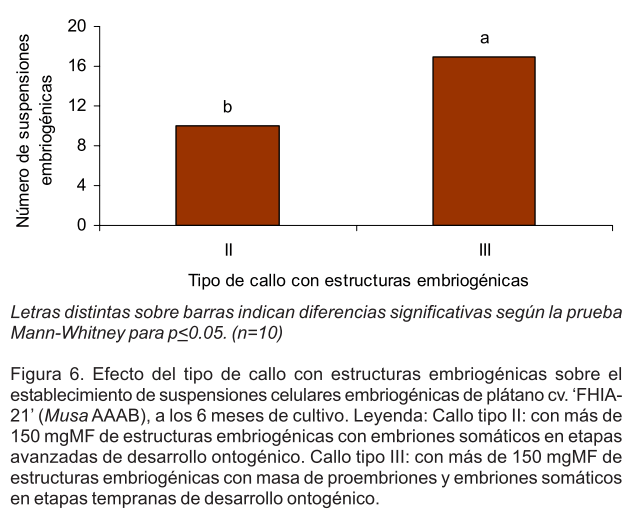
Letras distintas sobre barras indican diferencias significativas según la prueba Mann-Whitney para p<0.05. (n=10)
Figura 6. Efecto del tipo de callo con estructuras embriogénicas sobre el establecimiento de suspensiones celulares embriogénicas de plátano cv. `FHIA-21' (Musa AAAB), a los 6 meses de cultivo. Leyenda: Callo tipo II: con más de 150 mgMF de estructuras embriogénicas con embriones somáticos en etapas avanzadas de desarrollo ontogénico. Callo tipo III: con más de 150 mgMF de estructuras embriogénicas con masa de proembriones y embriones somáticos en etapas tempranas de desarrollo ontogénico.
En el cv. `FHIA-21', Daniels et al. (2002) no encontraron diferencias significativas entre cuatro concentraciones de 2,4-D utilizadas para el establecimiento de suspensiones celulares embriogénicas, lo cual indica que esta auxina no determinó el establecimiento de las suspensiones en este cultivar. Según Strosse et al. (2003), la calidad de la suspensión celular va a depender de las características de las estructuras embriogénicas del callo y del rigor con que se maneje el establecimiento del cultivo en medio de cultivo líquido.
Posteriormente, Strosse et al. (2006) formaron callos a partir de meristemos múltiples (scalps) y señalaron que el callo compuesto por proembriones y embriones en etapa globular resultó ideal para el establecimiento de una suspensión de células embriogénicas. Estos resultados coinciden con los obtenidos en este estudio. Sin embargo, es de destacar que en el cv. `FHIA-21' ambos tipos de callos liberaron agregados de células al medio de cultivo y se logró formar un 50.0% de suspensiones celulares embriogénicas a partir de callos de tipo II compuestos por embriones somáticos en etapas avanzadas de desarrollo, lo cual no fue descrito por Strosse et al. (2006).
CONCLUSIONES
En este estudio se demostró la influencia de la posición del brote floral masculino sobre la formación de callos y establecimiento de suspensiones celulares embriogénicas en el cultivar de plátano `FHIA-21' (AAAB). En este sentido, las flores masculinas inmaduras procedentes de los brotes masculinos más jóvenes con menor longitud del raquis presentaron mayor formación de callos con estructuras embriogénicas que las procedentes de brotes masculinos con mayor periodo de permanencia en la planta donante. Por otra parte, la caracterización morfológica de los callos con estructuras embriogénicas fue especialmente importante para el establecimiento de suspensiones celulares embriogénicas. Se precisó que los callos compuestos por proembriones y embriones somáticos en etapas tempranas de desarrollo proporcionaron el mayor porcentaje de suspensiones celulares embriogénicas (85.0%). Aspectos importantes para la posterior formación de embriones somáticos y obtención de plantas por este sistema de regeneración.
AGRADECIMIENTOS
Los autores agradecen a la Dr.C. Yelenys Alvarado-Capó por la revisión del manuscrito y a la Dr.C. Novisel Veitía por su colaboración en el análisis estadístico de los datos. Esta investigación fue apoyada por el Ministerio de Ciencia Tecnología y Medio Ambiente de Cuba a través del proyecto `Aplicación de la embriogénesis somática como una vía alternativa para la propagación masiva del cultivar de plátano vianda `FHIA-21' (Musa AAAB)'.
REFERENCIAS
Dai, XM, Xiao W, Huang X, Zhao JT, Chen YF, Huang X (2010) Plant regeneration from embryogenic cell suspensions and protoplasts of dessert banana cv. `Da Jiao' (Musa paradisiacal ABB Linn.) via somatic embryogenesis. In Vitro Cell. Dev. Biol-Plant. 46(5): 403-410
Daniels, D, Kosky R, Vega M (2002) Plant regeneration system via somatic embryogenesis in the hibrid cultivar FHIA 21 (Musa spp. AAAB group). In Vitro Cell. Dev. Biol-Plant. 38: 330-333
Escalant, JV, Teisson C, Cote F (1994) Amplified somatic embryogenesis from male flowers of triploid banana and plantain cultivars (Musa spp.). In Vitro Cell Dev. Biol-Plant 30:181-186
Fehér, A (2008) The initiation phase of somatic embryogenesis: what we know and what we don't. Acta Biologica Szegediensis 52(1): 53-56
Grapin, A, Ortíz JL, Lescot T, Ferrière N, Côte FX (2000) Recovery and regeneration of embryogenic cultures from female owers of False Horn Plantain. Plant Cell, Tissue and Organ Culture 61: 237-244
Jiménez, V (2005) Involvement of plant hormones and plant growth regulators on in vitro somatic embriogénesis. Plant Growth Regulation 47: 91-110
López, ZM (1989) El plátano. Editorial Pueblo y Educación, pp 6-18. La Habana
López, J, Kosky R, Trujillo R, Montano N, Reinaldo D, Raya A (2006) Metodología para el desarrollo de la embriogénesis somática en el cultivar de plátano vianda Navolean (Musa spp., Grupo AAB). Biotecnología Vegetal 6(3): 155-163
Marroquin, CG, Paduscheck C, Escalant JV, Teisson C (1993) Somatic embryogenesis and plant regeneration through cell suspensions in Musa acuminate. In vitro Cell. Dev. Biol-Plant 29: 43-46
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant 15: 473-497
Navarro, C, Escobedo RM, Mayo A (1997) In vitro plant regeneration from embryogenic cultures of a diploid and a triploid, Cavendish banana. Plant Cell, Tissue and Organ Culture 51: 17-25
Novak, FJ, Afza R, Duren M, Perea DM, Conger BV, Tang X (1989) Somatic embryogenesis and plant regeneration in suspension cultures of dessert (AA and AAA) and cooking (ABB) bananas (Musa spp.). Bio Technology 7: 154-159
Sheng, ZW, Ma WH, Jin ZQ, Bi Y, Sun ZG, Dou HT, Gao JH, Li JY, Han LN (2010) Investigation of dietary fiber, protein, vitamin E and other nutritional compounds of banana flower of two cultivars grown in China. African Journal of Biotechnology 9 (25): 3888-3895
Strosse, H, Domergue R, Panis B, Escalant JV, Côte F (2003) Suspensiones de células embriogénicas de bananos y plátanos. Guias técnicas INIBAP. 8: 6-6
Strosse, H, Van den Hauwe I, Panis B (2004) Banana cell and tissue culture - review. En: Jain, SM, Swennen R (Eds). Banana Improvement: Cellular, Molecular Biology and Induced Mutations. pp 1-12. Science Publishers, Inc., Enfield, NH, USA
Strosse, H, Schoofs H, Panis B, Andre E, Reyniers K, Swennen R (2006) Development of embryogenic cell suspensions from shoot meristematic tissue in bananas and plantains (Musa spp). Plant Sci. 170:104-112
Villegas, F, Jiménez C, Vilchez J, Moreno M, Sandoval L, Colmenares M (2008) Oxidación en la inducción de la embriogénesis somática a partir de flores masculinas inmaduras de Gran Enano (Musa AAA). Rev. Fac. Agron. 25(3): 21-28
von Arnold, S, Sabala I, Bozhkov P, Dyachok J, Filonova L (2002) Developmental pathways of somatic embryogenesis. Plant Cell, Tissue and Organ Culture 69: 233-249
von Arnold, S (2008) Somatic embryogenesis. En: George EF, Hall MA, De Klerkl GJ (Eds) Plant Propagation by Tissue Culture, pp 335-354. 3rd Edition, Springer. Doldrecht
Youssef, M, James A, Mayo-Mosqueda A, Ku-Cauich JR, Grijalva-Arango R, Escobedo-GM RM (2010) Influence of genotype and age of explants source on the capacity for somatic embryogenesis of two Cavendish banana cultivars (Musa acuminata Colla, AAA). African Journal of Biotechnology 9(15): 2216-2223
Recibido: 17-10-2012
Aceptado: 23-11-2012
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
