ARTÍCULO ORIGINAL
Biotecnología
Vegetal Vol. 15, No. 1: 35 - 45, enero - marzo, 2015
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
Instituto de Biotecnología de las Plantas. UCLV. MES.
Efecto de la densidad de inóculo y la renovación
de la atmósfera gaseosa en el cultivo de brotes de Digitalis purpurea
L. en Sistemas de Inmersión Temporal
Effect of inoculum density and gaseous atmosphere renovation in Digitalis purpurea L. shoots culture in Temporary Immersion Systems
Naivy Pérez-Alonso1, Alina Capote 1, Anabel Pérez 1, André Gerth2, Borys Chong-Pérez1, Elio Jiménez3 *Autor para correspondencia
1Instituto
de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las
Villas, Carretera a Camajuaní km 5.5. Santa Clara, Villa Clara, Cuba
2VITA
34 AG. Deutscher Platz 5a D-04103 Leipzig, Germany
3Present address: Tropical Research and Education Center, Institute of Food and Agricultural Sciences, University of Florida, 18905 SW 280th Street, Homestead, FL 33031, USA
RESUMEN
Digitalis purpurea L. es una de las dos únicas especies de interés económico del género Digitalis. Su importancia radica en que constituye una de las principales fuentes de cardenólidos, fármacos irreemplazables en el tratamiento de la insuficiencia cardíaca. El presente trabajo se realizó con el objetivo de determinar el efecto de la densidad de inóculo y la renovación de la atmósfera gaseosa en sistemas de inmersión temporal (SIT) en Digitalis purpurea L. Para su cumplimiento, se estudiaron diferentes densidades de inóculo (6, 12, 18 explantes por SIT) en la producción de biomasa así como el uso de la ventilación forzada. La mayor producción de biomasa por SIT (104.03 gMF y 5.74 gMS) se obtuvo cuando se inocularon 12 explantes. Mientras, la menor densidad de inóculo produjo un efecto negativo en el desarrollo de los explantes y no hubo incremento de biomasa. Por su parte, la renovación de la atmósfera mediante la ventilación forzada indujo un mayor estrés oxidativo asociado a un aumento de la síntesis de digitoxina. Tanto la densidad de inóculo como la ventilación forzada son factores de gran importancia en el cultivo en sistemas de inmersión temporal ya sea para la producción de biomasa como para la obtención de metabolitos secundarios en plantas de interés.
Palabras clave: cardenólidos, medios líquidos, metabolitos secundarios, ventilación forzada
ABSTRACT
Digitalis purpurea L. is one of the two unique species of economic interest in the genus Digitalis. It is important because is one of the principal source of cardenolides, irreplaceable drugs in the treatment of heart failure. The present work was done with the objective to determinate the effect of inoculum density and gaseous atmosphere renovation in D. purpurea plants cultivated in Temporal Immersion Systems (TIS). To do this, several parameters like inoculums density (6, 12, 18 explants per TIS) and the use forced ventilation were studied. The highest biomass production was obtained when 12 explants were inoculated (104.03 gFW and 5.74 gDW). On the contrary, the lower inoculum density caused a negative effect in plant development and the biomass did not increase. On the other hand, the renovation of atmosphere mediated by forced ventilation induced a higher oxidative stress associated to an increase of digitoxin synthesis. Both factors are of great importance for biomass and secondary metabolites production in plants with pharmaceutical interest.
Keywords: cardenolides, forced ventilation, liquid medium, secondary metabolites
INTRODUCCIÓN
Las plantas son consideradas una fuente valiosa para la producción de compuestos de interés farmacéutico. Entre ellas se destacan como fuente de cardenólidos las pertenecientes al género Digitalis, siendo Digitalis purpurea L. una de las dos únicas especies de interés económico de dicho género (Sales et al., 2011). Estos compuestos son relevantes para la industria farmacéutica, principalmente en el tratamiento de la insuficiencia cardíaca. Las enfermedades cardiovasculares constituyen la segunda causa de muerte en varios países, incluido Cuba. Además, en los últimos años se han descrito también sus efectos en el control del cáncer de riñón, de próstata y leucemia (Elbaz et al., 2012).
El proceso de síntesis química es inviable por los altos costos y la complejidad estructural de los cardenólidos por lo que las plantas de dicho género constituyen la única fuente comercial de estos compuestos (Sales et al., 2011). En Cuba, la planta no se cultiva por lo que se importa la materia prima para la elaboración de los fármacos proveniente de plantas de Digitalis cultivadas en países productores.
En este caso, las estrategias se han visto restringidas al cultivo in vitro y el aumento de la productividad de las plantas. Es por ello que se realizan estudios con este fin y ofrecer alternativas a la producción en condiciones naturales la cual presenta limitantes considerables. Estas se enmarcan en la variación ambiental que provoca cambios en la calidad de las plantas y la fluctuación y heterogeneidad de las sustancias activas (Roca-Pérez et al., 2004).
En consecuencia, el desarrollo de la biotecnología para la obtención de compuestos activos comprende dos pasos cruciales según Wang et al. (2012). Uno de ellos, es el desarrollo de métodos eficientes para la producción de biomasa que permitan obtener grandes cantidades de materia prima en cortos períodos de tiempo, en espacios reducidos y al menor costo posible. Es en este contexto, los sistemas de inmersión temporal (SIT) juegan un papel fundamental debido a la facilidad de escalado y el incremento de la eficiencia biológica, ventajas que se describen en la literatura científica (Pérez-Alonso et al., 2012; Schumann et al., 2012). El segundo paso es lograr una concentración elevada del compuesto de interés en la biomasa producida. Esta pudiera lograrse con la activación transitoria de las rutas que regulan la biosíntesis de dichos compuestos mediante la variación de las condiciones de cultivo entre otras variantes.
La densidad de
inóculo así como la renovación de la atmósfera gaseosa,
son factores que podrían contribuir a lograr un incremento de la biomasa
de Digitalis purpurea y en
consecuencia de las concentraciones de digoxina y la digitoxina, cardenólidos
de interés. En la literatura científica, pocos son los trabajos
que refieren el efecto de estos factores en los SIT, sin embargo se consideran
de relevante importancia. En D. purpurea no se describe hasta la fecha
el efecto de estos factores en la producción de biomasa y cardenólidos,
el cual constituye el objetivo de la investigación realizada.
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon plantas in vitro de Digitalis purpurea L. var. `Rotter Berggold' propagadas según (Pérez-Alonso et al., 2009) entre el cuarto y séptimo subcultivo. Las hojas y raíces de estas fueron cortadas. Los brotes con una longitud aproximada de 2.0 cm fueron utilizados como inóculo.
Para el desarrollo de los experimentos, se empleó el medio de cultivo compuesto por las sales inorgánicas propuestas por Murashige y Skoog (1962), 4.0 mg l-1 de tiamina, 100 mg l-1 de mio-inositol, 30 g l-1 de sacarosa con 0.5 µM de ácido indolacético (AIA) y 4.4 µM de 6-bencilaminopurina (6-BAP). El pH de los medios de cultivo fue ajustado a 5.7 antes de la esterilización, con KOH 0.5 N y HCl 0.5 N.
Los brotes se cultivaron en cámara de crecimiento con un fotoperíodo de 16 h con lámparas fluorescentes de luz blanca, con una intensidad de flujo de fotones fotosintéticos de 40 µmol m-2 s-1 y ocho horas de oscuridad, a 27±2 ºC.
Cada SIT estuvo conformado por dos frascos de vidrio de 1000 ml de capacidad, según describe Jiménez et al. (1999). Se añadieron 250 ml de medio de cultivo anteriormente descrito por SIT y en cada experimento fueron inoculados cuatro SIT por tratamiento.
Efecto de la densidad de inóculo
El objetivo de este experimento fue determinar el efecto de la densidad de inóculo sobre el desarrollo morfo-fisiológico de los brotes y por consiguiente en la producción de biomasa en los SIT. Para ello, se evaluaron tres densidades de inóculo: 6, 12 y 18 brotes por SIT. Antes de la inoculación se determinó la masa fresca (g) correspondiente a cada densidad de inóculo. Las inmersiones se realizaron cada cuatro horas con dos minutos de duración teniendo en cuenta estudios previos descritos por Pérez-Alonso et al. (2009).
A los 28 días de cultivo se cosechó la biomasa producida. Se evaluaron la altura (cm) y el número de brotes como indicadores morfológicos de crecimiento. La biomasa producida se evaluó mediante la masa fresca, expresada en gramos de masa fresca (gMF) y masa seca, expresada en gramos de masa seca (gMS), por frasco de cultivo referido por Pérez-Alonso et al. (2009). El cálculo del contenido de agua (%) se realizó según describe Bandyopadhyay et al. (2004).
Además, los brotes fueron individualizados y clasificados en brotes hiperhídricos o normales según su aspecto morfológico. Se consideraron como brotes hiperhídricos aquellos que presentaron apariencia turgente, translúcidos y que se quiebran fácilmente en comparación con los brotes normales. Para determinar el color de los brotes se utilizó el código hexadecimal de colores (http://www.cwp.linet.edu/cwis/cwp.html).
Efecto de la renovación de la atmósfera
Este experimento se desarrolló con el objetivo de determinar el efecto de la renovación de la atmósfera gaseosa en los SIT sobre la producción de biomasa y de cardenólidos. Se tuvieron en cuenta los resultados obtenidos en cuanto a la densidad de inóculo así como estudios previos descritos por Pérez-Alonso et al. (2009).
Los recipientes de cultivo que contenían los explantes fueron aireados de forma periódica (dos veces) durante un minuto en los intervalos entre cada inmersión para un total de 12 aireaciones adicionales. El diseño de los SIT no se modificó, solo se programó el canal de entrada de aire a este recipiente y se tuvieron en cuenta las posibilidades del temporizador para la programación. Como control se empleó igual frecuencia (cada 4h) sin aireaciones adicionales.
Además de las variables morfológicas y de producción de biomasa descritas anteriormente, se determinó la dinámica de producción de biomasa durante el cultivo mediante el monitoreo de la masa fresca por SIT, para lo cual se pesó el frasco de cultivo de los brotes previo a la inoculación. Este valor fue restado al peso total del frasco con los explantes cada siete días.
Previo a la inoculación en los SIT, los brotes se pesaron para conocer la masa fresca (g) inicial. Se determinó el contenido de los cardenólidos (digoxina y digitoxina) mediante HPLC, se expresó en µg gMS-1 y se calculó la producción neta de cardenólidos (µg de cardenólidos por SIT) teniendo en cuenta la masa seca obtenida por SIT. El protocolo de extracción y cuantificación de cardenólidos fue el propuesto por Wichtl et al. (1982) con algunas modificaciones referidas por Pérez-Alonso et al. (2009).
Como marcadores de estrés oxidativo se determinaron los niveles de peróxido de hidrógeno (H2O2) y malondialdehído (MDA). Los primeros fueron determinados según el método descrito por Sergiev et al. (1997). El contenido de H2O2 fue calculado mediante una curva de calibración realizada a partir de concentraciones conocidas de peróxido de hidrógeno. La peroxidación lipídica fue estimada mediante la determinación de los niveles de malondialdehído (MDA) en las hojas a través de la reacción del ácido tiobarbitúrico (SIGMA) (Sivanesan et al., 2011).
Procesamiento estadístico
Para el análisis estadístico de los datos experimentales se utilizó el programa SPSS ver. 18.0, para el sistema operativo Windows. Se aplicaron análisis no paramétricos en todos los datos puesto que no cumplieron los supuestos de normalidad y homogeneidad de varianza. Se realizó la prueba de Kruskal-Wallis para p<0.05 de significación y las diferencias estadísticas entre los tratamientos fueron determinadas mediante la prueba de Mann Whitney con la penalización de Bonferroni.
RESULTADOS Y DISCUSIÓN
Los resultados mostraron que la densidad de inóculo tuvo efecto en el desarrollo morfo-fisiológico de los brotes y la biomasa obtenida por SIT (Tabla 1). Las plántulas obtenidas en el tratamiento con 12 explantes (aproximadamente 20 ml de medio de cultivo por explante) alcanzaron una mayor altura (10.93 cm) y un mayor número de brotes por explante (5.85).
De igual manera, en este tratamiento se obtuvieron los mayores valores en la masa fresca y masa seca por SIT y un menor contenido de agua en la biomasa producida por SIT respecto al tratamiento con una densidad de inóculo de 18 explantes. Todos estos factores indicaron una mayor calidad de las plántulas obtenidas en el tratamiento con 12 explantes. El incremento de la producción de biomasa como índice biológico está directamente relacionado con la disponibilidad de nutrientes, la cual está influenciada por el volumen de medio de cultivo por explante (Gárate y Bonilla, 2008).
En el tratamiento con menor densidad de inóculo (6 explantes/SIT) se observaron los menores valores en las variables evaluadas y en los brotes se apreciaron afectaciones morfológicas a los 28 días de cultivo (Figura 1).
La densidad de inóculo como variable tiene su fundamento en la cantidad de volumen de medio de cultivo disponible por explante, además del espacio físico para su desarrollo. Es posible que el poco desarrollo morfo-fisiológico y la afectación en los explantes sea debido a un insuficiente inóculo, influenciado a su vez por la disponibilidad del medio de cultivo (aproximadamente 40 ml disponibles por explante) y el ambiente in vitro. Estos factores, según Piqueras y Debergh (1999), influyen directamente en el desarrollo de los brotes y los procesos morfo-genéticos.
En el tratamiento con 18 explantes por SIT (aproximadamente 13 ml de medio de cultivo por explante) hubo una reducción considerable del valor de la masa seca (2.57 g), con el mayor contenido de agua en la biomasa producida (97.1%). En este tratamiento pudo haber una mayor competencia por los nutrientes lo que afectó los valores de masa fresca y masa seca. Además, esta reducción de la masa seca en el tratamiento con 18 explantes puede estar asociada a la presencia de brotes hiperhídricos (20.15%), valor que difiere significativamente con el porcentaje de brotes hiperhídricos obtenidos en las densidades menores.
La figura 2 muestra la morfología de los brotes normales con hojas verdes (código hex: #008000) expandidas y los hiperhídricos obtenidos en el tratamiento con 18 explantes. En las densidades de inóculo de 12 y 18 explantes/SIT, el 100% de los brotes normales desarrollaron raíces.
La hiperhidricidad descrita como severos desórdenes fisiológicos y anatómicos (Ivanova y Van Staden, 2011) se caracteriza por la presencia de grandes cantidades de agua residual en los espacios apoplásticos de los tejidos. Las hojas y los tallos de los brotes hiperhídricos muestran una apariencia turgente y superficie acuosa, sus órganos son translúcidos y se quiebran con facilidad (Savio et al., 2012). Según Kevers et al. (2004), la hiperhidricidad implica problemas de diferenciación celular, por lo que los brotes no pueden tener un desarrollo morfo-fisiológico normal. Este fenómeno aunque no ha sido dilucidado completamente se describe como un desorden multicausal (Quiala et al., 2012) pero que en las condiciones experimentales pudo ser resultado de una mayor concentración de etileno en la atmósfera interna. Preil (2005) refiere que los brotes de especies dicotiledóneas tienden a ser más hiperhídricos cuando las densidades de inóculo son altas en los cultivos en medios líquidos.
Hasta el momento, varias investigaciones refieren el empleo de los SIT en la producción de biomasa en especies de interés medicinal (Schumann et al., 2012). Sin embargo, a pesar de que la densidad de inóculo es una variable básica para establecer métodos de cultivo en SIT, existe limitada información acerca de su efecto sobre la proliferación y calidad de los brotes.
Schumann et al. (2012) describen la influencia de diferentes factores, entre ellos la densidad de inóculo en la producción de biomasa en brotes de Leucojum aestivum L. en sistemas de inmersión temporal. En su investigación refieren resultados muy similares donde el incremento de biomasa varió en dependencia de la densidad de inóculo. Los autores obtuvieron el mayor coeficiente de multiplicación (6,09) en SIT de 1,0 l con una densidad de 10 gMF y una reducción con la menor densidad de inóculo pero no refieren una explicación al fenómeno.
Contrario a los pocos ejemplos relacionados con el estudio de la densidad de inóculo en el cultivo de órganos en plantas de interés farmacológico, la literatura científica refleja investigaciones en los procesos de micropropagación de diferentes especies en medios de cultivo líquidos.
Al respecto, Hahn y Paek (2005) indicaron que la evaluación de este factor incrementó la eficiencia de multiplicación pues es posible obtener un gran número de propágulos al mismo tiempo. Sus investigaciones se desarrollaron en el cultivo de brotes de Dendranthema grandiflorum Kitam en biorreactores de 10 l de capacidad y observaron que en las etapas iniciales la multiplicación de brotes se incrementó en el tratamiento donde se empleó la mayor densidad (80 explantes). Sivakumar et al. (2005) en el cultivo de brotes de Chrysanthemum grandiflorum L. en biorreactores compararon diferentes densidades de inóculo en el crecimiento y la calidad de las plantas. En su investigación obtuvieron el menor desarrollo de los brotes y de la biomasa con la menor densidad de inóculo, pero no encontraron una explicación a este resultado.
El estrés que sufren las plantas durante el cultivo in vitro es posible controlarlo potencialmente mediante la manipulación de los parámetros de cultivo (Cassells y Curry, 2001). De esta afirmación se deriva el especial interés en el estudio de la densidad de inóculo en el desarrollo de métodos para la producción de biomasa. Además, el manejo de la densidad de explantes, nos permite, según Jiménez (2005), definir el aprovechamiento del volumen del frasco de cultivo, así como la capacidad productiva en las cámaras de crecimiento.
A partir de los resultados obtenidos, se definió como densidad de inóculo 12 explantes para la multiplicación de brotes de D. purpurea que servirá de base para futuras investigaciones.
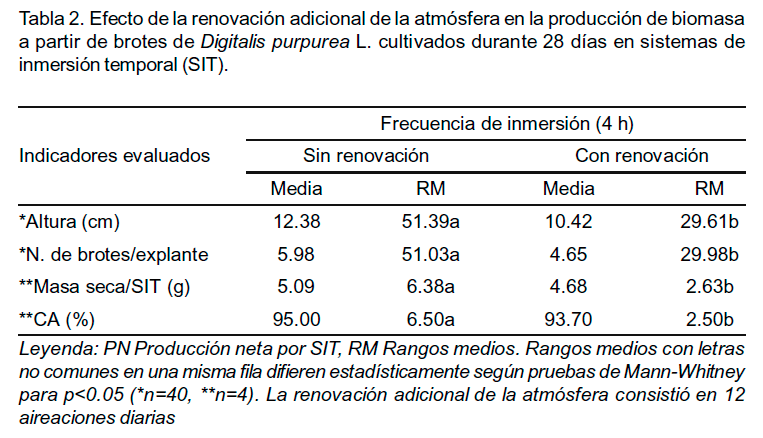
Efecto de la renovación de la atmósfera
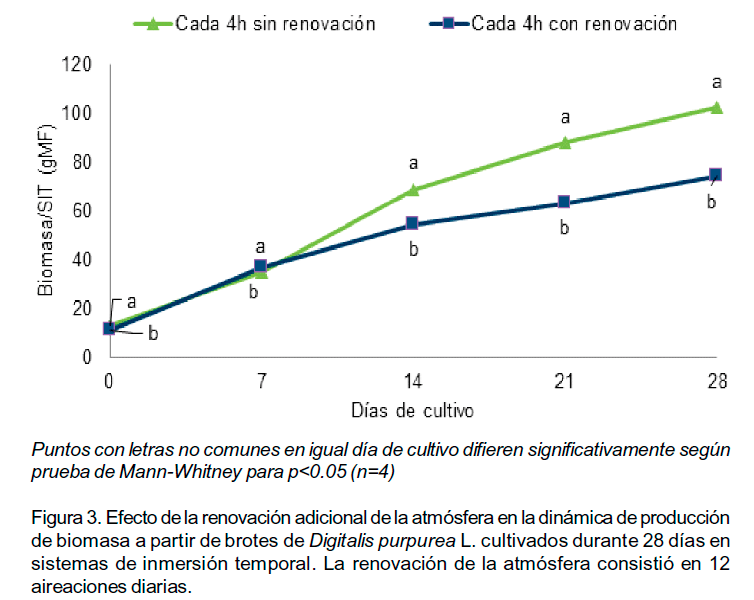
La renovación adicional de la atmósfera, la cual consistió en 12 aireaciones diarias, provocó una reducción significativa en las variables evaluadas (Tabla 2). Durante los primeros siete días (Figura 3) se observó un incremento similar de biomasa en ambos tratamientos y a los 14 días se determinó un menor crecimiento en el tratamiento con renovación adicional. En ambos tratamientos la presencia de brotes hiperhídricos fue baja y los valores no difirieron significativamente (2,0 y 3,25 brotes por SIT con y sin renovación adicional respectivamente) por lo que no representó una variable importante.
La ventilación forzada es una estrategia que puede tenerse en cuenta para incrementar la producción de biomasa y la obtención de metabolitos secundarios, pues influye en la asimilación de nutrientes, eliminación de gases como son el etileno y el CO2, los cuales pueden llegar a ser tóxicos y la renovación de la atmósfera interna del frasco de cultivo (Mohamed y Ibrahim, 2012). Estos aspectos aplicados a los resultados obtenidos pudieran parecer contradictorios; sin embargo, una mayor ventilación debido a la renovación adicional de la atmósfera interna mediante 12 aireaciones diarias pudo ser excesiva e inhibir el desarrollo de la biomasa en los SIT.
En ambos tratamientos debido al principio de funcionamiento de los SIT ya existe una renovación de la atmósfera que reduce la humedad relativa dentro del frasco (Berthouly y Etienne, 2005) y las concentraciones de CO2 recobran los valores de concentración ambiental en el momento de la inmersión (Roels et al., 2006). Estas condiciones ambientales pudieron ser suficientes para el desarrollo de la biomasa de D. purpurea como se corrobora en el tratamiento con inmersiones cada 4h (control). Sin embargo, una renovación adicional elevada de 12 aireaciones diarias pudo favorecer la transpiración excesiva y de esta manera afectar la producción de la masa fresca y seca.
Mills et al. (2004) en la multiplicación de brotes de Simmondsia chinensis (Link) C. K. Schneid describen resultados similares por una elevada ventilación. Además, coinciden con resultados obtenidos por Mohamed y Ibrahim (2012) en el cultivo de Ruta graveolens donde una elevada ventilación afectó negativamente el crecimiento y desarrollo de las plantas.
De igual manera, coinciden con los informados por Ziv (2000) quienes refirieron que una elevada aireación redujo el desarrollo de la biomasa de Dianthus caryophyllus L. En este mismo cultivo pero en condiciones estáticas Fal et al. (2002) describieron que un incremento en la ventilación provocó un aumento en la desecación, la cual de acuerdo con estos autores pudiera ser la causa principal de la disminución de la biomasa de D. purpurea. Otra hipótesis señalada por Sallanon y Maziere (1992) que justificaría esta reducción del crecimiento, pudiera ser que la evaporación del medio de cultivo conduce a una concentración de las sales e induce estrés en las plántulas y como consecuencia el crecimiento es menos vigoroso.
Los cultivos con ventilación forzada favorecen el normal desarrollo morfológico y fisiológico de las plantas (Park et al., 2004). A diferencia de estos sistemas de cultivo estáticos descritos donde la ventilación ha sido favorable, en los SIT, existe un intercambio gaseoso y una ventilación de la atmósfera interna como ya se ha explicado con anterioridad. Por tanto, los resultados demostraron que la renovación adicional, al menos con 12 aireaciones diarias que fue la estudiada, no mejoró las condiciones de cultivo creadas en los SIT para la producción de biomasa.
La renovación adicional también influyó en el contenido de cardenólidos. La digoxina no se detectó en el tratamiento con renovación adicional, mientras que el contenido de digitoxina se incrementó hasta 111.0 µg gMS-1 (Figura 4A). Los cardenólidos están constituidos por una genina o aglicona y una secuencia de moléculas de azúcares generalmente raros (Kreis y Müller-Uri, 2013). En Digitalis, la diferencia entre sus geninas (serie A la más común, serie C mayor importancia) está en el grupo OH que tiene la digoxina en el carbono 12, mientras que la digitoxina tiene un grupo hidrógeno. Es probable que los cambios en la atmósfera gaseosa debido a la ventilación forzada pudo afectar fenómenos como la hidroxilación, tal como sucede con elicitores abióticos y bióticos descritos por Pérez-Alonso et al. (2014). Según Yücesan (2011) se desconoce cuáles variaciones encontradas en las series A y C son determinadas genéticamente o cuáles pueden ser causadas por factores ambientales o externos.
Se observó un incremento en el contenido de ambos marcadores de estrés oxidativo en el tratamiento con renovación de la atmósfera, donde también se manifestó un aumento de la concentración de digitoxina (Figura 4B). La biosíntesis de metabolitos secundarios puede asociarse con la respuesta de defensa de las plantas cuando son sometidas a condiciones de estrés. Entre las respuestas bioquímicas tempranas de la planta, está la generación de las especies reactivas de oxígeno. En el tratamiento sin renovación adicional, el contenido de peróxido de hidrógeno fue muy bajo y se obtuvo un incremento de su contenido en los brotes desarrollados bajo el efecto de la renovación adicional de la atmósfera. En células vegetales, el estrés oxidativo se origina por una descompensación entre la tasa de formación de especies reactivas de oxígeno (EROs) y la capacidad defensiva antioxidante. Por otra parte, en el proceso metabólico de las EROs, el MDA es un marcador apropiado de la peroxidación lipídica (Wu et al., 2009). Su incremento en el tratamiento con renovación adicional de la atmósfera indica según Niknam et al. (2011) un daño oxidativo bajo condiciones de estrés.
Los resultados hasta aquí descritos indicaron que la renovación adicional de la atmósfera gaseosa en los SIT provocó cambios notables en el contenido de cardenólidos, específicamente en la digitoxina. Los contenidos de H2O2 y MDA fueron superiores, lo que corrobora que un incremento en la frecuencia de renovación de la atmósfera indujo un mayor estrés oxidativo en los brotes asociado a un aumento en la síntesis de digitoxina.
En la literatura científica se describen algunos estudios que relacionan la biosíntesis de metabolitos secundarios con el estrés oxidativo. Al respecto, Chong et al. (2004) refieren que los mayores niveles de antraquinonas en el cultivo de suspensiones celulares de Morinda elliptica L. podrían estar asociados con un incremento en los niveles de H2O2.
La biosíntesis
de metabolitos secundarios está regida por procesos de gran complejidad,
la interacción de las rutas en la red metabólica, los mecanismos
de transporte, compartimentación y almacenamiento, las enzimas complejas
así como la inhibición de reacciones y la regulación de
los procesos.
Desafortunadamente, los mecanismos de producción de cardenólidos
en plantas del género Digitalis no han sido elucidados completamente
y es necesario profundizar en su estudio. Es posible especular sobre el efecto
de las condiciones ambientales en aspectos básicos aun cuando no existen
evidencias que confirmen los posibles mecanismos en los que influyen directamente.
Estas pueden estar relacionadas con afectaciones en el metabolismo primario
que modulan la expresión de moléculas del metabolismo primario
involucrado en el transporte a vacuolas donde se almacenan dichos metabolitos,
limiten o favorezcan precursores de la ruta del ácido mevalónico
descrita como ruta de biosíntesis de cardenólidos (Kreis y Müller-Uri,
2013).
Los resultados apuntan a que posiblemente el estrés asociado a la renovación adicional de la atmósfera alteró la localización o la solubilidad de las enzimas y provocara una activación en las enzimas específicas que regulan la síntesis de la digitoxina en detrimento de aquellas que rigen la síntesis de la digoxina, la cual no fue detectada en las muestras analizadas. Esto por supuesto es un tema que debe ser objeto de futuras investigaciones, las que contribuirán a un mayor conocimiento de las rutas biosintéticas.
REFERENCIAS
Bandyopadhyay T, Gangopadhyay G, Poddar R, Mukherjee K (2004) Trichomes their diversity, distribution and density in acclimatization of Teak (Tectona grandis L.) plants grown in vitro. Plant Cell Tiss Organ Cult 78:113-121
Berthouly M, Etienne H (2005) Temporary immersion system: a new concept for use liquid medium in mass propagation. En: Hvoslef-Eide AK, Preil W (Eds) Liquid culture systems for in vitro plant propagation, pp 165-195. Springer. Dordrecht
Cassells AC, Curry RF (2001) Oxidative stress and physiological, epigenetic and genetic variability in plant tissue culture: implications for micropropagators and genetic engineers. Plant Cell Tiss Organ Cult 64:145-157
Chong TM, Abdullah MA, Fadzillah NM, Lai OM, Lajis NH (2004) Anthraquinones production, hydrogen peroxide level and antioxidant vitamins in Morinda elliptica cell suspension cultures from intermediary and production medium strategies. Plant Cell Rep 22:951-958
Elbaz HA, Stueckle TA, Wang HL, O'Doherty GA, Lowry DT, Sargent LM, Wang L, Dinu CZ, Rojanasakul Y (2012) Digitoxin and a synthetic monosaccharide analog inhibit cell viability in lung cancer cells. Toxicol Appl Pharmacol 258:5160
Fal MA, Majada JP, Sánchez Tamés R (2002) Physical environment in non-ventilated culture vessels affects in vitro growth and morphogenesis of several cultivars of Dianthus caryophyllus L. In Vitro Cell Dev Biol-Plant 38:589-594
Gárate A, Bonilla I (2008) Nutrición mineral y producción vegetal. En: Azcón-Bieto J, Talón M. Fundamentos de fisiología vegetal, pp. 143-164. Mc Graw Hill Interamericana. Madrid
Hahn EJ, Paek KY (2005) Multiplication of Chrysanthemum shoots in bioreactors as affected by culture method and inoculation density of single node stems. En: Hvoslef-Eide AK, Preil W (Eds) Liquid culture systems for in vitro plant propagation, pp. 143-153. Springer. Dordrecht.
Ivanova M, Van Staden J (2011) Inûuence of gelling agent and cytokinins on the control of hyperhydricity in Aloe polyphylla. Plant Cell Tiss Organ Cult 104:13-21
Jiménez E (2005) Mass propagation of tropical crops in temporary immersion systems. En: Hvoslef-Eide AK, Preil W (Eds) Liquid culture systems for in vitro plant propagation, pp. 197-211. Springer. Dordrecht.
Jiménez E, Pérez-Alonso N, de Feria M, Barbón R, Capote A, Chávez M, Quiala E, Pérez JC (1999) Improved production of potato microtubers using a temporary immersion system. Plant Cell Tiss Organ Cult 59:19-23
Kevers C, Franck T, Strasser RJ, Dommes J, Gaspar T (2004) Hyperhydricity of micropropagated shoots: a typically stress-induced change of physiological state. Plant Cell Tiss Organ Cult 77:181-191
Kreis W, Müller-Uri F (2013) Cardenolide aglycone formation in Digitalis. En: Bach TJ y Rohmer M (Eds) Isoprenoid synthesis in plants and microorganisms: new concepts and experimental approaches, pp. 425-438. Springer Science+Business Media. New York.
Mills D, Yanqing Z, Benzioni A (2004) Improvement of jojoba shoot multiplication in vitro by ventilation. In Vitro Cell Dev Biol Plant 40:396-402
Mohamed MAH, Ibrahim T (2012) Enhanced in vitro production of Ruta graveolens L. coumarins and rutin by mannitol and ventilation. Plant Cell Tiss Organ Cult 111:335-343
Murashige, T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco cultures. Physiol. Plant. 15: 473497
Niknam V, Meratan AA, Ghaffari SM (2011) The effect of salt stress on lipid peroxidation and antioxidative enzymes in callus of two Acanthophyllum species. In Vitro Cell Dev Biol-Plant 47:297-308
Park SW, Jeon JH, Kim SH, Park YM, Aswath C, Joung H (2004) Effect of sealed and vented gaseous microenvironment on hyperhydricity of potato shoots in vitro. Sci Hort 99:199-205
Pérez-Alonso N, Capote A, Gerth A, Jiménez E (2012) Increased cardenolides production by elicitation of Digitalis lanata shoots cultured in temporary immersion systems. Plant Cell Tissue Organ Cult 110:153162
Pérez-Alonso, N, Wilken D, Gerth A, Jahn A, Nitzsche HM, Kerns G, Capote-Pérez A, Jiménez EA (2009) Cardiotonic glycosides from biomass of Digitalis purpurea L. cultured in temporary immersion systems. Plant Cell Tiss Organ Cult 99: 151156
Pérez-Alonso N, Arana Labrada F, Capote A, Pérez A, Sosa R, Mollineda A, Jiménez E (2014)
Estimulación de la producción de cardenólidos en brotes de Digitalis purpurea L. cultivados in vitro mediante la adición de elicitores. Revista colombiana de Biotecnología XVI (1): 51-61
Piqueras A, Debergh P (1999) Morphogenesis in micropropagation. En: Soh WY, Bhojwani SS (Eds.). Morphogenesis in plant tissue cultures, pp. 443-462 Kluwer Academic Publishers. Dordrecht.
Preil W (2005) General introduction: a personal reflection on the use of liquid media for in vitro culture. En: Hvoslef-Eide AK, Preil W (Eds) Liquid culture systems for in vitro plant propagation, pp. 1-8. Springer. Dordrecht.
Quiala E, Cañal MJ, Meijón M, Rodríguez R, Chávez M, Valledor L, de Feria M, Barbón R (2012) Morphological and physiological responses of proliferating shoots of teak to temporary immersion and BA treatments. Plant Cell Tiss Organ Cult 109:223-234
Roca-Pérez L, Boluda R, Gavidia I, Pérez-Bermúdez P (2004) Seasonal cardenolide production and Dop5br gene expression in natural populations of Digitalis obscura. Phytochemistry 65:1869-1878
Roels S, Noceda C, Escalona M, Sandoval J, Canal MJ, Rodriguez R, Debergh P (2006) The effect of headspace renewal in a temporary immersion bioreactor on plantain (Musa AAB) shoot proliferation and quality. Plant Cell Tiss Organ Cult 84: 155163
Sales E, Frieder M, Nebauer SG, Segura J, Kreis W, Arrillaga I (2011) Digitalis. En: C Kole (Ed.) Wild Crop Relatives: Genomic and Breeding Resources, Plantation and Ornamental Crops, pp. 73-111. Springer-Verlag Berlin Heidelber. Berlin
Sallanon H, Maziere Y (1992) Inûuence of growth room and vessel humidity on the in vitro development of rose plants. Plant Cell Tiss Organ Cult 30:121-125
Savio LEB, Astarita LV, Santarém ER (2012) Secondary metabolism in micropropagated Hypericum perforatum L. grown in non-aerated liquid medium. Plant Cell, Tissue and Organ Culture 108(3): 465-472
Schumann A, Berkov S, Claus D, Gerth A, Bastida J, Codina C (2012) Production of galanthamine by Leucojum aestivum shoots grown in different bioreactor systems. Appl Biochem Biotechnol 167: 19071920
Sergiev I, Alexieva V, Karanov E (1997) Effect of spermine, atrazine and combination between them on some endogenous protective systems and stress markers in plants. CR Acad Bulg Sci 51:121-124
Sivakumar G, Kim SJ, Hahn EJ, Paek KY (2005) Optimizing environmental factors for large-scale multiplication of Chrysanthemum (Chrysanthemum grandiflorum) in balloon-type bioreactor culture. In Vitro Cell Dev Biol-Plant 41:822-825
Sivanesan I, Song JY, Hwang SJ, Jeong BR (2011) Micropropagation of Cotoneaster wilsonii Nakai-a rare endemic ornamental plant. Plant Cell Tiss Organ Cult 105:55-63
Wang J, Gao WY, Zhang J, Zuo BM, Zhang LM, Huang LQ (2012) Production of ginsenoside and polysaccharide by two-stage cultivation of Panax quinquefolium L. cells. In Vitro Cell Dev Biol-Plant 48:107-112
Wichtl M, Mangkudidjojo M, Wichtl-Bleier W (1982) Hochleistungs-ûüssigkeits-chromatographische analyse von digitalis-blattext-rakten. J Chromatogr 234:503-508
Wu Z, Chen LJ, Long YJ (2009) Analysis of ultrastructure and reactive oxygen species of hyperhydric garlic (Allium sativum L.) shoots. In Vitro Cell Dev Biol Plant 45:483-490
Yücesan B (2011) In vitro propagation and cardiac glycoside production in endemic Digitalis L. species de Anatolia. Thesis submitted to the graduate school of natural and applied sciences of the Abant Izzet Baysal University, Turkey.
Ziv M (2000) Bioreactor technology for plant micropropagation. Hortic Rev 24:1-30
Recibido:
Aceptado:
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.