ARTÍCULO ORIGINAL
ISSN 2074-8647,
RNPS: 2154 (Versión electrónica)
ISSN 1609-1841, RNPS: 0397 (Versión impresa)
Cuantificación del crecimiento in vitro de Mycosphaerella fijiensis mediante lecturas de absorbancia
Quantification of Mycosphaerella fijiensis in vitro growth by absorbance readings
Mileidy Cruz-Martín, Mayra Acosta-Suárez1 , Eilyn Mena1, Berkis Roque1, Michel Leiva-Mora1, Tatiana Pichardo1, Rosa del Pilar Castro1,2, Yelenys Alvarado-Capó1
1Instituto
de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las
Villas. Carretera a Camajuaní km 5.5. Santa Clara. Villa Clara. Cuba.
CP 54 830
e-mail: mileidy@ibp.co.cu
2Facultad
de Recursos Naturales. Departamento de Fitopatología. Escuela Superior
Politécnica de Chimborazo. Panamericana Sur km 1 ½. Riobamba. Ecuador.
CP 06-01-4703
RESUMEN
El crecimiento lento de Mycosphaerella fijiensis Morelet en medios de cultivo sintéticos y semi-sintéticos así como las características de sus colonias hacen que el uso de los métodos tradicionales de evaluación del crecimiento fúngic o sean inadecuados y poco factibles. Por ello, se requiere de un método que permita cuantificar su crecimiento en volúmenes reducidos de sustancias y en cortos periodos de tiempo. El objetivo de este trabajo fue cuantificar el crecimiento de M. fijiensis a través lecturas de absorbancia, en el tiempo, de suspensiones miceliales obtenidas de cultivos en medio líquido. Se comparó la masa seca del micelio de este patógeno crecido en medio de cultivo líquido en frascos de 250 ml de capacidad y la absorbancia en placas de 96 pocillos. Similar procedimiento se empleó para evaluar el efecto de filtrados de cultivo bacterianos con actividad antifúngica in vitro frente a M. fijiensis. Se encontró una relación lineal entre la absorbancia a 595 nm del crecimiento fúngico en medio de cultivo líquido con respecto a la masa seca. Mediante lecturas de absorbancia en placas de 96 pocillos fue posible cuantificar el crecimiento de suspensiones miceliales M. fijiensis en medio de cultivo líquido. Además, pudo ser aplicado para evaluar la inhibición del crecimiento del patógeno por filtrados de cultivo bacterianos con resultados a las 48 h de incubación.
Palabras clave: actividad antifúngica, biomasa, DO595
ABSTRACT
The slow growth of Mycosphaerella fijiensis Morelet in synthetic and semi-synthetic media as well as the characteristics of their colonies makes the use of traditional methods for evaluating the fungal growth are inadequate and impractical. Therefore, it requires a method to quantify growth in small volumes of substance and in short periods of time. The aim of this study was to quantify the M. fijiensis growth, through absorbance readings on the time, of mycelial suspensions obtained from cultures in liquid medium. Mycelial dry weight of the pathogen grown in liquid culture in flasks of 250 ml capacity and the absorbance in 96 well plates was compared. Similar procedure was used to evaluate the effect of bacterial culture filtrates with in vitro antifungal activity against M. fijiensis. A linear relationship between absorbance at 595 nm of fungal growth in liquid culture medium with respect to the dry mass was found. Absorbance readings using 96-well plates were possible to quantify the M. fijiensis mycelial suspensions growth in liquid culture. Also, there may be applied to assess the growth inhibition of the pathogen for bacterial culture filtrates with results at 48 h incubation.
Key words: antifungal activity assay, biomass, DO595
INTRODUCCIÓN
Como medida del crecimiento fúngico se han empleado diferentes método entre los que se destacan: medida del crecimiento radial de las colonias (Hernández-Castillo et al., 2008), determinación de la masa seca del micelio y la lectura de la turbidez mediante absorbancia (Broekaert et al., 1990). Sin embargo, una de las características distintivas de Mycosphaerella fijiensis Morelet, principal patógeno foliar de plátanos y bananos (Musa spp.), es su crecimiento lento en medios de cultivo sintéticos y semi-sintéticos. Además, las colonias son compactas, elevadas y pequeñas (Meredith y Lawrence, 1969; Manzo et al., 2001) (Figura 1A). Esto implica una desventaja en los estudios de interacción planta pa tógeno donde se requiere de producción de inóculo del hongo o en ensayos relacionados con la actividad antifúngica ya sea de controles biológicos, nuevos productos químicos o de evaluación de la resistencia del patógeno. Esto ha llevado a la búsqueda de alternativas para el uso de estructuras de reproducción del patógeno y otros métodos para su cultivo.
Por ejemplo, se ha empleado la descarga de ascosporas de hojas con síntomas del patógeno y mediante la inhibición del crecimiento del tubo germinativo se puede monitorear la resistencia a fungicidas químicos (Chin et al., 2001, Pérez et al., 2009). Sin embargo, este método es laborioso, se contamina con otros microorganismos fácilmente, depende de la colecta adecuada de los síntomas y de su disponibilidad. Para este fin se han empleado también conidios (Essis et al., 2010), pero la producción in vitro de estos depende de la cepa y de las condiciones de incubación. Igualmente, se ha utilizado la medición del diámetro de las colonias para evaluar la inhibición del crecimiento fúngico (Mosquera et al., 2009) pero esto se dificulta por las características del crecimiento in vitro del patógeno descritas anteriormente y se requieren entre 15 y 20 días para mostrar los resultados. Por ello, contar con un método de evaluación del crecimiento de la biomasa de M. fijiensis que sea adecuado, ya sea para la caracterización de aislados (producción de biomasa) o la evaluación de nuevos fungicidas químicos o de naturaleza biológica y que permita mostrar resultados en menor tiempo y confiables, contribuiría al desarrollo de los estudios de interacción planta-patógeno y de nuevas estrategias de control.
Peláez et al. (2006) propusieron un método para determinar la sensibilidad de aislados de M. fijiensis frente a varios fungicidas a partir de la lectura de absorbancia a DO 595 nm. Estos autores utilizaron como inóculo fragmentos de micelio obtenidos de colonias de 12-15 días de crecidas en medio de cultivo Agar papa dextrosa, sin embargo, los resultados se obtenían a partir de los 12 días de cultivo. El utilizar colonias como inóculo y el tiempo que requiere para su evaluación son aspectos que pudieran mejorarse para que pueda ser utilizado en diferentes aplicaciones.
Teniendo en cuenta lo an teriorme nte planteado, este trabajo se propuso cuantificar el crecimiento de M. fijiensis a través lecturas de absorbancia en el tiempo de suspensiones miceliales obtenidas de cultivos en medio líquido.
Además, los resultados se compararon con el incremento de la masa seca de suspensiones miceliales crecidas en similar medio de cultivo y se comprobó la factibilidad del empleo de este método para la evacuación de la actividad antifúngica de filtrados de cultivo bacterianos.
MATERIALES Y MÉTODOS
El aislado de M. fijiensis empleado fue el CCIBP-Pf-83 perteneciente a la Colección de Cultivos Microbianos del IBP. La suspensión micelial se obtuvo a partir de un cultivo del patógeno en Caldo Papa Dextrosa (PDB) (BioCen) incubado durante 15 días en agitación a 120 rpm y 28oC. Esta se homogeneizó en batidora (Ultraturrax T25), durante 1 min con medio de cultivo PDB y se filtró por tamiz de 40.0 ìm.
Se inocularon 250 ìl de una suspensión micelial de M. fijiensis (aprox. 5.0 x 105 fragmentos de micelio ml-1) en placas estériles de 96 pocillos. Posteriormente, se incubaron a 28ºC y oscuridad.
Las mediciones del crecimiento de M. fijiensis se realizaron a los tres, cinco, siete y diez días de incubación. Los valores de absorbancia a 595 nm del crecimiento de M. fijiensis en placas de 96 pocillos, fueron obtenidos mediante un espectrofotómetro.
Simultáneamente se inocularon Erlenmeyer (250 ml de volumen) con 100 ml medio de cultivo PDB, con una suspensión micelial de M. fijiensis a igual concentración. Los frascos se colocaron en zaranda orbital a 28ºC y 120 rpm. A los a los tres, cinco, siete y diez días de incubación se determinó el incremento de la biomasa fúngica mediante la masa seca (g). Para ello, se eliminó el medio de cultivo por filtración y el micelio se secó en estufa a 60ºC, hasta obtener masa constante.
Se realizaron tres repeticiones para cada método y se graficó el incremento de la biomasa fúngica en función del tiempo. Seguidamente, se determinó la correspondencia entre los resultados del incremento de la biomasa mediante ambos métodos a través de un análisis de regresión lineal según lo propuesto por Broekaert et al. (1990).
Finalmente, se aplicaron los resultados para la evaluación de la actividad antifúngica de un filtrado de cultivo bacteriano frente a M. fijiensis. El filtrado de cultivo se obtuvo a partir de la cepa CCIBP-C5 perteneciente a la Colección de Cultivos Microbianos del Instituto de Biotecnología de las Plantas (aislada de la filosfera de Musa y con actividad antifúngica in vitro), según lo descrito por Cruz-Martín et al. (2010). Se siguió similar procedimiento para ambos métodos de evaluación (lectura de absorbancia y masa seca) y se usó una dilución de 1:10 del filtrado bacteriano con respecto al medio de cultivo. Para el análisis estadístico de los resultados se realizó un análisis de varianza de un factor y se empleó el programa estadístico SPSS para Window versión 19.0 previa comprobación de los supuestos de normalidad y homogeneidad de varianza.
RESULTADOS Y DISCUSIÓN
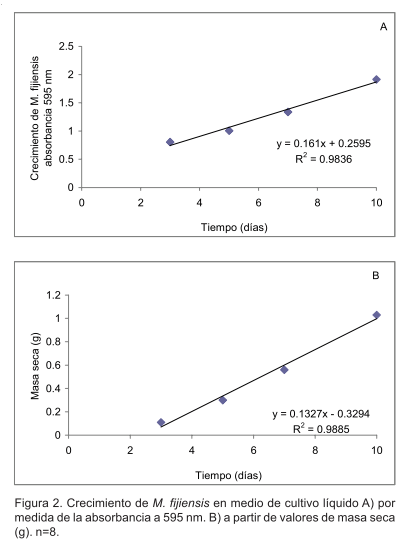
Se comprobó que el crecimiento de M. fijiensis en medio de cultivo PDB tuvo similares características tanto en frascos de cultivo de 250 ml de capacidad como en placas de 96 pocillos. En ambos la turbidez se incrementó en el tiempo (Figura 1 B,C) y esto se corroboró mediante los valores de absorbancia y masa seca (Figura 2).
Se encontró una relación lineal entre la absorbancia a 595 nm de suspensiones miceliales de M. fijiensis con respecto a la masa seca (g) (Figura 3) con R2 de 0.9993. Similares resultados fueron obtenidos por Broekaert et al. (1990) en curvas de crecimiento de Phycomyces blakesleeanus, Fusarium culmorum, Trichoderma hamatum, Septoria nodorum y Rhizoctonia solani obtenidas mediante el registro de la absorbancia a 595nm y la masa seca.
El incremento de la biomasa de M. fijiensis registrado mediante ambos métodos sugiere la posibilidad de evaluar el crecimiento in vitro de este patógeno en menores periodos de tiempo que los propuestos por Peláez et al. (2006).


Según Broekaert et al. (1990) si la absorbancia es un indicador de la biomasa del hongo en curvas de crecimiento normal, entonces las medidas de absorbancia pueden ser utilizadas como una herramienta para determinar las curvas de inhibición del crecimiento o hacer un monitoreo de la biomasa fúngica. Estos autores, plantearon que el uso de microplacas constituye una ventaja, ya que el ensayo puede montarse de forma fácil y rápida, se requieren pocas cantidades de muestra, la detección se hace por medio de un instrumento exacto y brinda la posibilidad de computarizar el procesamiento de los datos de forma directa.
Cuando se evaluó la actividad antifúngica del filtrado de cultivo bacteriano frente a M. fijiensis se observó similar comportamiento en cuanto a la relación entre la inhibición del crecimiento por medida de la masa seca y la absorbancia a 595 nm con un valor de R2=0.9945.
Al comparar el crecimiento de la biomasa de M. fijiensis en presencia del filtrado con actividad antifúngica con respecto al control (Figura 1 C,D) se observaron diferencias significativas a las 48 horas de incubación, según análisis de varianza de un factor (p<0.05), lo que permitió seleccionar este tiempo de cultivo para la evaluación de la actividad antifúngica.
En este estudio se comprobó por primera vez la relación lineal existente entre los valores de absorbancia a 595 nm y la masa seca (g) como medida del crecimiento de M. fijiensis en medio de cultivo líquido, para cuantificar la biomasa del patógeno. Se pueden emplear microplacas de 96 pocillos para la evaluación de la inhibición del crecimiento, lo cual es importante cuando se cuenta con pequeños volúmenes del agente antagonista así como la posibilidad de incorporar un gran número de réplicas al experimento. Este resultado posibilita minimizar los volúmenes finales requeridos en la cuantificación del crecimiento de M. fijiensis así como los tiempos de evaluación, variables imprescindibles en estudios de efectividad de compuestos purificados de naturaleza biológica frente a este patógeno.
CONCLUSIONES
Mediante lecturas de absorbancia en placas de 96 pocillos fue posible cuantificar el crecimiento de suspensiones miceliales M. fijiensis en medio de cultivo líquido. Además pudo ser aplicado para evaluar la inhibición del crecimiento del patógeno por filtrados de cultivo bacterianos con resultados a las 48 h de incubación. Como ventaja adicional se emplearon suspensiones miceliales del patógeno crecido en medio de cultivo líquido lo cual facilita su manipulación y ajuste de concentración.
REFERENCIAS
Broekaert WF, Terras F, Cammue B, Vanderleyden J (1990) An automated quantitative assay for fungal growth inhibition. Microbiology Letters 69: 55-60
Chin K, Wirz M, Laird D (2001) Sensitivity of Mycosphaerella fijiensis from banana to trifloxystrobin. Plant Dis. 85: 1264-1270
Cruz-Martín M, Alvarado-Capó Y, Acosta-Suárez, Roque B, Leiva-Mora M (2010) Efecto de filtrados cultivo bacterianos con actividad antifúngica in vitro en la interacción Musa spp.- Mycosphaerella fijiensis Biotecnología Vegetal. 10(2): 99-104
Essis B, Kobenan K, Traoré S, Koné D, Yatty J (2010) Sensibilité au laboratoire de Mycosphaerella fijiensis responsable de la Cercosporiose noire des bananiers vis-à-vis de fongicides couramment utilisés dans les bananeraies ivoiriennes. Journal of Animal & Plant Sciences 7(2): 822- 833
Hernández-Castillo F, Lira-Saldivar RH, Cruz-Chávez L, Gallegos-Morales G, Galindo-Cepeda M, Padrón-Corral E, Hernández-Suárez M (2008) Potencial antifúngico de cepas de Bacillus spp. y extracto de Larrea tridentata contra Rhizoctonia solani en el cultivo de la papa (Solanum tuberosum L.) ÖYTON 77: 241-252
Manzo G, Orozco M, Guzmán S (2001) Caracterización morfológica de Mycosphaerella fijiensis Morelet de la región Pacífico-Centro de México y su desarrollo en medios de cultivo líquidos. Revista Mexicana de Fitopatología. 19: 66-71
Meredith, D, Lawrence J (1969) Black leaf streak disease of bananas (Mycosphaerella fijiensis): symptoms of disease in Hawaii, and notes on the conidial state of the causal fungus. Trans. Br. Mycol. Soc. 52 (3): 459-476
Mosquera O, Echeverry L, Osorio J (2009) Evaluación de la actividad antifúngica de extractos vegetales sobre el hongo Mycosphaerella fijiensis Morelet. Scientia Et Technica XV(41): 232-236
Peláez J, Vásquez LE, Díaz TJ, Castañeda DA, Rodríguez E, Arango RE (2006) Use of a micro title
Peláez J,
Vásquez LE, Díaz TJ, Castañeda DA,Rodríguez E, Arango
RE (2006) Use of a micro title plate dilution assay to measure activity of antifungal
compounds against Mycosphaerella fijiensis Morelet.
Rev.Fac.Nal.Agr.Medellín. 59(2): 3425-3433
Pérez, L (2009) Fungicidas utilizados en el manejo de las enfermedades de los bananos y plátanos. Resistencia a Fungicidas. Seminario de manejo deenfermedades de Musáceas. INISAV. Ciego de Ávila,Cuba
Recibido: 10-7-2013
Aceptado: 16-9-2013
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
