ARTÍCULO ORIGINAL
Biotecnología
Vegetal Vol. 15, No. 2: 75 - 83, abril - junio, 2015
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
Instituto de Biotecnología de las Plantas. UCLV. MES.
Propagación in vitro de variedades cubanas de Solanum tuberosum L. `Yuya', `Marinca', `Grettel' e `Ibis'
In vitro propagation of Cubans varieties of Solanum tuberosum L. `Yuya', `Marinca', `Grettel' and `Ibis'
Leyanis García-Águila1*, Mayelin Rodríguez1, Mariana La O1, Marta Pérez1, Yelenys Alvarado-Capó1, Manuel de Feria1, Novisel Veitía1, Deivis Mirabal1, Juan Castillo2. *Autora para correspondencia
1Instituto
de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas, Carretera a Camajuaní km 5.5. Santa
Clara. Villa Clara. Cuba. CP 54 830. e-mail:
leyanis@ibp.co.cu
2Instituto Nacional Ciencias Agropecuaria (INCA). Carretera a Tapaste km 3.5. Gaveta Postal 1. San José de las Lajas. Mayabeque. Cuba.
RESUMEN
Las técnicas de cultivo in vitro se utilizan para apoyar los procesos de producción de semilla de papa (Solanum tuberosum L.) porque garantizan la rápida propagación de variedades promisorias, alta estabilidad genética y calidad fitosanitaria. Este trabajo tuvo como objetivo determinar la respuesta de cuatro variedades de papa `Yuya', `Marinca', `Grettel' e `Ibis' durante el proceso de propagación in vitro. Se establecieron meristemos (0.3-0.5 mm de longitud), se multiplicaron las plantas y se formaron microtubérculos. Se describieron durante todo el proceso de propagación in vitro las características morfológicas del material vegetal. El porcentaje de supervivencia de los meristemos y el coeficiente de multiplicación se calcularon y se cuantificó el número de microtubérculos por planta. Los resultados mostraron la respuesta diferencial de las variedades durante su propagación in vitro. `Yuya' e `Ibis' presentaron los mayores porcentajes de supervivencia de meristemos, con alta frecuencia de plantas de morfología normal, presencia de hojas y raíces. La formación de microtubérculos con diámetro entre 0.1 a 1.0 cm se produjo en todas las variedades y el mayor número por planta se obtuvo en la variedad `Marinca'. Estos resultados proporcionan información importante que permitirá establecer indicadores de calidad y planificación durante el proceso de propagación in vitro de las variedades cubanas de papa.
Palabras clave: meristemos, microtubérculos, morfología, papa, supervivencia
ABSTRACT
The in vitro culture techniques are used to support the production processes of potato seed (Solanum tuberosum L.) because it ensure the rapid propagation of promising varieties, genetic stability and high quality plant. This study aimed to determine the response of four potato varieties `Yuya' `Marinca' `Grettel' and `Ibis' during in vitro propagation. Meristems were stablished (0.3-0.5 mm long), multiplied plants and microtubers were formed. During the process of in vitro propagation it were described the morphological characteristics of the plant material. The percent survival of the meristems and the multiplication coefficient were calculated and the number of microtubers per plant was quantified. The results showed a differential response of varieties during in vitro propagation. `Yuya' and `Ibis' had the highest survival meristem rates, high frequency of plants with normal morphology characterized by dark green color, stem of between 2.5 and 4.5 cm in length and presence of leaves and roots. The microtubers formation with diameters between 0.1 to 1.0 cm occurred in all varieties and the highest number per plant was obtained in variety `Marinca'. These results provide important information that will establish quality and planning indicators during in vitro propagation of Cuban potato varieties.
Key words: meristems, microtubers, morphology, potato, survival
INTRODUCCIÓN
La papa (Solanum tuberosum L.), es uno de los cultivos alimenticios más importantes tanto en países desarrollados como en vías de desarrollo. Por su alto valor nutritivo se considera estratégica para solucionar los problemas del hambre en el mundo (Castro et al., 2012).
Las técnicas de cultivo in vitro se utilizan para apoyar los procesos de producción de semilla de papa porque garantizan la rápida propagación de variedades promisorias, una alta estabilidad genética y la sanidad del material vegetal. Las plantas y microtubérculos obtenidos in vitro son plantados en casas de cultivo para la producción de minitubérculos, los cuales constituyen la semilla original de papa que posteriormente transitará por las categorías básica, certificada y registrada mediante sucesivas multiplicaciones en campo (Jiménez-Terry et al., 2010).
En Cuba se establecen las condiciones para la producción de semilla de papa con el empleo de técnicas biotecnológicas y se trabaja en el desarrollo de nuevas variedades a través del Programa de mejoramiento genético del Instituto Nacional de Ciencias Agrícolas. Como resultado se cuenta con un grupo de variedades cubanas adaptadas a las condiciones climáticas y con resistencia o tolerancia a las principales enfermedades del cultivo entre los que se encuentran `Yuya', `Marinca', `Grettel' e `Ibis' (Estévez et al., 1998; Castillo et al., 2006; Castillo et al., 2011).
La propagación in vitro es indispensable para la rápida producción de semilla e introducción de estas variedades a condiciones de producción. Sin embargo, no se conoce su respuesta a las condiciones de cultivo in vitro lo cual es necesario antes de comenzar un programa de propagación in vitro a gran escala (Srivastava et al., 2012). Teniendo en cuenta los antecedentes anteriormente descritos este trabajo tuvo como objetivo determinar la respuesta de cuatro variedades de papa `Yuya', `Marinca', `Grettel' e `Ibis' durante el proceso de propagación in vitro.
MATERIALES Y MÉTODOS
Material vegetal
Tubérculos de las variedades `Yuya', `Marinca', `Grettel' e `Ibis' procedentes de plantas negativas a los principales microrganismos patógenos del cultivo.
Cultivo in vitro
Los tubérculos se lavaron con agua corriente para eliminar restos de suelo, se secaron al aire y se colocaron en condiciones de oscuridad total hasta la brotación de sus yemas.
A partir de brotes con aproximadamente 2.0 cm de longitud se extrajeron meristemos. Los brotes fueron separados de los tubérculos y se colocaron en recipientes de cultivo de 250 ml de capacidad total para su desinfección superficial (Figura 1 a b). El proceso de desinfección se realizó con una solución de etanol al 70.0% durante dos minutos y posteriormente se añadió hipoclorito de sodio al 1.0% (v/v i.a) por 10 minutos. Seguidamente se efectuaron tres lavados sucesivos con agua destilada estéril.
La extracción de los meristemos se realizó en la cabina de flujo laminar con el empleo de un microscopio estereoscópico (Figura 1 c). Las hojas fueron separadas y cortadas hasta dejar el domo meristemático acompañado de tres primordios foliares con una longitud aproximada de 0.3- 0.5 mm. La medición se efectuó con una escala milimétrica presente en el ocular del microscopio estereoscópico.
Los meristemos se colocaron en tubos de ensayo (15.0 x 2.0 cm) sobre 10 ml de medio de cultivo compuesto por el 100% de las sales y vitaminas propuestas por Murashige y Skoog (1962) (MS) (DUCHEFA), 100 mg l-1 de mio-inositol, 20 g l-1 de sacarosa, y 2.5 g l-1 de Gelrite®. El pH se ajustó a 5.7 previo a la esterilización en autoclave.
Los tubos de ensayo con los meristemos se colocaron a 20±2 ºC y fotoperiodo de 16 horas de luz y 8 horas de oscuridad. Se utilizaron lámparas fluorescentes (PHILIPS TLD, 58 W/84) con intensidad lumínica de 37.5-43.7 µmol m-2 s-1.
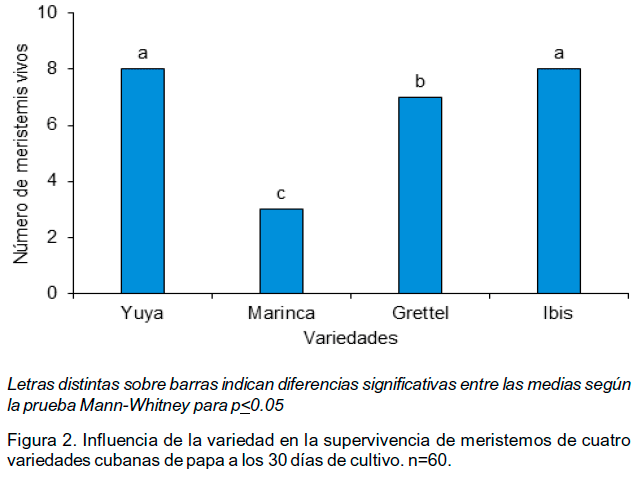
A los 30 días de cultivo, se cuantificó el número de meristemos vivos y se calculó el porcentaje de supervivencia. Como criterio de vitalidad se consideró el aumento del tamaño y la coloración verde de los tejidos. Además, a los 50 días de cultivo se realizó una descripción morfológica de las plantas regeneradas a partir de los meristemos, basada en sus características, color e intensidad del color de tallos y hojas. Se establecieron 20 meristemos por variedad.
Las plantas se multiplicaron mediante el corte de las yemas apicales y axilares (explantes). Los explantes se colocaron en medio de cultivo de similar composición al descrito anteriormente, con modificación en el contenido de sacarosa a 30 g l-1 y esterilización química con la adición de 116 mg l-1 de Vitrofural® (35 mg l-1 i.a). Se utilizaron recipientes de cultivo de 500 ml de capacidad total con 60 ml de medio de cultivo y se colocaron 20 explantes por cada uno. Las condiciones de cultivo fueron iguales a las utilizadas para el establecimiento de meristemos.
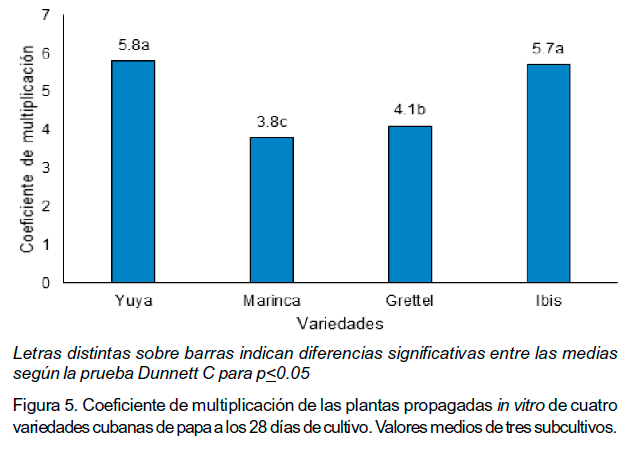
Se realizó un diseño experimental completamente aleatorizado, donde se establecieron 20 réplicas (recipiente de cultivo) por cada variedad y tres subcultivos (cada 28 días). En cada subcultivo se calculó el coeficiente de multiplicación de las plantas de cada variedad a través de la siguiente expresión matemática: Coeficiente de multiplicación= número de explantes final/ número de explantes inicial.
Además, en cada variedad con el objetivo de formar microtubérculos se emplearon plantas in vitro con seis subcultivos de multiplicación (15 recipientes de cultivo con 20 plantas cada uno, para un total de 300 plantas in vitro) que se encontraban en sus recipientes de cultivo a las cuales se adicionaron 20 ml medio de cultivo líquido compuesto por el 100% de las sales de MS (DUCHEFA) y 80 g l-1 de sacarosa. El pH se ajustó a 5.7 antes de la esterilización en autoclave.
Los recipientes de cultivo se colocaron en condiciones de oscuridad total a 20±2 ºC. A los 60 días de cultivo, se realizó una descripción morfológica basada en el color e intensidad del color de tallos, hojas y microtubérculos. Para determinar el color se utilizó el código hexadecimal de colores (http://www.cwp.linet.edu/cwis/cwp.html). Seguidamente, se cuantificó el número de microtubérculos por planta y se midió el diámetro (cm).
Análisis estadístico
El procesamiento estadístico se realizó con el paquete estadístico SPSS versión 21 para ambiente del sistema operativo Windows de Microsoft®. Como procedimiento común para todas las variables, se efectuó la comprobación de los supuestos de distribución normal y homogeneidad de varianzas. Las pruebas se efectuaron con un nivel de significación de 0.05. Los datos correspondientes al porcentaje de supervivencia se compararon mediante la prueba Mann-Whitney, mientras que los datos del coeficiente de multiplicación y número de tubérculos por planta se compararon mediante la prueba de Dunnett C.
RESULTADOS
A los 30 días de cultivo, se observaron diferencias significativas entre las variedades con respecto al porcentaje de supervivencia de los meristemos. Las variedades `Ibis' y `Yuya' mostraron los mayores valores sin diferencias significativas entre ellos y sí con los restantes (Figura 2).
Las plantas regeneradas a partir de los meristemos mostraron diferencias en su morfología y se identificaron dos grupos. Un grupo de plantas se caracterizó por presentar una coloración verde oscuro (código: 336F1F), tallos rectos de entre 2.5 y 4.5 cm de longitud que se formaron a partir del domo meristemático, con entrenudos a intervalos regulares y la presencia de hojas y raíces. Las plantas con estas características se consideraron como plantas de morfología normal (Figura 3 a).
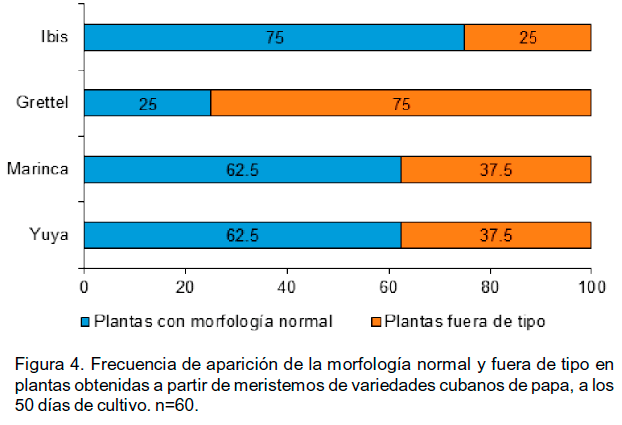
El otro grupo mostró una coloración verde claro (código: 84DD84), tallos de menor longitud entre 0.5 y 1.5 cm, entrenudos cortos, hojas con aspecto hiperhídrico y ausencia de raíces (Figura 3 b). Estas fueron designadas como plantas fuera de tipo. Ambos grupos de plantas se observaron en las cuatro variedades objeto de estudio.
La frecuencia de aparición de los dos tipos de plantas varió entre
las variedades. En `Marinca', `Ibis' y `Yuya' más del 50% de las plantas
mostraron una morfología normal. Por otra parte, en la variedad `Grettel'
se observó una mayor frecuencia de plantas con morfología fuera
de tipo (Figura 4). Las plantas con estas características
se descartaron del proceso de propagación in vitro por no ser
posible su multiplicación.
En todas las variedades se logró multiplicar las plantas. Se observó la formación de tallos, hojas y raíces a partir de los explantes iniciales. En `Yuya' e `Ibis' aparecieron plantas con la presencia de dos tallos por la brotación de las yemas axilares cercanas a la base de la planta. Este aspecto trajo como consecuencia el incremento del coeficiente de multiplicación en estas variedades, con diferencias significativas con respecto a `Marinca' y `Grettel' (Figura 5).
Al finalizar el proceso de tuberización, las plantas de las cuatro variedades mostraron similares características con tallos de color verde oscuro (código: 336F1F) hacia la porción basal y amarillo claro (código: D9F294) en la zona apical. Se observaron raíces y estolones de color blanco crema (código: F6F7E6) en la base de las plantas y en las yemas axilares con crecimiento en dirección apical. Las hojas mostraban síntomas de clorosis y necrosis.
De igual manera, todas las variedades formaron microtubérculos con colores que variaban del blanco crema (código: F8F8F3) hasta el rosado claro (código: F8E9E4) y oscuro (código: CC5D5D) (Figura 6). El diámetro de los microtubérculos osciló entre 0.1 a 1.0 cm con una mayor frecuencia en el rango de 0.1 a 0.5 cm. Estos se ubicaban principalmente en la zona apical y central de la planta.
La variedad `Marinca' mostró el mayor número de tubérculos por planta con diferencias significativas con respecto al resto (Figura 7).
Las características predominantes de estas variedades en la propagación in vitro en medios de cultivo sin reguladores del crecimiento se resumen en la tabla 1. Se incluyen solo las características de las plantas definidas como normales.
DISCUSIÓN
En la literatura científica no se han encontrado antecedentes sobre la propagación in vitro de las variedades cubanas de papa `Yuya', `Marinca', `Grettel' e `Ibis'. Mediante este estudio fue posible conocer su respuesta in vitro en medios de cultivo sin reguladores del crecimiento. Ello ofrece la posibilidad de observar su potencial tanto para la obtención de plantas in vitro como de microtubérculos que se emplean comúnmente en los programas de producción de semilla de este cultivo (Dobránszki et al., 2008).
Se apreció en todas las variedades la aparición de plantas con características morfológicas diferentes (fuera de tipo) con mayor porcentaje en la variedad `Grettel'. Aunque se ha descrito que las condiciones del cultivo in vitro inducen desórdenes en las plantas (Hazarica, 2006) este aspecto ha sido poco abordado en los trabajos sobre propagación in vitro de papa y en este estudio no se realizaron otros experimentos que aportaran evidencias sobre las posibles causas. Sin embargo, identificar plantas con estas características y eliminarlas del proceso productivo tiene gran importancia para garantizar el cumplimiento de las estrategias productivas.
En este trabajo se demostró la influencia del genotipo en el establecimiento de meristemos, multiplicación de plantas y formación de microtubérculos de estas variedades en las mismas condiciones experimentales. Ello ha sido descrito previamente por diferentes autores en otras variedades de papa (Gopal et al., 1998; Dobránszki et al., 1999; Ranalli et al., 1994; Hossain, 2005). Los mejores resultados durante la iniciación del cultivo
in vitro, la supervivencia de sus meristemos
así como regeneración de plantas con características favorables para su multiplicación se obtuvieron en las variedades `Yuya' e `bis'. Sin embargo, la variedad `Grettel' se mostró recalcitrante al cultivo in vitro. El 75.0% de sus meristemos formaron plantas con características fuera de tipo y las plantas restantes mostraron baja formación de microtubérculos. Por otra parte, la variedad `Marinca' presentó los menores valores de establecimiento de meristemos, aunque con formación de plantas a partir de las cuales se produjo la mayor formación de microtubérculos con respecto al resto de las variedades estudiadas. Conocer el potencial de las variedades cubanas permitirá definir estrategias para su propagación masiva por técnicas biotecnológicas y su uso para obtener minitubérculos en casa de cultivo o campo.
Si se tiene en cuenta que la respuesta in vitro no solo está relacionada con el potencial genético inherente a la variedad; sino también con las condiciones de cultivo (Srivastava et al., 2012) se podría estudiar la influencia de otros factores tales como la composición del medio de cultivo, el tipo de agente gelificante, la iluminación, la temperatura, la adición de reguladores del crecimiento que permitan mejorar la supervivencia de los meristemos de la variedad `Marinca' e incrementar el número de microtubérculos por planta en todas las variedades. Autores tales como Sharma et al. (2011) mejoraron la tasa de multiplicación in vitro de trece variedades de papa de la India con diferentes agentes gelificantes y Gudeva et al. (2012) mediante la adición de citoquininas y la combinación de citoquininas y auxinas en el medio de cultivo contribuyeron al crecimiento in vitro y a una mejor inducción de la tuberización en dos variedades de papa.
La obtención de microtubérculos en medio de cultivo semisólido con la adición a las plantas de medio de cultivo líquido proporciona, además, información valiosa a tener en cuenta para el uso posterior de sistemas de inmersión temporal que se emplean para producir microtubérculos (Jiménez et al., 1999). Se ha considerado que los microtubérculos son un material vegetal ideal para producir semilla de alta calidad con ventajas sobre las plantas in vitro relacionadas con su pequeño tamaño, su vigor, requerimientos de poco espacio para su almacenamiento por tiempo prolongado, fácil transportación, y posibilidades de empleo para la producción de minitubérculos en casa de cultivo o campo en programas de producción de semilla de papa. Además, permiten la conservación e intercambio de germoplasma y estudios de mejoramiento genético (Dobránszki et al., 2008; Castro et al., 2012, Fufa y Diro, 2014).
CONCLUSIONES
Las variedades cubanas `Yuya', `Marinca', `Grettel' e `Ibis' pueden ser propagadas in vitro y su respuesta es genotipo dependiente. Las variedades `Yuya' e `Ibis' presentan alta supervivencia de sus meristemos, con una mayor frecuencia de plantas de morfología normal y altos coeficientes de multiplicación. Todas las variedades tienen la capacidad de formar microtubérculos de 0.1 a 1.0 cm de diámetro y la variedad `Marinca' es la que produce mayor número por planta. Estos resultados brindan la información necesaria para establecer los indicadores de calidad y planificación durante el proceso de propagación masiva de estas variedades.
AGRADECIMIENTOS
El presente trabajo se realizó en el marco del proyecto Nacional Fortalecimiento de la semilla de papa que se ejecuta entre varios centros de investigación del país.
REFERENCIAS
Castillo JG, Estévez A, González ME, Salomón JL (2006) Informe de nuevas genotipos `Grettel', una nueva variedad cubana de papa para el consumo fresco e industrial. Cultivos Tropicales 27: 63
Castillo JG, Jorge L, Díaz S, Estévez A, Espinosa HM, González AP, Castiello UO, Monguía R, Lorenzo N, Tabera O (2011) Informe de nuevas genotipos `Yuya', nueva variedad de papa cubana para doble propósito. Cultivos Tropicales 32(2). 45
Castro J, Agramonte D, Alvarado-Capó Y, de Feria M, Pugh T (2012) Empleo de métodos biotecnológicos en la producción de semilla de papa. Biotecnología Vegetal 12(1): 3-24
Dobránszki J, Magyar-Tábori K, Ferenczy A (1999) Light and genotype effects on in vitro tuberization of potato plantlets. Potato Research 42: 483-488
Dobránszki Judit, Magyar-Tábori Katali, Hudák Ildikó (2008) In vitro tuberization in hormone-free systems on solidified medium and dormancy of potato microtubers. En: Benkeblia N, Tennant P (Eds) Potato I. Fruit, Vegetable and Cereal Science and Biotechnology, pp. 82-94. Global Science Books. London
Éstevez A, González ME, Castillo J, Ortiz U, Cordero M (1998) Informe de nuevas genotipos `Lizzette' e `Ibis' dos nuevos genotipos cubanos de papa. Cultivos Tropicales 19(2): 57
Fufa M, Diro M (2014) Microtuber induction of two potato (Solanum tuberosum L.) varieties. Adv Crop Sci Tech 2: 122
Gudeva K, Mitrev S, Fidanka T, Mite I (2012) Micropropagation of potato Solanum tuberosum L. Electronic Journal of Biolog 8(3): 45-49
Hazarika B N (2006) Morpho-physiological disorders in in vitro culture of plants. Scientia Horticulturae 108: 105120
Hossain MJ (2005) In vitro microtuberization in potato obtained from diverse sources. Plant Tissue Culture and Biotech 15(2): 157-166
Jiménez E, Pérez N, De Feria M, Barbón R, Capote A, Chávez M, Quiala E, Pérez J (1999) Improved production of potato microtubers using a temporary immersion system. Plant Cell, Tissue and Organ Culture 59: 19-23
Jiménez-Terry F, Agramonte D, Pérez M, León M, Rodríguez M, de Feria, M, Alvarado-Capó Y (2010) Producción de minitubérculos de papa var. `Desirée' en casa de cultivo con sustrato zeolita a partir de plantas cultivadas in vitro. Biotecnología Vegetal 10(4): 219-228
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant 15: 473-497
Sharma S, Venkatasalam EP, Patial R, Latawa J, Singh S (2011) Influence of gelling agents and nodes on the growth of potato microplant. Potato J. 38(1): 41-46
Srivastava AK, Diengdoh LC, Rai R, Bag TK, Shing BP (2012) In Vitro Micropropagation and Micro-tuberization Potential of Selected Potato Varieties. Indian Journal of Hill Farming 25(2): 14-17
Recibido: 11-11-2014
Aceptado:
04-03-2015
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.