ARTICULO ORIGINAL
Biotecnología
Vegetal Vol. 12, No. 3: 143 - 148, julio - septiembre, 2012
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
ISSN 1609-1841, RNPS: 0397 (Versión impresa)
Influencia del agente gelificante en la regeneración de plantas de Phaseolus vulgaris L. a partir de callos organogénicos
Influence of gelling agent in the regeneration of plants from Phaseolus vulgaris L. plants starting from organogenic callus
Novisel Veitía*, Raúl Collado, Lourdes R. García, Idalmis Bermúdez-Caraballoso, Damaris Torres, Carlos Romero.
Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas.
RESUMEN
El genotipo, el tipo de explante y la concentración de los reguladores del crecimiento se han estudiado para incrementar la eficiencia en la regeneración de plantas de Phaseolus vulgaris L. Sin embargo, los estudios sobre el efecto del agente gelificante en la inducción de brotes son escasos. Es por ello, que el presente trabajo tuvo como objetivo determinar el efecto del agente gelificante sobre la multiplicación de callos organogénicos y la regeneración de brotes de P. vulgaris var. BAT-93, BAT-304, BAT-482, Ica Pijao y CIAP 7247F. Se determinó la masa fresca de los callos (g) y en la regeneración de brotes se cuantificó el número de callos con brotes, el número de brotes por callo y el número de brotes hiperhídricos. Los resultados mostraron que el gelificante influyó en la multiplicación de los callos y regeneración de brotes en las cinco variedades. Se encontró que Ica Pijao, CIAP7247F y BAT-93, mostraron los mayores valores en la masa fresca (g) de los callos cuando se empleó agar microbiológico E. Sin embargo, `BAT-482' alcanzó el mayor valor de masa fresca de los callos en medio de cultivo endurecido con gelrite. Los callos de `BAT-304' presentaron valores de masa fresca similares en los dos tratamientos. En la regeneración las variedades `BAT-93' y `CIAP 7247F' mostraron los mayores valores en el número de callos con brotes y brotes por callo en medio de cultivo solidificado con gelrite. No obstante, en este tratamiento hubo mayor número de brotes hiperhídricos independientemente del cultivar.
Palabra clave: agar, cultivo in vitro, frijol común, gelrite.
ABSTRACT
Genotype, type of explant and concentration of growth regulators have been studied to increase efficiency in plant regeneration of Phaseolus vulgaris L. However, studies on the effect of the gelling agent in shoots induction are not enough. Therefore, the present study aimed to determine the effect of gelling agent on organogenic calli proliferation and shoots regeneration of P. vulgaris cv. `BAT-93', `BAT-304', `BAT-482', `Ica Pijao' and `CIAP 7247F'. Callus fresh weight (g) was determined. Number of calli with shoots, number of shoots per callus and number of hyperhydric shoots was measured in shoots regeneration. Results showed that gelling influenced the calli multiplication and shoot regeneration in the five cultivars. `Ica Pijao', `CIAP7247F' and `BAT-93' showed the highest values in calli fresh weight (g) using microbiological agar E. Besides, `BAT-482' reached the highest value of fresh weight of calli in culture medium hardened with gelrite. `BAT-304' calli showed similar values of fresh weight in both treatments. During regeneration, cultivars `BAT-93' and `CIAP 7247F' showed the highest values in the number of callus with shoots and shoots per callus in culture medium solidified with gelrite. Nevertheless, in this treatment there were more hyperhydric shoots regardless the cultivar.
Keywords: agar, in vitro culture, common bean, gelrite.
INTRODUCCIÓN
La regeneración de plantas vía organogénesis indirecta en Phaseolus vulgaris L. ha sido descrita (Mohamed et al., 1993; Zambre et al., 1998; Arellano et al., 2009). Sin embargo, estos protocolos son genotipo dependiente o presentan baja eficiencia en la regeneración in vitro. Lo anteriormente se relaciona con la reducida variabilidad genética de las variedades que se cultivan, las cuales son el resultado de largos periodos de selección y mejoramiento genético (Veltcheva et al., 2005). Para dar solución a las limitaciones que existen para la regeneración de plantas a partir de callos organogénicos en P. vulgaris, las investigaciones se han concentrado en el estudio de aspectos tales como: el genotipo, el tipo de explante, la concentración y tipo de citoquinina para la formación, multiplicación de callos y en la regeneración de brotes en callos organogénicos de P. vulgaris (Zambre et al., 1998; Arellano et al., 2009).
Sin embargo, existen escasos trabajos que describan el efecto de otros aspectos como el agente gelificante en los protocolos de regeneración de plantas de P. vulgaris. Al respecto, Guidolin (2003), describió que el tipo de agente gelificante influyó sobre el crecimiento de los callos del genotipo de P. vulgaris `Xan 159'. Este autor logró los mayores valores de masa fresca de los callos cuando empleó como agente gelificante el gelrite y fitagel en el medio de cultivo en comparación con diferentes tipos de agar utilizados en dicho estudio.
El agar es el agente gelificante más comúnmente utilizado en los medios de cultivo de tejidos vegetales (Kaçar et al., 2010). El agar presenta propiedades tales como: estabilidad, claridad y alta resistencia al metabolismo durante el desarrollo in vitro de las plantas que lo convierten en el agente gelificante de elección (Jain y Babbar, 2002). Por otro lado, el gelrite aparece como un sustituto económico del agar que se caracteriza por la alta pureza y menores cantidades del mismo le proporcionan una dureza al medio de cultivo similar a la producida con el agar (Ivanova y van Staden, 2011).
En la literatura científica se plantea que el tipo y la concentración del agente gelificante afecta significativamente la respuesta del material vegetal in vitro y favorece la aparición de plantas con hiperhidricidad (Tsay et al., 2006). Estas afectaciones están relacionadas con las alteraciones producidas por el agente gelificante sobre la disponibilidad de agua en el medio de cultivo (Ivanova y van Staden, 2011).
Teniendo en consideración lo anteriormente descrito el presente trabajo tuvo como objetivo determinar el efecto del agente gelificante sobre la multiplicación de callos organogénicos y la regeneración de brotes de P. vulgaris L. cv. `BAT-93', `BAT-304', `BAT-482', `Ica Pijao' y `CIAP 7247F'.
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon semillas de Phaseolus vulgaris L. de los cultivares `BAT-93', `BAT-304', `BAT-482', `Ica Pijao' y de la variedad cubana `CIAP7247F', variedad cubana procedentes del Centro de Investigaciones Agropecuarias (CIAP) de la Universidad Central `Marta Abreu' de Las Villas.
La desinfección de las semillas se realizó según el protocolo propuesto por Dillen et al. (1997). Una vez desinfectadas las semillas se colocaron en medio de cultivo de germinación descrito por García et al. (2008). El pH del medio de cultivo se ajustó a 5.7 previo a la esterilización en autoclave a 120°C durante 20 minutos. En cada frasco de cultivo (250 ml) que contenía 30 ml de medio de cultivo de germinación se colocaron 10 semillas para un total de 150 semillas por cultivar. Los frascos fueron colocados en cámaras de crecimiento en oscuridad constante a 25±2°C durante tres días.
Como explante inicial para la formación de callos se empleó el nudo cotiledonal con un cotiledón o dos según el cultivar, en el medio de cultivo de inducción de callos compuesto por: sales MS, vitaminas B5 (Gamborg et al., 1967), tidiazurón (TDZ) 0.2 mg l-1, ácido indol 3-acético (AIA) 0.05 mg l-1, mio-inositol 100 mg l-1, sacarosa 30 g l-1 y agar E microbiológico (Biocen) 6.0 g l-1. El pH fue ajustado a 5.7 previo a la esterilización en autoclave a 120°C durante 20 minutos.
El material vegetal se mantuvo a 25±2°C y oscuridad constante durante siete días. Posteriormente fue colocado en cámaras de crecimiento con luz artificial con fotoperíodo de 16/8 (luz/oscuridad) durante 14 días. Para la iluminación se emplearon lámparas fluorescentes (45 µmol m2s-1).
Efecto del tipo de agente gelificante en la multiplicación de callos
Para determinar el efecto del agente gelificante sobre la multiplicación de callos en los cultivares de P. vulgaris `BAT-93', `BAT-304', `BAT-482', `Ica Pijao' y `CIAP7247F' se realizó el siguiente experimento. Se emplearon callos procedentes del medio de cultivo de formación de callos descrito por García et al. (2008). Estos fueron cortados en fragmentos de 0.2-0.3 g y colocados sobre el medio de cultivo de multiplicación compuesto por: Sales MS, vitamina B5, AIA 0.05 mg l-1, TDZ 0.2 mg l-1, mio-inositol 100mg l-1, sacarosa 20g l-1, (pH 5.7). El medio de cultivo fue endurecido con agar E microbiológico (Biocen) 6.0g l-1 gelrite (Duchefa) 3.0g l-1 por lo que se conformaron dos tratamientos para cada cultivar.
Se emplearon 25 frascos de cultivo por cada tratamiento y cultivar con cinco callos por frasco de cultivo (250 ml de volumen). Los frascos fueron colocados en cámaras de crecimiento durante 21 días. Los primeros siete días a 25±2°C y oscuridad constante y los restante 14 días fueron colocados en cámaras de crecimiento con luz artificial y fotoperiodo de 16/8 (luz/oscuridad). Para la iluminación se emplearon lámparas fluorescentes (45 µmol m2s-1).
Las evaluaciones consistieron en determinar la masa fresca de los callos (g) y para ello se empleó una balanza digital Sartorius (Alemania) a los 21 días de cultivo.
Efecto del tipo de gelificante en la regeneración de brotes
El presente experimento se realizó con el objetivo de determinar el efecto del tipo de gelificante en la regeneración de brotes en los cultivares de P. vulgaris `BAT-93', `BAT-304', `BAT-482', `Ica Pijao' y `CIAP7247F'. Se realizó la siembra, formación y multiplicación de callos similar a lo descrito en el experimento anterior. Los callos multiplicados (segundo subcultivo) fueron colocados en el medio de cultivo de regeneración de brotes compuesto por: Sales MS, vitamina B5, 6-BAP 2.25 mg l-1, mio-inositol 100 mg l-1 y sacarosa 30 g l-1. Se establecieron dos tratamiento en uno se empleó agar E microbiológico (Biocen) 6.0 g l-1 y en el otro gelrite (Duchefa) 3.0 g l-1 El pH del medio de cultivo fue ajustado a 5.7.
Los frascos de cultivo fueron colocados en cámaras de crecimiento en condiciones similares a las descritas para la multiplicación de los callos. Se emplearon 25 frascos por tratamiento. Se cuantificó el número callos con brotes y se calculóel porcentaje, el número de brotes por callos para cada tratamiento y cultivar y el número de brotes hiperhídricos.
Análisis estadístico
La masa fresca
de los callos, el número de callos con brotes, el número de brotes
por callo y el
número de brotes hiperhídricos fue analizado mediante la prueba
de Kruskal-Wallis y Mann Whitney mediante el paquete estadístico
SPSS PASW Statistic 18 (SPSS Inc., Chicago, IL, USA). En todos los casos
las diferencias se establecieron para P<0.05.
RESULTADOS
Efecto del tipo de gelificante en la multiplicación de callos
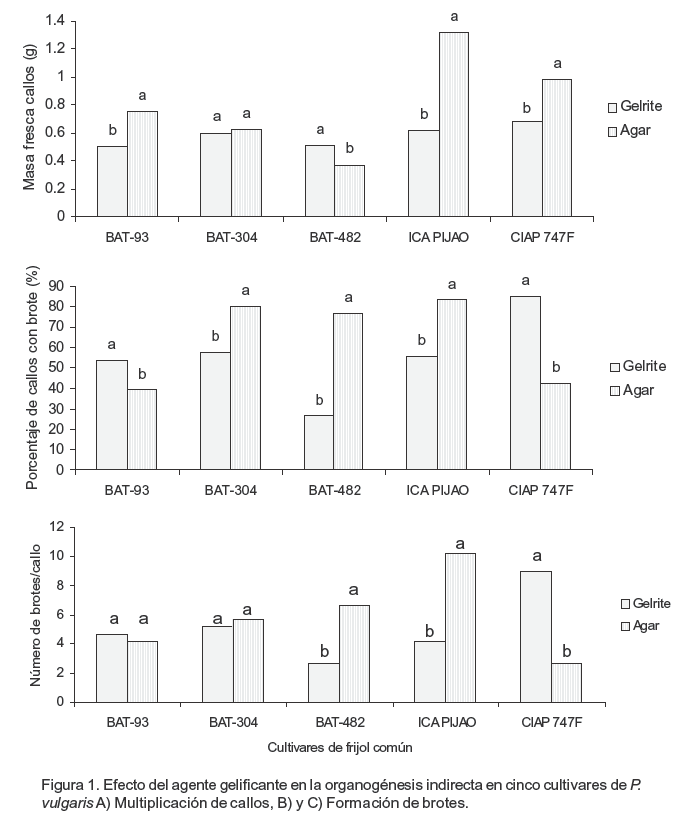
Los resultados mostraron que el agente gelificante influyó en la multiplicación de los callos en los cinco cultivares de P. vulgaris estudiadas y que esto dependió del cultivar `Ica Pijao', `CIAP7247F' y `BAT-93', mostraron los mayores valores en la masa fresca (g) de los callos cuando se empleó agar E microbiológico para solidificar el medio de cultivo de multiplicación, con diferencias significativas entre ambos tratamientos para cada cultivar. Sin embargo, los callos de `BAT 482' alcanzaron los mayores valores en la masa fresca cuando el medio de cultivo se solidificó con gelrite, con diferencias significativas respecto a los callos del mismo cultivar en medio de cultivo de proliferación endurecido con agar. Por otra parte, los callos de `BAT-304' presentaron valores similares en cuanto a la masa fresca (g) en el medio de cultivo de multiplicación independientemente del tipo de gelificante que se agregó al medio de cultivo (Figura 1A).
Efecto del tipo de agente gelificante en la regeneración de brotes
A partir de los resultados se pudo comprobar que el gelificante influyó en la formación de brotes en los cinco cultivares de P. vulgaris utilizados en el presente estudio. En el medio de cultivo de regeneración endurecido con agar E microbiológico (Figura 1B) las variedades `ICA Pijao', `BAT-482' y `BAT-304' presentaron los mayores valores en el porcentaje de callos con brotes con diferencias significativas con los valores alcanzados cuando el medio de cultivo fue endurecido con gelrite. Por el contario, `BAT-93' y `CIAP7247F' presentaron los mayores porcentajes de callos con brotes en el medio de cultivo de regeneración de brotes endurecido con gelrite. Estos valores difirieron significativamente con los obtenidos en el medio de cultivo con agar E microbiológico para cada variedad. Por otra parte, para la variable número de brotes por callo se encontró que los tres cultivares que mostraron los mayores porcentajes de callos con brotes también presentaron los mayores valores en cuanto al número de brotes por callos (Figura 1C). Estos valores difirieron significativamente con los del tratamiento en que se agregó gelrite al medio de cultivo. Sin embargo, `BAT- 93' no mostró diferencias entre los dos tratamientos evaluados. El cultivar `CIAP 7247F' presentó los mayores valores en el número de brotes por callo cuando se empleó el gelrite en el medio de cultivo con diferencias significativas respecto al tratamiento con agar E microbiológico.
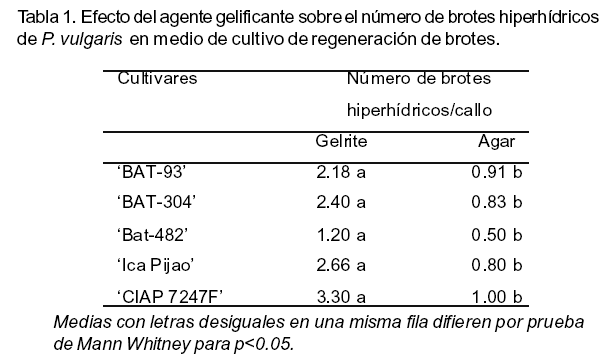
En cuanto al número
de brotes hiperhídricos se encontró que en los cinco cultivares
estudiadas los mayores valores se registraron en los tratamientos en los que
se le agregó gelrite al medio de cultivo de regeneración de brotes,
los cuales se caracterizaron por presentar hojas de color verde claro y traslúcidas
(Figura 2A). Sin embargo, los brotes en medio de cultivo solidificado con agar
E Microbiológico mostraron un desarrollo normal (Figura 2B).

DISCUSIÓN
El agente gelificante empleado en el endurecimiento del medio de cultivo puede influir en la respuesta del material vegetal al cultivo de tejidos (Pereira-Netto et al., 2007). La multiplicación de callos de P. vulgaris en el presente trabajo estuvo influenciada por el gelificante que se agregó al medio de cultivo y por el cultivar. Los callos alcanzaron los mayores valores de masa fresca (g) cuando el medio de cultivo se le agregó agar E microbiológico en cuatro de los cultivares estudiadas y solo una (BAT-482) presentó el mayor valor en la masa fresca de los callos en el medio de cultivo endurecido con gelrite.
En la literatura científica existen pocos trabajos que refieran el estudio del gelificante en la multiplicación de callos y regeneración de brotes en P. vulgaris. Al respecto, Guidolin (2003) evaluó el crecimiento de los callos del cultivar Xan 159 de P. vulgaris en el medio de cultivo con diferentes gelificantes. Este autor, logró los mayores valores de masa fresca de los callos cuando empleó como agente gelificante el gelrite, fitagel y agargum que cuando empleó los de tipo agar en el endurecimiento de los medios de cultivo.
Esta respuesta también se manifestó en la regeneración de brotes tanto para el porcentaje de callos con brotes como para el número de callos con brotes, donde `CIAP7247F' presentó los mayores valores para las variables anteriormente mencionadas cuando se empleó el gelrite para solidificar el medio de cultivo. Los restantes variedades presentaron mayor número de brotes cuando los callos fueron cultivados en presencia de agar E microbiológico. Sin embargo, los brotes formados en medio de cultivo endurecido con gelrite en cinco cultivares estudiadas mostraron brotes hiperhídricos. Estos resultados coinciden con lo descrito por Ivanova y Van Staden (2011) en Aloe polyphylla (clasificador Schonland ex Pillans) cuando compararon estos dos agentes gelificante, agar y gelrite en concentraciones que produjeran una dureza similar al medio de cultivo.
En varias especies vegetales se ha descrito que el gelrite provoca hiperhidricidad en las plantas (Kadota et al., 2001, Tsay et al., 2006). Según Ivanova y van Staden (2010), el efecto del gelrite sobre la hiperhidricidad se ha relacionado con su estructura física, la cual permite un incremento en la absorción de sustancias, tales como: citoquininas, iones amonio y agua. Sobre la baja frecuencia de hiperhidricidad en los medios de cultivo endurecidos con agar se ha planteado que puede estar dado por el sulfato galactano en el agar que pudiera controlar la hiperhidricidad (Nairn et al., 1995).
CONCLUSIONES
El presente estudio demostró que el tipo de agente gelificante y el cultivar influyeron en la multiplicación de callos y en la regeneración de brotes de P. vulgaris. Por ello, deben considerarse en el establecimientos de protocolos de regeneración de plantas vía organogénesis indirecta ya que puede incrementarse la eficiencia en la regeneración de plantas en una especie recalcitrante al cultivo de tejidos y reducir el número de brotes hiperhídricos.
REFERENCIAS
Arellano, J, Fuentes SI, Castillo-España P, Hernández G (2009) Regeneration of different cultivars of common bean (Phaseolus vulgaris L.) via indirect organogenesis. Plant Cell. Tiss. Organ Cult. 96:1-11
Dillen, W, DE Clercq J, Goosens A, Van Montagu M, Agenon G (1997) Agrobacterium mediated transformation of Phaseolus acutifolius A. gray. Theor. Appl. Genet. 94:151-158
Gamborg, OL, Miller RA, Ojima K (1968) Nutrient requirements of suspension cultures of soybean root cells. Exp. Cell. Res. 50: 151-158
García, L, R Collado, Bermúdez-Caraballosos I, Veitía N, Torres D, Romero C (2008) Regeneración de plantas via organogenesis directa en Phaseolus vulgaris L. Biotecnología Vegetal 8(2):109-114
Guidolin, F (2003) Regeneraçao de plantas de Phaseolus vulgaris L. a partir de calos e transformaçao genetico Agrobacterium. Tesis en opción al grado de Doctor en Ciencias. PIRACICABA, Sâo Paulo, Brazil.
Ivanova, M, van Staden J (2011) Influence of gelling agent and cytokinins on the control of hyperhydricity in Aloe Polyphylla. Plant Cell. Tiss. Organ Cult. 104(1):13-21
Jain N, Babbar SH (2002) Gum katira - a cheap gelling agent for plant tissue culture media. Plant Cell Tissue Organ Cult. 71: 223-229
Kaçar, YA, Biçen B, Varol I, Mendi YY, Serçe S, Çetiner S (2010) Gelling agent and culture vessels affect in vitro multiplication of banana plantlets. Genetics and Molecular Research 9(1): 416-424
Kadota, M, Imizu K, Hirano T (2001) Double-phase in vitro culture using sorbitol increases shoot proliferation and reduces hyperhydricity in Japanese pear. Sci. Horticulturae 89:207-215
Mohamed, MF, Coyne DP, Read PE (1993) Shoot organogenesis in callus induced from pedicel explants of common bean (Phaseolus vulgaris L.). J Am. Soc. Hortic. Sci. 118:158-162
Nairn, BJ, Furneaux RH, Stevenson TT (1995) Identification of an agar constituent responsible for hydric control in micropropagation of radiate pine. Plant Cell Tissue and Organ culture 43:1-11.
Pereira-Netto, AB, Petkowicz CLO, Cruz-Silva CTA, Gazzoni MT, Mello AFP, Silveira JLM (2007) Differential performance of marubakaido apple rootstock shoots grown in culture media containing different agar brands: dinamyc rheological analysis. In vitro Cell. Dev. Biol. Plant 43:356-363
Tsay H-S, Lee C-Y, Agrawal DC, Basker S (2006) Influence of ventilation closure, gelling agent and explant type on shoot bud proliferation and hyperhydricity in Scrophularia yoshimurae-a medicinal plant. Acta Horticulturae 461:243-249
Veltcheva MR, Svetleva D, Petrova SP, Perl A (2005) In vitro regeneration and genetic transformation of common bean (Phaseolus vulgaris L.)-Problems and progress. Scientia Horticulturae 107:2-10
Zambre MA, De Clercq J, Vranová E, Van Montagu M, Angenon G, Dillen W (1998) Planta regeneration from embryo-derived callus in Phaseolus vulgaris L. (common bean) and P. acutifolious A. Gray (tepary bean). Plant Cell Rep. 17:626-630
Recibido: 7-5-2012
Aceptado: 2-6-2012
Novisel Veitía.
Carretera
a Camajuaní km 5.5. Santa Clara, Villa Clara. Cuba. CP 54 830 e-mail:
novisel@uclv.edu.cu
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
