Artículo original
Biotecnología
Vegetal Vol. 12, No. 3: 157 - 164 , julio - septiembre, 2012
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
ISSN 1609-1841, RNPS: 0397 (Versión impresa)
Selección de cepas de Azotobacter chroococcum para su aplicación en la aclimatización de plantas in vitro de piña cv. `Cayena lisa'
Selection of Azotobacter chroococcum strains for its application on in vitro pineapple cv. `Cayena lisa' plants acclimatization
Rayza M. González Rodríguez1, Alitza Iglesias1, José Calos Lorenzo1, Bernardo Dibut2.
1Centro
de Bioplantas. Universidad de Ciego de Ávila.
2Instituto
Nacional de Investigaciones Fundamentales en Agricultura Tropical.
RESUMEN
Azotobacter chroococcum es una bacteria rizosférica que ha sido utilizada durante décadas como estimulador del crecimiento vegetal en una amplia gama de cultivos. Es capaz de fijar nitrógeno y producir sustancias estimuladoras del crecimiento. En el presente trabajo se muestran los resultados de determinar la efectividad de la aplicación de diferentes cepas de A. chroococccum en la aclimatización de plantas in vitro de piña. Se evaluaron seis cepas provenientes de la colección de cepas del INIFAT. Para su multiplicación y aplicación se empleó la norma cubana para la producción de A. chroococcum. Se evaluaron los siguientes indicadores: supervivencia, altura de la planta, número de hojas, longitud de la raíz, masa fresca y masa seca. La cepa INIFAT 5 resultó ser la que mayor estimulación produjo en la mayoría de las variables analizadas y fue seleccionada para estudios posteriores como la cepa más efectiva para la aclimatización de plantas in vitro de piña.
Palabras clave: Ananas comosus L., bacterias promotoras del crecimiento vegetal, biofertilizante.
ABSTRACT
Azotobacter chroococcum is a rhizosphere bacterium that has been used for decades as a plant growth stimulator in a wide range of crops. It is able to fix nitrogen and produce growth promoting substances. In the present work we show the results to determine the effectiveness of the application of different strains of A. chroococccum on acclimatization of in vitro pineapple plants. Six strains were evaluated from the strain collection of INIFAT. For its multiplication and application the Cuban standard for the production of A. chroococcum was used. We evaluated the following indicators: survival, plant height, leaf number, root length, fresh weight and dry weight. Strain INIFAT 5 proved to be the greatest stimulation occurred in most of the variables analyzed and it was selected for further study as the most effective strain for acclimatization of in vitro pineapple plants.
Key words: Ananas comosus L., biofertilizer, plant growth promotion bacteria.
INTRODUCCIÓN
La piña
(Ananas comosus L.) ocupa el tercer lugar en cuanto a volumen de producción
después de los bananos (Musa spp.) y los cítricos (Citrus
spp.) (Rohrbach et al., 2003). Su producción mundial fue de 18.4
millones de toneladas en 2009 (FAOSTAT, 2011). Sin embargo, el área cultivable
de esta fruta, continúa aumentando en el mundo (Bartholomew, 2009).
En Cuba, a pesar de que se ha incrementado su producción, no se logra satisfacer la demanda. Entre las causas se mencionan la carencia de material vegetal de plantación y las afectaciones fitosanitarias en las áreas de producción de semilla (Hernández, 2003; Hernández et al., 2010).
Para elevar estas producciones también se han establecido varios métodos como la multiplicación de plantas a través del cultivo de tejidos con el desarrollo de diferentes protocolos de propagación (Daquinta y Benega, 1997; Escalona et al., 1999; Botella y Fairbairn, 2005; Wang 2009). Sin embargo, aún estos presentan dificultades en la fase de aclimatización por la baja supervivencia de las plantas y su crecimiento lento en esta fase (Van de Broek et al., 1997; Yanes et al., 2001).
El uso de microorganismos promotores del crecimiento vegetal podría contribuir a mejorar la calidad de las plantas, influir en su crecimiento y desarrollo y por ende disminuir el tiempo requerido para su trasplante a campo.
Desde hace algunos años se viene introduciendo en el país el uso de los biofertilizantes (Dibut et al., 2004), y especial énfasis ha cobrado la utilización de bacterias rizosféricas del género Azotobacter, debido fundamentalmente al papel que éstas cumplen en la nutrición vegetal y su influencia en la actividad fisiológica de las plantas. Sus principales efectos están relacionados con la fijación biológica del nitrógeno, la solubilización de fosfatos, producción de antibióticos y de reguladores del crecimiento vegetal, entre otros (Ahmad, 2005; Adesemoye, 2009). El uso de estos biofertilizantes también constituye una alternativa para la obtención de productos cada vez más ecológicos y con menos efectos nocivos al medio ambiente que contribuyan a incrementar los rendimientos y disminuir el uso de fertilizantes químicos.
González et al. (1997), demostraron que la aplicación de Azotobacter chroococcum en el cultivo de piña cv. `Cayena Lisa serrana' en fase de aclimatización mejoraba el crecimiento y desarrollo de las plantas. Sin embargo, se requerían estudios donde se incorporaran cepas empleadas para la producción de biofertilizantes en el país de las cuales se tienen estandarizados los protocolos para su producción.
Teniendo en cuenta estos precedentes y la necesidad de incrementar la eficiencia del proceso de propagación de piña por métodos biotecnológicos donde se aplicaran productos nacionales, se desarrolló la presente investigación con el objetivo de determinar la efectividad de diferentes cepas de A. chroococcum de la colección de biofertilizantes del INIFAT en la aclimatización de plantas in vitro de piña cv. `Cayena lisa'.
MATERIALES Y MÉTODOS
El experimento se llevó a cabo en el Laboratorio de interacción planta-patógeno, y en las casas de cultivo (área de aclimatización) del Centro de Bioplantas, adjunto a la Universidad de Ciego de Avila, Cuba.
Material vegetal. Procedencia y características del cultivo
Se utilizaron para el experimento plantas in vitro de piña cv. `Cayena lisa' en fase de enraizamiento. Estas fueron propagadas por organogénesis en medio de cultivo MS (Murashige y Skoog, 1962) según el procedimiento descrito por Daquinta y Benega (1997). Las plantas se colocaron en frascos plásticos de 83 cm3 de capacidad que contenían como sustrato una mezcla de cachaza y suelo Ferralítico Rojo (SFR) en la proporción 1:1 (v/v). Los frascos se ubicaron en una casa de cultivo a una intensidad de luz de 458 µmol m-2 s-1. El riego utilizado fue a través de un sistema de nebulización automatizada durante 25 segundos cada 30 min, siguiendo las instrucciones brindadas por Yanes et al. (2001). Se mantuvo un control fitosanitario visual durante todo el tiempo que duró el experimento. No se aplicó fertilización química en los tratamientos. Se utilizó un diseño completamente aleatorizado.
Material microbiano
empleado como base para la obtención del biofertilizante
Se utilizaron seis cepas de la especie Azotobacter chroococcum: INIFAT 4, INIFAT 5, INIFAT 9, INIFAT 12, INIFAT 15, INIFAT 17, provenientes de la colección nacional de A. chroococcum del Instituto Nacional de Investigaciones Fundamentales en Agricultura Tropical (INIFAT).
La multiplicación de las cepas se realizó en medio de cultivo Dimargon (Patente 22178) según Dibut et al. (2000) y la inoculación se efectuó a razón del 8% (v/v) a partir de un preinóculo en Erlenmeyers de 500 ml que contenían 150 ml de medio de cultivo. Posteriormente, los frascos se colocaron en un agitador orbital (RETOMED) a 320C y 180 r.p.m. durante 72 horas, hasta lograr una concentración final de 1010 -1011 UFC.m l-1.
Determinación de la efectividad de las cepas
Los cultivos obtenidos con cada cepa para su aplicación fueron diluidos 1/10 con agua común, según la norma técnica establecida para la producción de Azotobacter (Dibut et al., 1992).
Se emplearon 40 plantas por cada cepa (seis) evaluada y el control (plantas sin inocular) para un total de 280 plantas.
En el momento de la siembra, las plantas fueron inoculadas por aspersión al sistema foliar y al sustrato, con ayuda de un asperjador manual (en las primeras horas de la mañana). Cada planta se inoculó con aproximadamente 2 ml m-2. Además, se realizaron aplicaciones periódicas de cada producto (seis cepas) cada 8 semanas (tres aplicaciones en 24 semanas) según el procedimiento descrito anteriormente y tomando como base la norma cubana antes mencionada.
Al cabo de 24 semanas (seis meses) se realizaron evaluaciones sobre diferentes indicadores del crecimiento y desarrollo de las plantas tales como: número de hojas por planta, masa fresca y masa seca de la planta (g), longitud de la raíz más larga (cm) y altura de la planta (cm) medida desde la base del tallo hasta el extremo de la hoja más larga. Además, se cuantificó el número de plantas vivas que se expresó como porcentaje de supervivencia.
A partir de los resultados de las variables evaluadas se seleccionó la cepa de mejores resultados con respecto al control.
Análisis bioestadístico
Previamente en todos los casos se comprobó la distribución normal y homogeneidad de varianza según las pruebas de Kolmogorov-Smirnov (5%) y Levene (5%), respectivamente El procesamiento estadístico de los datos se realizó a través de la prueba de Kruskal Wallis y la prueba de rango Student-Newman-Keuls. Se realizó la transformación de la variable número de hojas mediante la ecuación . Se empleó el utilitario estadístico SPSS (versión 11 para Windows) con un intervalo de confianza de 95%.
RESULTADOS Y DISCUSION
Determinación de la efectividad de las cepas
La correcta selección de cepas de microorganismos biofertilizadores en estudios agrobiológicos que implican su uso para mejorar la productividad de los cultivos resulta indispensable en los esquemas de investigación que se diseñan con estos fines (Dibut, 2000, Rojas et al., 2006). Muchos errores se han cometido en el diseño de obtención de inoculantes comerciales al emplear cepas de microorganismos procedentes de colecciones referenciadas o aisladas de agroecosistemas de forma arbitraria, o sea, sin realizar ensayos de selección que permitan disponer de la estirpe que se muestra como la más efectiva del total de microorganismos probados (Dibut et al., 2005). En el cultivo de la piña existe poca información sobre esquemas de selección de cepas de rizobacterias en función de la estimulación del crecimiento de esta especie vegetal.
En este estudio se comprobó que las cepas de A. chroococcum tuvieron efecto sobre las plantas in vitro de piña durante su aclimatización.
En todos los tratamientos se logró más de 70% de supervivencia con diferencias significativas con respecto al control (Figura 1A) con incrementos entre 12.5 y 30.0%. Los mayores valores se obtuvieron en los tratamientos donde se inocularon las cepas INIFAT 4, 5 y 17. La supervivencia de las plantas es un indicador que constituye un pilar fundamental en la eficiencia del sistema de producción de plantas por métodos biotecnológicos en este o cualquier otro cultivo de interés económico (Barriuso et al., 2008; Bartholomew, 2009).
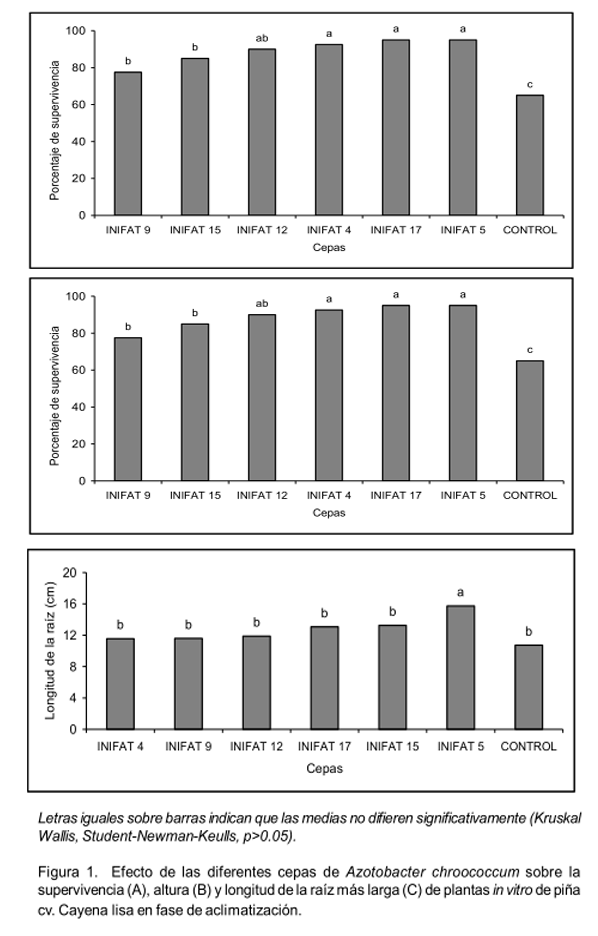
De igual forma, las plantas que fueron inoculadas con las cepas de A.
chroococcum alcanzaron una altura significativamente superior a las plantas
sin inocular
(Figura 1B), con la cepa INIFAT 5 se obtuvieron los mayores valores. Otros autores
han referido la efectividad cepas de Azotobacter sobre
el crecimiento de diferentes plantas. Por ejemplo, al aplicar la cepa INIFAT-17
de Azotobacter chroococcum a semilleros de cebolla (Allium cepa L.)
se logró un incremento en la altura de las posturas, lo que permitió
obtener plántulas aptas para el trasplante en un período de 7
días antes, en comparación con los semilleros que no recibieron
el efecto del biofertilizante (Dibut et al., 1992). En otros estudios
similares el efecto de la bacteria arrojó altos valores de estimulación
de este indicador en este mismo cultivo, con un aumento de la calidad de las
posturas obtenidas bajo condiciones de cepellón (Pulido, 2002).
Igualmente, en sistemas de viveros de frutales se ha logrado la obtención de plantas de mayor calidad y con mayor altura al inocular cepas bacterianas. Específicamente, en papaya (Carica papaya L.) se obtuvieron plantas más altas al aplicar Gluconacetobacter diazotrophicus, lo que definió la calidad de las posturas para su adaptación a la fase de campo (Dibut et al., 2004). Igualmente, estos resultados coinciden con los informados por Canbolat et al. (2006), al estudiar la efectividad de cepas de Bacillus sp. aisladas de la rizosfera de plantas de pimienta (Piper nigrum L.), y aplicadas en semilleros de plantas de cebada (Hordeum sativum L.), donde apreciaron que todas las cepas estimularon el crecimiento del cultivo.
El incremento de la altura de las plantas resulta de mucho interés ya que este indicador es uno de los que define su calidad para su plantación en campo según la metodología propuesta por Yanes et al. (2000) para la aclimatización de plantas in vitro de piña.
En este estudio se comprobó que sólo con la cepa INIFAT 5 aumentó significativamente la longitud de la raíz más larga de las plantas (Figura 1C).
En este tratamiento se incrementó en 36.0% la longitud del sistema radicular con respecto al tratamiento control, lo cual pudiera fundamentarse por la excreción de sustancias estimuladoras del crecimiento como las auxinas que juegan un papel decisivo en la rizogénesis. Algunos reguladores del crecimiento, producidas por microorganismos rizosféricos, pueden provocar un aumento de la superficie de la raíz, que permite a la planta una mayor absorción de nutrientes (Artursson et al., 2004; Narula et al., 2006).
Azotobacter chroococcum es una especie bacteriana cuyo hábitat fundamental es la rizosfera a través de la cual se establece una relación con la planta producto de los metabolitos y sustancias fisiológicamente activas que la misma excreta al medio. Este microorganismo al encontrarse en elevadas poblaciones en el suelo logra asociarse al sistema radical de algunas especies vegetales y ocasiona una aceleración del desarrollo y un aumento en volumen del sistema de raíces (Aquilanti et al., 2004).
Al ser la adaptación y supervivencia de las plantas obtenidas in vitro objetivo de la presente investigación, este resultado cobra gran interés ya que el indicador fundamental en el anclaje (establecimiento) de una planta al suelo o sustrato lo constituye el sistema radicular (Benizri y Amiaud, 2005). Al lograr un mejor enraizamiento de las plantas de piña se logran plántulas más vigorosas en la fase de aclimatización.
En otros cultivos de tales como cebolla y pimiento (Capsicum frutescens L.), ambos caracterizados por un pobre sistema radical, se obtuvieron beneficios en la estimulación de este indicador al aplicar cepas seleccionadas de Azotobacter chroococcum lo que finalmente se tradujo en el manejo exitoso de las posturas en semilleros y casas de cultivo (Pulido et al., 2003).
Otros estudios con la aplicación de reguladores del crecimiento (ej. ácido indolacético y citoquininas) provenientes de cultivos microbianos han permitido incrementar la superficie de la raíz, que permiten a la planta un mejor anclaje y una mayor absorción de nutrientes (De Salmone et al., 2001). En este caso las rizobacterias Azotobacter chroococcum y Azospirillum brasilense constituyen los microorganismos más empleados con estos fines (Jha et al., 2009). Para los viveros de plántulas de piña, el hecho de lograr una estimulación de este tipo en el sistema radicular abre nuevas perspectivas para la coinoculación con otros microorganismos rizosféricos o mezclas de nuevos sustratos que permitan obtener plántulas con mayor calidad.
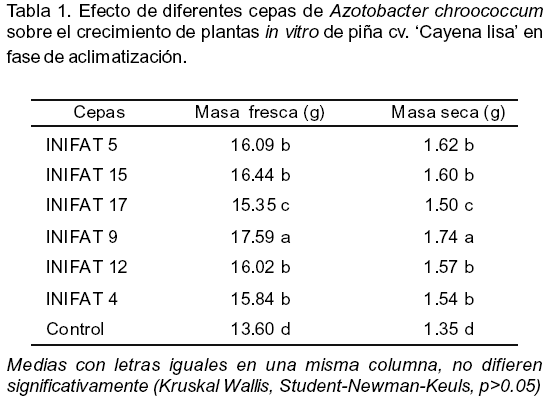
Tanto la masa fresca de las plantas, como la masa seca se incrementaron significativamente en los tratamientos inoculados con las cepas bacterianas (Tabla 1). La masa seca aumentó entre 11.0% (en presencia de la cepa INIFAT 17) y 28.0% (Cepa INIFAT 9). Ello sugiere que el metabolismo del cultivo se vio estimulado por la acción de la bacteria. Resultados similares refirieron autores como Cupull et al. (2006) en viveros de posturas de café (Coffea arabica L.) donde utilizaron siete cepas de este microorganismo y obtuvieron incrementos significativos en los indicadores morfológicos evaluados, entre ellos masa seca. Igualmente, Aseri et al. (2008) informaron resultados positivos en estos indicadores al realizar estudios de selección de cepas de esta especie bacteriana en varios cultivos donde se destaca la importancia de estimular este indicador (masa) por la influencia que tiene sobre el desarrollo del sistema planta en general.
Los valores obtenidos se corresponden con los encontrados por varios autores al evaluar el indicador biomasa en experimentos agrobiológicos donde se emplearon ésta y otras rizobacterias como Azospirillum brasilense, Burkholderia y Herbaspirillum sp. (Egamberdieva, 2008).
En el número de hojas no se observaron diferencias significativas entre el control y las tratamientos que recibieron el efecto de las diferentes cepas de A. chroococcum evaluadas. Sin embargo, a partir de observaciones visuales se comprobó que las hojas en el control eran de menor tamaño lo cual se corresponde con los menores valores de masa fresca y seca.
Al evaluar el efecto de rizobacterias y productos estimuladores del crecimiento vegetal de origen químico en diferentes especies vegetales, también se ha observado que no se estimula la formación de nuevas hojas. En ocasiones se forman una o dos hojas más en las plantas control pero con mucho menor desarrollo que en las plantas inoculadas, lo que a efecto de los procesos fotosintéticos y metabólicos en general, no representa ventajas medibles para el desarrollo del cultivo (Maynard y Hochmuth, 2007).
Cuando en las plantas se forman hojas con propiedades fotosintéticas más relevantes, este fenómeno influye notablemente sobre el desarrollo de la planta en general como sistema, es decir, en el vigor que es capaz de desarrollar, y por consiguiente, en la adaptación a cualquier sustrato o tipo de suelo (Babaloa, 2010).
Es por esto, que según la experiencia actual que se ha proyectado en este tipo de estrategia, resulta más conveniente el empleo de medios biológicos (biofertilizantes y bioestimuladores) que interactúan en equilibrio con la planta y estimulan de forma armónica los diferentes tejidos y órganos del vegetal. Además, garantizan una asociación altamente efectiva y persistente en el tiempo (Berg y Smalla, 2009).
Teniendo en cuenta los resultados en los diferentes indicadores evaluados se seleccionó la cepa INIFAT 5 para ser aplicada en la aclimatización de plantas de piña cv. `Cayena lisa' obtenidas por métodos biotecnológicos. Mediante este estudio se corroboró la capacidad de cepas de A. chroococcum de estimular el crecimiento vegetal y se abren perspectivas para su uso en este campo.
REFERENCIAS
Adesemoye, AO, Kloepper JW (2009) Plant_microbes interactions in enhanced fertilizer-use efficiency. Appl Microbiol Biotechnol 85:1_12
Ahmad, F, Ahmad I, Khan MS (2005) Indole Acetic Acid production by the indigenous isolates of Azotobacter and fluorescent Pseudomonas in the presence and absence of tryptophan. Turk. J. Biol. 29: 29-34
Aquilanti, L, Favilli F, Clementi F (2004) Comparison of different strategies for isolation and preliminary identification of Azotobacter from soil samples. Soil Biology and Biochemistry 36: 1475_1483
Artursson, V, Finlay R, Jansson J (2006) Interactions between arbuscular mycorrhizal fungi and bacteria and their potential for stimulating plant growth. Environmental Microbiology 8: 1_10
Aseri, GK, Jain N, Panwar J, Rao AV, Meghwal PR (2008) Biofertilizers improve plant growth, fruit yield, nutrition, metabolism and rhizosphere enzyme activities of pomegranate (Punica granatum L.) in Indian Thar Desert. Scientia Horticulturae 117:130_135
Babalola, O O (2010) Beneficial bacteria of agricultural importance. Biotechnol Lett 32:1559_1570
Barriuso, J, Solano BR, Fray RG, Camara M, Hartmann A, Manero FJG (2008) Transgenic tomato plants alter quórum sensing in plant growth-promoting rhizobacteria. Plant Biotechnol J. 6(5):442_452
Bartholomew, D (2009) MD2 pineapple transforms the world's pineapple fresh fruit export industry. Pineap News 16: 2_5
Benizri, E, Amiaud B (2005) Relationship between plants and soil microbial communities in fertilized grasslands. Soil Biology and Biochemistry 37: 2055_2064
Berg, G, Smalla K (2009) Plant species and soil type cooperatively shape the structure and function of microbial communities in the rhizosphere. FEMS Microbiol Ecol 68:1_13
Botella, JR, Fairbairn D J (2005) Present and future potential of pineapple biotechnology. Acta Hort. 622: 23_28
Canbolat, MY, Bilen S, Çakmakçý R, Ahin F, Aydin A (2006) Effect of plant growth-promoting bacteria and soil compaction on barley seedling growth, nutrient uptake, soil properties and rhizosphere microflora. Biol Fertil Soils 42: 350_357
Cupull, R S, Cupull MCS, Sánchez CE, Ortiz A A, González C F, Viva MF (2006) Efecto de siete cepas de la familia Azotobacteriaceae en la producción de posturas de Coffea arabica L. Centro Agrícola 33 (2): 5-9
Daquinta, M, Benega R (1997) Brief review of tissue culture in pineapple. Pineap. News 3: 7_9
De Salmone, IEG, Hynes RK, Nelson LM (2001) Cytoquinin production by plant growth promoting rhizobacteria and selected mutants. Canadian Journal of Microbiology 47(5): 404-411
Dibut, AB (2000) Obtención de un bioestimulador del crecimiento y el rendimiento vegetal para el beneficio de la cebolla (Allium cepa L.). Tesis de Doctor en Ciencias Agrícolas, Ministerio de la Agricultura, La Habana
Dibut, AB, Martínez R, Ortega M, García R, Tejeda G, Rodríguez J, Simanca ME, Fey Gobín L (2004) AZOMEG, nuevo biofertilizante mixto de amplio espectro de acción. EI efecto sobre el cultivo de la rosa. Memorias del Cuarto Encuentro Base de Agricultura Orgánica, ACTAF. La Habana
Dibut, AB, Martínez VR, González R (1992) Uso de biopreparados a base de Azotobacter en la agricultura cubana. Resultados y perspectivas. I Taller Internacional sobre biofertilización en los trópicos, pp. 25-27. La Habana
Dibut, AB, Ortega M, Martínez R, Fey L, Ríos Y (2005) Nuevos aislados de en cultivos de importancia económica para Cuba. Cultivos tropicales 25 (2): 13-17
Egamberdieva, D (2008) Plant growth promoting properties of rhizobacteria isolated from wheat and pea grown in loamy sand soil. Turk J Biol. 32(1): 9_15
Escalona, M, Lorenzo JC, González B, Daquinta M, González J L, Desjardins Y, Borroto CG (1999) Pineapple (Ananas comosus (L.) Merr.) micropropagation in temporary immersion systems. Plant Cell Rep. 18: 743_748
FAOSTAT (2011) FAO Statistic División. Helping to build a world without hunger. [En línea] En: FAO STATISTIC DIVISION. http://faostat.fao.org.: 567. Consultado 23 de febrero de 2012
González, R, Domínguez Q, Expósito LA, González JL, Hidalgo M (1997) Efectividad de ocho cepas de Azotobacter en la adaptación de vitroplantas de piña (Ananas comosus (L.) Merr.), cv Cayena Lisa. Acta Horticulturae 425: 277-281
Hernández A A, Muiño B L, Rosón C, Casola C, Porras A, López A (2010) Control químico de patógenos fungosos en piña de vivero. Fitosanidad 14 (1): 31-37
Hernández, M (2003) Obtención y caracterización de preparados enzimáticos de bromelina a partir de tallos de piña (Ananas comosus (L.) Merr) cosechados en Cuba. Tesis presentada en opción al grado científico de Doctor en Ciencias Biológicas. Universidad de Ciego de Avila. Centro de Bioplantas. Ciego de Avila
Jha, B, Thakur MC, Gontia I, Albrecht V, Stoffels M, Schmid M, Hartmann A (2009) Isolation, partial identification and application of diazotrophic rhizobacteria from traditional Indian rice cultivars. Eur J Soil Biol. 45(1):62_72
Maynard, DN, Hochmuth GJ (2007) Knott's handbook for vegetable growers. 5th ed. pp 65_68. Wiley Hoboken, New Jersey
Murashige, T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant 15:473-497
Narula, N., Deubel, A, Gans W, Behl RK, Merbach W (2006) Paranodules and colonization of wheat roots by phytohormone producing bacteria in soil. Plant Soil Environ 52: 119_129
Pulido, L, Medina N, Cabrera A (2003) La biofertilización con rizobacterias y hongos micorrízicos arbusculares en la producción de posturas de tomate y cebolla. Crecimiento vegetativo. Cultivos Tropicales 24(1): 45-50
Rohrbach, KG, Leal F, Coppens D' Ecckenbrugge G (2003) History, distribution and world production. En: DP Bartholomew, RE Paull, KG Rohrbach (Eds) The Pineapple. Botany, production and uses, pp. 1-12. CAB International. Roma
Rojas, M, Montoute M, Heydrich M (2006) Potencialidades de cepas de Gluconacetobacter diazotrophicus aisladas de diferentes ecosistemas para la estimulación del crecimiento vegetal. Congreso Científico INCA (15: 2006, nov 7-10, La Habana) Memorias. Instituto Nacional de Ciencias Agrícolas. La Habana
Van de Broek, A, Van Dommet A, Costacura A, Prensen E, De Zamaroczy M, Okon Y, Lambrecht M, Dosselere F. Keijers V, Vanderleyden J (1997) Azospirillum-plant associations: Genetics of indol-3-acetic acid biosíntesis and ammonium transport. Proceedings of the 11th International Congress in Nitrogen Fixation, Institute Pasteur, Paris
Wang, L, Uruu G, Xiong L, He X, Nagai C, Cheah T, Hu S, Nang Sipes S, Atkinson J, Moore H, Rohrbach G, Paull R (2009) Production of transgenic pineapple (Ananas comosus (L.)Merr.) planta via adventitious bud regeneration. In vitro Cell Dev. Biol. Plant 45: 113_121
Yanes, E, González J, Rodríguez R (2000) A technology of acclimatization of pineapple vitroplants. Pineapple News 7: 24
Yanes, E, González-Olmedo J L, Rodríguez R (2001) Empleo de giberelinas y fertilización foliar durante la aclimatización de vitroplantas de piña Cayena lisa cv. Serrana. Biotecnología Vegetal 1: 23-28
Recibido: 19-4-2012
Aceptado:
6-6-2012
Rayza
M. González Rodríguez.Centro
de Bioplantas. Universidad de Ciego de Ávila. Carretera Morón
km 9. Ciego de Ávila. CP 69 450. e-mail:
rgonzalez@bioplantas.cu
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
