Artículo original
Biotecnología Vegetal Vol. 12, No. 4: 203 - 210, octubre - diciembre,
2012
IISSN 2074-8647, RNPS: 2154 (Versión electrónica)
ISSN 1609-1841, RNPS: 0397 (Versión impresa)
Determinación de la concentración mínima inhibitoria de Glufosinato de amonio en callos organogénicos de Phaseolus vulgaris L cv. `CIAP7247F'
Determination of the minimal inhibitory concentration of Ammonium glufosinate in organogenic calli of Phaseolus vulgaris cv. `CIAP 7247F'
Idalmis Bermúdez-Caraballoso1, Raúl Collado1, Lourdes R. García1, Novisel Veitía1, Amanda Martirena1, Damaris Torres1, Carlos Romero1, Gert Angenon2. *Autor para correspondencia.
1Instituto de Biotecnología
de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní
km 5.5, Santa Clara, Villa Clara. Cuba. CP 54 830. e-mail: idalmis@ibp.co.cu
2Laboratory
of Plant Genetics. Vrije Universiteit Brussel. Belgium.
RESUMEN
Un sistema de selección eficiente es necesario para distinguir las células transformadas del tejido no transformado. El presente trabajo tuvo como objetivo determinar la concentración mínima inhibitoria del herbicida Glufosinato de amonio en callos organogénicos de Phaseolus vulgaris cv. `CIAP7247F', con el fin de usarlo como agente selectivo en el proceso de transformación genética. Se utilizaron fragmentos de callos de 4-5 mm de diámetro, en el segundo subcultivo de multiplicación. Se empleó el medio de cultivo de proliferación al que se le adicionaron diferentes concentraciones del herbicida (0.10, 0.20, 0.30, 0.40, 0.50 y 0.60 mg l-1). A las ocho semanas de cultivo se cuantificó el número de callos necrosados y se calculó el porcentaje de mortalidad. Además, se describieron las afectaciones provocadas por el agente selectivo en los callos. Todas las concentraciones de Glufosinato de amonio estudiadas produjeron necrosis en los callos de P. vulgaris cv. `CIAP7247F'. El aumento de la concentración de Glufosinato de amonio en el medio de cultivo de proliferación incrementó el porcentaje de callos necrosados. Con las concentraciones de 0.50 y 0.60 mg l-1 el 87.5% y 93.8% de los callos presentaron necrosis total, respectivamente. A partir de las observaciones realizadas se elaboró una escala descriptiva de grados para evaluar las afectaciones provocadas por el agente selectivo en los callos de frijol. Finalmente, se seleccionó 0.50 mg l-1 de Glufosinato de amonio como la concentración mínima inhibitoria, ya que más del 87% de los callos mostraron necrosis total a las ocho semanas de cultivo.
Palabras clave: agente selectivo, callos, frijol, gen bar.
ABSTRACT
An efficient selection system is necessary for distinguishing transformed cells of the untransformed tissue. This study aimed to determine the minimum inhibitory concentration of the herbicide Ammonium glufosinate in organogenic calli of Phaseolus vulgaris cv. CIAP 7247F, to use it as a selective agent in the process of genetic transformation. Fragments (4-5 mm) of proliferated calli after second subculture were used as explant. Callus proliferation medium with different concentrations of Ammonium glufosinate (0.10, 0.20, 0.30, 0.40, 0.50 and 0.60 mg l-1) was employed. At eight week of culture, the number of necrotic calli and the percentage of callus mortality were scored. Moreover, the damages caused by the selective agent in treated calli were described. All studied concentrations of Ammonium glufosinate produced necrosis in calli of P. vulgaris cv. CIAP7247F. The increase of Ammonium glufosinate concentration in the proliferation culture medium increased the percentage of necrotic calli. With concentrations of 0.50 and 0.60 mg l-1 of the selective agent, 87.5% and 93.8% of the calli showed complete necrosis respectivity. Base on previous observations a descriptive scale of degree was designed to evaluate the affectations provoked by the selective agent in common bean calli. Finally, 0.5 mg l-1 of Ammonium glufosinate was selected as the minimum inhibitory concentration because more than 87 percent of the calli necrotic within 8 weeks of cultivation.
Key words: bar gen, beans, callus, selective agent.
INTRODUCCIÓN
El frijol (Phaseolus vulgaris L.) es una fuente importante de proteína vegetal , especialmente en aquellas regiones del mundo en las cuales las proteínas de origen animal son muy escasas. A nivel mundial el frijol provee el 22% de las proteínas totales requeridas en la alimentación (Kwapata et al., 2012).
El mejoramiento genético convencional en leguminosas tiene una larga historia y se han obtenido un gran número de variedades mejoradas, sin embargo, existen varios inconvenientes que limitan su aplicación, entre ellas: desconocimiento de la biología de la especies, incompatibilidad con la especie silvestre que posee la característica deseada. En este sentido, la transformación genética puede ser considerada como una herramienta complementaria en las estrategias de mejoramiento genético (Varshney et al., 2009).
Las técnicas de transformación genética generalmente llevan implícito la transferencia de ácido desoxirribonucleico (ADN) de interés a pocas células. De esta manera, un requisito esencial es, disponer de un protocolo eficiente de regeneración de plantas unido a un sistema eficiente de selección de los tejidos transformados que facilite su recuperación (Karami et al., 2009).
Los genes marcadores de selección son necesarios para distinguir eficientemente las células transformadas de las no transformadas. Por ejemplo, los genes de resistencia a antibióticos y herbicidas han sido ampliamente usados para la selección en leguminosas transformadas genéticamente. Entre ellos se encuentran el gen de la neomicina fosfotransferasa (npt II); el de la higromicina fosfotransferasa (hpt); los genes de resistencia a herbicidas bar y pat (que codifican para la acetil fosfinotricina transferasa y confiere resistencia a biolaphos, fosfinotricina o Glufosinato de amonio) y genes que codifican para el herbicida acetolactatosintasa (ALS) (Miki et al., 2009).
La producción de transformantes quiméricos y escapes de material transgénico que sobrevive a la selección son los problemas más frecuentes que han sido descritos en la transformación de leguminosas (Hinchee et al., 1988; Popelka et al., 2006; Muruganantham et al., 2007; Saini et al., 2007; Thu et al., 2007).
El Glufosinato de amonio es un compuesto que se usa como herbicida no selectivo, que actúa sobre las partes verdes de la planta. Está registrado en más de 80 países bajo diferentes denominaciones, tales como: Basta®, Liberty®, Finale® y Rely® (Bayer CropScience, 2005). Este herbicida contiene intrínsecamente el isómero L- de la fosfinotricina, responsable de la actividad herbicida, que inhibe la acción de la enzima glutamina sintetasa, la cual interviene en la asimilación de nitrógeno y como resultado se alcanzan niveles tóxicos de amonio en las células de la planta. La resistencia a este herbicida ha sido desarrollada a través de un sistema de detoxificación. La enzima fosfinotricina acetil transferasa (PAT) codifica para los genes bar y pat que convierten el Glufosinato de amonio en N-acetil glufosinato que es un compuesto no fitotóxico a la planta (Kosky et al., 2010).
En el género Phaseolus existen pocos trabajos en los que se utilice el Glufosinato de amonio para la selección de tejidos transformados, solo Aragao et al. (2002) describen su empleo en la selección de brotes transformados por biobalística. La mayoría de los trabajos refieren el empleo de geneticina (De Clercq et al., 2002; Zambre et al., 2005) o de kanamicina (Aragao et al., 1993; Amugune et al., 2011). Por otra parte, en la literatura científica consultada no existe referencia del uso de este compuesto en la selección de callos organogénicos transformados, por lo que la determinación de la concentración mínima inhibitoria serían de gran valor práctico en trabajos de transformación genética de frijol.
Por todo lo antes expuesto, el objetivo del presente trabajo fue determinar la concentración mínima inhibitoria del herbicida comercial Glufosinato de amonio para usarlo como agente selectivo en el proceso de transformación genética de callos organogénicos de Phaseolus vulgaris cv. `CIAP 7247F'.
MATERIALES Y MÉTODOS
Material vegetal
Como material vegetal se utilizaron fragmentos de callos organogénicos de 4-5 mm de diámetro, en el segundo subcultivo de multiplicación. Para su obtención se siguió el procedimiento descrito por Collado et al. (2008).
Determinación de la concentración mínima inhibitoria del herbicida comercial
Glufosinato de amonio para la selección de callos organogénicos
de frijol
Para el establecimiento de los tratamientos se adicionaron diferentes concentraciones del herbicida comercial Glufosinato de amonio (0.10, 0.20, 0.30, 0.40, 0.50 y 0.60 mg l-1) al medio de cultivo para la proliferación de callos (Sales MS 100%, Vitamina B5, 0.05 mg l-1 de ácido indol acético (AIA), 0.1 g l-1 de mio-inositol, 0.04g l-1 de Tidiazuron, 2% de sacarosa, 6.0 g l-1 de agar). La solución inicial del herbicida se preparó a 15 mg ml-1, la cual se esterilizó por filtración y se añadió al medio de cultivo en la cabina de flujo laminar. El pH del medio de cultivo fue ajustado a 5.7 y se esterilizó en autoclave a 121ºC.
Los callos fueron colocados en placas de Petri que contenían medio de cultivo de proliferación de callos con las diferentes concentraciones del agente selectivo para un total de seis tratamientos y un control. Se realizaron cuatro ciclos de selección: dos en medio de cultivo de proliferación de callos y dos en medio de cultivo de inducción de brotes (sales MS 100%, Vitamina B5, 0.1g l-1 de mio-inositol, 2.25 g l-1 de 6- Bencilaminopurina (6- BAP), 30 g l-1 de sacarosa, 6.0 g l-1 de agar), de acuerdo con el procedimiento descrito por Collado et al. (2008) para la regeneración de plantas de frijol vía organogénesis indirecta. Cada 15 días se realizó el subcultivo por ocho semanas, correspondiendo con los ciclos de selección. Se utilizaron cinco placas de Petri de 9.0 cm de diámetro por tratamiento, con diez callos por placa.
Los callos fueron colocados en cámaras de crecimiento con fotoperíodo 16/8 horas luz/oscuridad a 26±2°C e intensidad luminosa de 68.3-72.81 µE m-2 s-1 provista por lámparas fluorescentes.
A las ocho semanas de cultivo se cuantificó el número de callos con necrosis y se calculó el porcentaje de mortalidad de los callos. Además, se describieron las afectaciones provocadas por el agente selectivo sobre estos y se confeccionó una escala de grados de afectación.
El análisis estadístico del porcentaje de mortalidad de los callos, así como el análisis descriptivo de las afectaciones provocadas por el agente selectivo se realizó con la ayuda del Paquete estadístico Statistic Packaged for Social Science (SPSS) versión 18.0 sobre Windows. Se utilizó un análisis de regresión lineal, así como la prueba de Kruskall Wallis previa comprobación de los supuestos de normalidad y heterogeneidad de varianza.
RESULTADOS Y DISCUSIÓN
Determinación de la concentración mínima inhibitoria del herbicida comercial Glufosinato de amonio para la selección de callos organogénicos de frijol
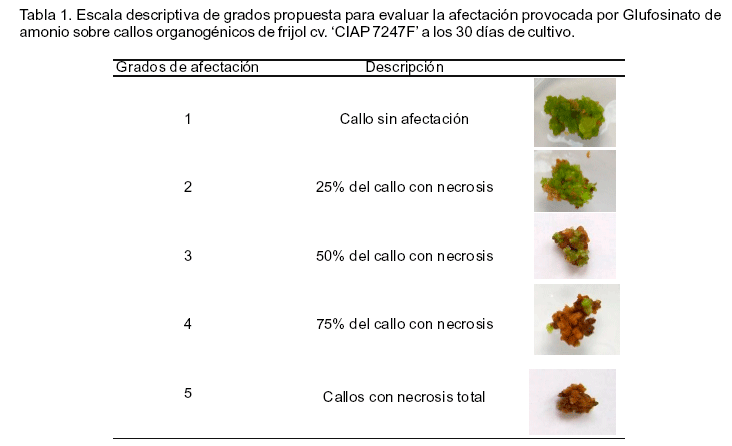
Todas las concentraciones de Glufosinato de amonio estudiadas produjeron necrosis sobre los callos de P. vulgaris cv. CIAP7247F en los medios de cultivo de proliferación de callos e inducción de brotes, respectivamente. Las afectaciones fueron progresando en la medida que aumentaron los ciclos de selección. Del total de los callos evaluados (300) el 30.4% presentaron entre el 25 y 50% del callo con necrosis (Figura 1a), el 42% presentó más de la mitad del callo con necrosis (Figura 1b) y el 26.8% presentó necrosis total (Figura 1c).
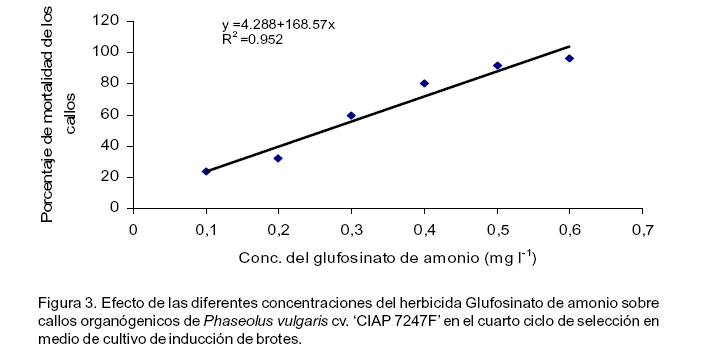
Las concentraciones del agente selectivo entre 0.10 y 0.40 mg l-1 produjeron necrosis en los callos que osciló entre el 25-50% de su superficie a necrosis total. Sin embargo, con las concentraciones de 0.50 y 0.60 mg l-1 del agente selectivo el 87.5% y 93.8% de los callos presentaron necrosis total, respectivamente (Figura 2).
Tomando en consideración los resultados de las afectaciones presentadas por los callos colocados en medio de cultivo con diferentes concentraciones del agente selectivo estudiado, se elaboró una escala descriptiva de grados. La escala consta de cinco grados de afectación donde el grado 1 se refiere a los callos sin afectaciones y el cinco a los callos con necrosis total (Tabla 1).
El análisis de regresión lineal indicó que a medida que aumentaron las concentraciones de Glufosinato de amonio se incrementó el porcentaje de mortalidad de los callos (Figura 3).
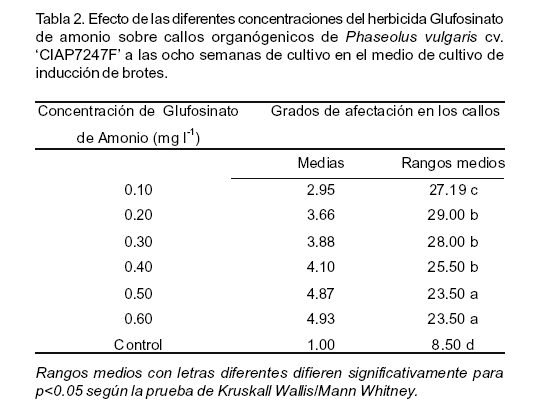
Con las concentraciones de 0.50 y 0.60 mg l-1 del agente selectivo se produjeron porcentajes de afectación superiores al 85%. Estos resultados se correspondieron con los grados de afectación provocados por el Glufosinato de amonio en los callos, según la escala de evaluación empleada. De igual forma se observó que las concentraciones de 0.50 mg l-1 y 0.60 mg l-1 del agente selectivo produjeron los mayores valores en el grado de afectación, con diferencias significativas con el resto de los tratamientos (Tabla 2).
De acuerdo con los resultados alcanzados se seleccionó la concentración de 0.50 mg l-1 de Glufosinato de amonio como la mínima inhibitoria, ya que a las ocho semanas de cultivo, produjo más del 85% de mortalidad en los callos organogénicos con predominio del grado de afectación cinco, que corresponde a la necrosis total con muerte del tejido.
Independientemente del método de transferencia de genes usado, el número de células que integran y expresan los transgenes introducidos de manera estable es pequeño. Por lo tanto se necesita que los genes marcadores de selección distingan eficientemente estas células, de una gran cantidad de células no transformadas. Los genes clásicos de resistencia a antibióticos y herbicidas (Miki y McHugh, 2004) han sido ampliamente usados para la selección en leguminosas genéticamente transformadas.
El Glufosinato de amonio es un herbicida no selectivo, que se convierte en la fitotoxina fosfinotricina (PPT) en las plantas. El herbicida actúa inhibiendo la enzima de la asimilación esencial de amonio: glutamina sintetasa (GS) (Sreeramanan et al., 2006).
En Phaseolus vulgaris no se ha informado deluso del Glufosinato de amonio como agente selectivo a nivel de callos organogénicos transformados genéticamente, solo en plantas completas en condiciones de invernadero y campo (Aragao et al., 2002). Estos autores utilizaron la biobalística como método de transformación en los cultivares ‘Olathe’ y ‘Carioca’ de frijol para desarrollar plantas resistentes a este herbicida. Se insertó el gen bar y su integración se confirmó por análisis de Reacción en Cadena de la Polimerasa (PCR) y Southern blot. Como resultado, encontraron dos eventos transgénicos, PHV119 y PHV122 del cultivar ‘Olathe’ (de un total de 11 607 entre los dos cultivares) que fueron resistentes a 500 g ha-1 de lufosinato, con síntomas no visibles comparado con frijol común no transgénico, bajo condiciones de invernadero. En el evento PHV119, las evaluaciones en campo mostraron plantas tolerantes a una concentración de 400 g ha-1 sin síntomas visibles. En este estudio no se definen los grados de las afectaciones en las plantas ante la presencia del agente selectivo, lo que dificulta su evaluación y la comparación con otros estudios en esta especie. Más recientemente, Kwapata et al. (2012) lograron la selección de brotes de Phaseolus vulgaris transformados por biobalística, con una concentración de Glufosinato de amonio de 4 mg l-1, en el medio de cultivo de regeneración y enraizamiento, así como en la germinación in vitro de semillas correspondientes a las progenies estudiadas. Dicha concentración fue ocho veces superior a la determinada en la presente investigación, pero con otro tipo de explante.
Sin embargo, no se dispone de referencias bibliográficas que informen sobre la utilización de un sistema que permita la evaluación de los diferentes niveles de afectación provocados por el Glufosinato de amonio en la transformación genética vía Agrobacterium tumefaciens de callos organogénicos de P. vulgaris, de ahí que la escala descriptiva de grados propuesta para la evaluación de dichas afectaciones, pudiera ser utilizada en otros protocolos de transformación.
Los resultados coinciden con los de Da Silva et al. (2004) quienes seleccionaron 0.5 mg l-1 como la concentración mínima inhibitoria en la transformación genética de callos y embriones somáticos de Coffea arabica cv. Catimor, en los cuales se observó necrosis en la totalidad de los callos cultivados.
Las concentraciones de Glufosinato de amonio empleadas fueron inferiores a las referidas por otros autores en otras leguminosas, pero utilizando otro tipo de explante. Por ejemplo, Khalafalla et al. (2005) en hojas de Vigna angulares; Adesoye et al. (2010) en Vigna unguiculata, quienes lograron En Phaseolus vulgaris no se ha informado del uso del Glufosinato de amonio como agente selectivo a nivel de callos organogénicos transformados genéticamente, solo en plantas completas en condiciones de invernadero y campo (Aragao et al., 2002). Estos autores utilizaron la biobalística como método de transformación en los cultivares `Olathe' y `Carioca' de frijol para desarrollar plantas resistentes a este herbicida. Se insertó el gen bar y su integración se confirmó por análisis de Reacción en Cadena de la Polimerasa (PCR) y Southern blot. Como resultado, encontraron dos eventos transgénicos, PHV119 y PHV122 del cultivar `Olathe' (de un total de 11 607 entre los dos cultivares) que fueron resistentes a 500 g ha-1 de glufosinato, con síntomas no visibles comparado con frijol común no transgénico, bajo condiciones de invernadero. En el evento PHV119, las evaluaciones en campo mostraron plantas tolerantes a una concentración de 400 g ha-1 sin síntomas visibles. En este estudio no se definen los grados de las afectaciones en las plantas ante la presencia del agente selectivo, lo que dificulta su evaluación y la comparación con otros estudios en esta especie.
Más recientemente, Kwapata et al. (2012) lograron la selección de brotes de Phaseolus vulgaris transformados por biobalística, con una concentración de Glufosinato de amonio de 4 mg l-1, en el medio de cultivo de una reducción del crecimiento de brotes y raíces de un 60% y un 80% respectivamente, cuando seleccionaron con 2 mg l-1. Todo parece indicar que el tipo de explante tiene influencia en la respuesta ante la presencia del herbicida en el medio de cultivo.
Teniendo en cuenta lo anteriormente expuesto, los resultados logrados pudieran estar relacionados con las características morfogenéticas del explante blanco utilizado, que responde de manera diferente al proceso de selección. Además, la determinación de la concentración mínima inhibitoria de Glufosinato de amonio como agente selectivo a nivel de callos organogénicos en el cultivar de frijol `CIAP 7247F', constituyen uno de los primeros pasos para el desarrollo de un programa de transformación genética, que culminará con la selección a nivel de planta completa en condiciones de campo.
REFERENCIAS
Adesoye, AI, Togun AO, Machuka J (2010) Transformation of cowpea (Vigna unguiculata L. Walp.) by Agrobacterium infiltration. Journal of Applied Biosciences 30: 1845-1860
Amugune, N, Anyango B, Mukiana, T K (2011) Agrobacterium-mediated transformation of common bean. African Crop Science Journal 19(3):137-147
Aragao, FJ, Sá MF, Davey MR, Brasileiro AC, Faria JC, Rech, EL (1993) Factors influencing transient gene expression in bean (Phaseolus vulgaris) using an electric acceleration device. Plant Cell Reports 12:483-490
Aragao, FJ, Vianna G, Albino M, Rech E (2002) Transgenic dry bean tolerant to the herbicide Glufosinate Ammonium. Crop Scienced 42:1248_1302
Bayer (2005) Technical information Glufosinate-ammonium. CropScience, p 38
Collado, RL, García RL, Angenon G, Torres D, Romero C, Bermúdez-Caraballoso I, Veitía NR, Ramirez M (2008) Organogénesis indirecta en Phaseolus vulgaris L. cv. CIAP7247. Biotecnología Vegetal 8(2): 81-86
Da Silva, FR, Yuffá AM (2004) Efecto del herbicida glufosinato de amonio en diferentes explantes de Coffea arabica cv. Catimor. Plant Mol Biol. 55: 211-217
De Clercq, J, Zambre M, Van Montagu M, Dillen W, Angenoon G (2002) An optimizad Agrobacterium- mediated transformation procedure for Phaseolus acutifolius A. Gray. Plant Cell Rep. 21: 333-340
Hinchee, MA, Connor-Ward, DV, Newell CA, Mc Donnell RE, Sato SJ, Gasser CS, Fischhoff DA, Re DB, Fraley RT, Horsch RB (1988) Production of transgenic soybean plants using Agrobacterium-mediated DNA transfer. Bio/Technology 6:915-921
Karami, O, Esna-Ashari M, Kurdistani GK, Aghavaisi B (2009) Agrobacterium-mediated genetic transformation of plants: The role of host. Biologia Plantarum 53:201-212
Khalafalla, MM, El-Shemy HA, Mizanur RS, Teraishi M, Ishimoto M (2005) Recovery of herbicide resistant Azuki bean [Vigna angularis (Wild.), Ohwi & Ohashi] plants via Agrobacterium-mediated transformation. African Journal Biotechnol 4(1):61-67
Kosky, RG, Reyes MV, Bermúdez-Caraballoso I, Chong-Pérez B, Alvarado-Capó Y (2010) Nuevo método para la selección rápida de plantas de banano (Musa spp. AAA cv. Grande naine) transformadas con el gen bar procedentes de campo, empleando el glufosinato de amonio. Rev. Colomb. Biotecnología XII(2):248-258
Kwapata, K, Nguyen T, Sticklen M (2012) Genetic transformation of common bean (Phaseolus vulgaris L.) with the GUS Color Marker, the bar herbicide resistance, and the Barley (Hordeum vulgare) HVA1 drought Tolerance Genes. International Journal of Agronomy 2012:1-8
Miki, B, Mc Hugh S (2004) Selectable marker genes in transgenic plants: applications, alternatives and biosafety. Journal of Biotechnology 107:193-232
Miki, B, Abdeen A, Manabe Y, MacDonald P (2009) Selectable marker genes and unintended changes to the plant transcriptome. Plant Biotechnology Journal 7: 211-218
Popelka, JC, Gollasch S, Moore A, Molvig L, Higgins TJ (2006) Genetic transformation of cowpea (Vigna unguiculata L.) and stable transmission of the transgenes to progeny. Plant Cell Report 25:304-312
Sreeramanan, S, Maziah M, Abdullah MP, Rosli NM, Xavier R (2006) Potential selectable marker for genetic transformation in banana. Biotechnology 5 (2): 189-197
Thu, TT, Dewaele E, Trung LQ, Claeys,M, Jacobs M, Angenon G (2007) Increasing lysine levels in pegeonpea (Cajanus cajan (L.) Millsp) seeds through genetic engineering. Plant Cell Tissue and Organ Culture 91:135-143
Varshuey, RK, Close TJ, Singh NK, Hoisington DA, Cook DR (2009) Orphan legume crops enter the genomics era. Current Opinion in Plant Biology 12: 202-210
Zambre, M, Goossens A, Cardona C, Van Montagu M, Terryn N, Angenon G (2005) A reproducible genetic transformation system for cultivated Phaseolus acutifolius (tepary bean) and its use to assess the role of arcelins in resistance to the Mexican bean weevil. Theor Appl Genet. 110: 914-924
Recibido: 17-7-2012
Aceptado: 29-9-2012
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.