Artículo Científico Biotecnología Vegetal Vol. 9, No. 1: 47 - 51, enero - marzo, 2009
ISSN 1609-1841 (Versión impresa)
ISSN 2074-8647 (Versión electrónica)
Influencia del medio de cultivo en el crecimiento y desarrollo de brotes de Phaseolus vulgaris L. regenerados in vitro
Lourdes R. García*, Raúl Collado, Idalmis Bermúdez-Caraballoso, Novisel Veitía, Damaris Torres, Carlos Romero. *Autor para correspondencia.
Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5. Santa Clara. Villa Clara. Cuba. CP 54 830. e-mail: lourdes@ibp.co.cu
RESUMEN
Para utilizar la transformación genética en el mejoramiento de los cultivos es indispensable contar con protocolos de regeneración de plantas que permitan a las células transformadas poder crecer, desarrollarse y regenerar plantas. Las leguminosas en general han permanecido recalcitrantes para la regeneración in vitro sobre todo la especie Phaseolus vulgaris L. Con el objetivo de lograr el crecimiento y elongación de brotes regenerados a partir de yemas adventicias de esta especie en el cv. CIAP 7247 se estudió la influencia de varios medios de cultivo propuestos en la literatura para las especies de Phaseolus, además de varias concentraciones de AG3 y de AgNO3. Los resultados mostraron que es indispensable el AG3 y el AgNO3 en los medios de cultivo para la elongación de brotes regenerados in vitro a partir de yemas múltiples en esta variedad. Las mayores concentraciones de este regulador del crecimiento permitieron obtener brotes elongados con longitudes medias que oscilaron entre 0.94 cm y 1.30 cm.
Palabras clave: elongación, cultivo de tejidos, frijol
ABSTRACT
In order touse genetic transformation for plant breeding is indispensable to have protocols of plants regeneration that enable transformed cells to grow, develop and regenerate new plants. Leguminous, in general, have remained recalcitrant to in vitro regeneration; mainly in Phaseolus vulgaris L.specie. The influence of several culture media, proposed in literature for Phaseolus species, and several concentrations of GA3 and AgNO3 in the culture media were studied aimed achieved growth and elongation of shoots regenerated from adventitious buds of this species in the cv. CIAP 7247. Results showed that the presence of GA3 and AgNO3 in the culture medium is indispensable for the elongation of in vitro shoots regenerated from adventitious buds in this variety. The biggest concentrations of this growth regulator enable to obtain shoots elongated tolongitudes oscillating between 0.94 cm to 1.30 cm.
Key words: beans, elongation, tissue culture
INTRODUCCIÓN
El frijol común (Phaseolus vulgaris) es ampliamente cultivado en el mundo por ser una valiosa fuente de proteínas, calorías, vitaminas y minerales, en la dieta de millones de personas en varias partes del planeta (Blair et al., 2006).
El mejoramiento genético de Phaseolus a través de los programas convencionales es limitado. Esta especie es susceptible a muchos microorganismos (virus, hongos y bacterias) (Gram y Vance, 2003), por lo que el empleo de la ingeniería genética para su mejoramiento es una opción que se ha manejado hace varios años (Guidolin, 2003). Esta estrategia requiere de sistemas de regeneración de plantas rápidos y eficientes (Arellano et al., 2008).
En Phaseolus la regeneración a través de organogénesis y embriogénesis somática ha sido descrita usando varios tipos de explantes (meristemos, pecíolo de hojas, ejes embrionarios, plántulas, embriones cigóticos) (Veltcheva et al., 2005; Varisai Mohamed et al., 2006; Chidananda y Maffei, 2008). Sin embargo, a pesar de algunos éxitos con la transformación genética (Russell et al., 1993; Aragao et al., 1996; Dillen et al., 1997; De Clercq et al., 2002; Zambre et al., 2005) las especies de Phaseolus han permanecido recalcitrantes para la regeneración in vitro y la transformación genética (Varisai Mohamed et al., 2006; Kanchiswamy y Maffei, 2008).
En artículo previo ha sido descrito un protocolo de regeneración de plantas vía organogénesis directa a partir de yemas adventicias (García et al., 2008) pero los brotes no superaron 1 cm de longitud. Por esta razón, la presente investigación fue iniciada con el objetivo de lograr la elongación de los brotes regenerados en P. vulgaris L. cv. CIAP 7247 para su posterior aclimatización.
MATERIALES Y MÉTODOS
Como material vegetal se emplearon brotes de P. vulgaris L. cv. CIAP 7247 regenerados a partir de yemas adventicias según el protocolo propuesto por García et al. (2008).
Los cultivos fueron incubados a 27 ± 2ºC en condiciones de luz solar en las cámaras de crecimiento.
Influencia del medio de cultivo
Con el objetivo de evaluar la influencia del medio de cultivo en la elongación de los brotes se probaron diferentes reguladores del crecimiento propuestos en la literatura científica para el desarrollo de brotes en Phaseolus.
Los medios de cultivo empleados se relacionan a continuación:
- Sales MS, sacarosa 30 g.l-1, mio-inositol 100 mg.l-1, vitaminas Heinz y Mee (1969), ácido Indolbutírico (AIB) 0.4 mg.l-1, ácido Giberélico (AG3) 1.38 mg.l-1 y Nitrato de plata (AgNO3) 2.12 mg.l-1 (Varisai Mohamed et al., (2006); para el desarrollo de brotes en Phaseolus angularis L.).
- Sales MS, sacarosa 30 g.l-1, mio-inositol 100 mg.l-1, vitaminas Heinz y Mee (1969)
- Sales MS, sacarosa 30 g.l-1, mio-inositol 100 mg.l-1, vitaminas Heinz y Mee (1969) y 6-Bencilaminopurina (6-BAP) 0.1 mg.l-1 (Zambre et al., (2005); para el desarrollo de brotes en Phaseolus acutifolius.
Influencia de la adición de AG3 y AgNO3
Una vez determinado el medio de cultivo que permitió los mejores resultados se realizó un segundo experimento para evaluar la influencia del AG3 y AgNO3 en la elongación de los brotes. Para esto se colocaron los explantes en diferentes medios de cultivo como se detalla a continuación:
1- Sales MS, sacarosa 30 gl-1, mio-inositol 100 mg.l-1, vitaminas Heinz y Mee (1969), AIB 0.4 mg.l-1, AG3
0.7 mg.l-1
2- Sales MS, sacarosa 30 gl-1, mio-inositol 100 mg.l-1, vitaminas Heinz y Mee (1969), AIB 0.4 mg.l-1, AG3 0.7 mg.l-1, AgNO3 2.12 mg.l-1
3- Sales MS, sacarosa 30 gl-1, mio-inositol 100 mg.l-1, vitaminas Heinz y Mee (1969), AIB 0.4 mg.l-1, AG3
1.4 mg.l-1
4- Sales MS, sacarosa 30 gl-1, mio-inositol 100 mg.l-1, vitaminas Heinz y Mee (1969), AIB 0.4 mg.l-1, AG3
1.4 mg.l-1 , AgNO3 2.12 mg.l-1
5- Sales MS, sacarosa 30 gl-1, mio-inositol 100 mg.l-1, vitaminas Heinz y Mee (1969), AIB 0.4 mg.l-1, AG3
3.0 mg.l-1
6- Sales MS, sacarosa 30 gl-1, mio-inositol 100 mg.l-1, vitaminas Heinz y Mee (1969), AIB 0.4 mg.l-1, AG3 3.0 mg.l-1, AgNO3 2.12 mg.l-1.
El pH de los medios de cultivo se ajustó a 5.7 previo a la esterilización en autoclave vertical. El AG3 fue esterilizado con filtro MILLIPORE 0.2 μm y añadido al medio de cultivo en cabina de flujo laminar.
Se colocaron 10 grupos de brotes por frasco de cultivo de 250 ml de capacidad que contenían 30 ml del medio de cultivo y se emplearon 10 frascos de cultivo por tratamiento. Los explantes fueron subcultivados cada dos semanas al mismo medio de cultivo y las evaluaciones se realizaron a los 60 días de cultivo.
Las variable evaluadas fueron el número explantes con brotes elongados por frasco, la longitud de los brotes alongados (cm), el número de brotes > 1 cm de longitud, el número de brotes > 3 cm de longitud y el número de los explantes vivos. Se definió como brote elongado aquel que desde la base hasta la inserción de la primera hoja alcanzara valores iguales o mayores a 0.5 cm de longitud.
Para los análisis estadísticos se realizaron análisis de varianza de clasificación simple o doble. Para determinar los grupos homogéneos y/o significativamente diferentes, a un nivel de 5.0%, se utilizó la prueba de rangos múltiples de Tukey o Dunnetts C, esta última cuando no se cumplieron los supuestos de homogeneidad de varianza.
RESULTADOS Y DISCUSIÓN
Influencia del medio de cultivo
Los mejores resultados para la elongación de los brotes se obtuvieron en el medio de cultivo que contenía AG3, AIB y AgNO3 (Figura 1). Aunque no se encontraron diferencias significativas para el porcentaje de explantes con brotes mayores de 5mm de longitud entre los tres tratamientos (50, 42 y 38% respectivamente) sí se encontraron cuando se evaluó el número de brotes mayores de 1cm de longitud entre el tratamiento 1 con el resto (Tabla 1). En este tratamiento, de los brotes elongados, el 65% eran mayores de 1 cm y el 16.4% eran mayores de 3 cm, mientras que en los demás medios de cultivo la mayoría de los brotes no rebasaron 1 cm de longitud. En el tratamiento 2 y 3 solo eran mayores de 1cm el 10.76% y el 16.4% de los brotes respectivamente.

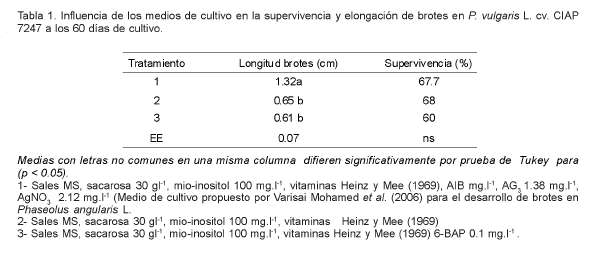
Cuando se evaluó la supervivencia de los explantes en los tres medios de cultivo estudiados no se encontraron diferencias significativas, lográndose valores que oscilaron entre 60 y 67.7% (Tabla 1).
Similares resultados fueron obtenidos en Phaseolus angularis por Varisai Mohamed et al. (2006), quienes refieren de 54.4 a 64% de brotes elongados, en dependencia de la variedad, cuando se empleó AG3 en el medio de cultivo, aunque la media de la longitud de los brotes fue de 5.5 cm. En el presente trabajo la media de la longitud de los brotes fue de 1.32 cm, lo cual pudiera estar determinado por la especie utilizada.
Uno de los problemas fundamentales que presentan los protocolos de regeneración de plantas que se han desarrollado para estas especies es la poca repetibilidad y la alta influencia que ejercen las variedades en el comportamiento in vitro, lo cual imposibilita extrapolar resultados de una a otra especie o variedad. En este trabajo no se observaron resultados favorables cuando se empleó 6-BAP en el medio de cultivo, para el desarrollo de los brotes, mientras que en la especie Phaseolus acutifolius se utilizó esta citoquinina para el crecimiento y desarrollo de brotes regenerados desde callos obtenidos en medios de cultivo con TDZ (Zambre et al., 2005).
Para lograr el crecimiento y elongación de los brotes que se regeneraron a partir de yemas adventicias formadas en medios de cultivo que contenían 1 mg.l-1 de TDZ. Fue indispensable la adición al medio de cultivo de AG3 y AIB. Es bien conocido que el TDZ suprime el crecimiento de los brotes de meristemos apicales y en contraposición induce una profusa formación de meristemos laterales (Tzitzikas et al., 2004). Además, se ha sugerido por numerosos investigadores que este regulador del crecimiento puede estar involucrado en la acumulación o síntesis de citoquininas (Capelle et al., 1983; Cruz de Carvalho et al., 2000).
Influencia de la adición AG3 y AgNO3
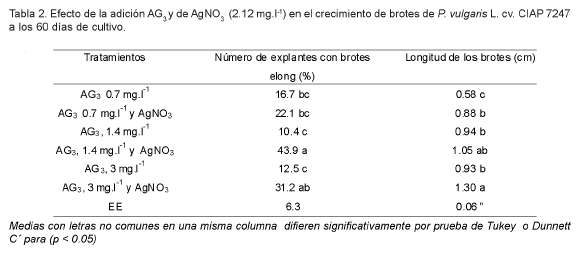
Cuando se estudiaron las diferentes concentraciones de AG3 y la presencia o no del AgNO3 en el medio de cultivo se encontró interacción entre estos dos factores cuando se evaluaron las variables explantes con brotes elongados y la longitud de los brotes. Sin embargo, cuando se analizó el número de brotes por explante no se encontró interacción entre estos dos factores por lo que se muestran los resultados independientes.
Como se observa en la tabla 2 los mejores resultados se obtuvieron cuando se añadieron las concentraciones más elevadas de AG3 (1.4 y 3 mg.l-1) y AgNO3 al medio de cultivo tanto para el número de explantes con brotes elongados como para la longitud de los brotes (Tratamientos 4 y 6). Por lo que se seleccionó el tratamiento en 1.4 mg.l-1 de AG3 y 2.12 mg.l-1 AgNO3.
Las diferentes concentraciones de AG3 no influyeron en el número de brotes elongados por explante. Sin embargo, cuando se utilizó AgNO3 en el medio de cultivo se obtuvo 1.89 brotes elongados por explante como promedio, valor que difirió signifcativamente del obtenido en los medios de cultivo que no lo contenían (0.83).
Estos resultados son similares a los descritos por Olhoft et al. (2003) quienes estudiaron el efecto del AG3, y zeatina sobre la elongación y crecimiento en Glycine max . Ellos también notaron que el AgNO3 incrementó la producción de brotesdurante las dos primeras semanas de cultivo en el medio de cultivo de elongación. Igualmente, en Pistacia versa la mayor frecuencia de regeneración (100%) se obtuvo cuando el medio de cultivo contenía 1.8 mg.l-1 de 6-BAP, 0.07 mg.l-1 de AG3 y 4-8 mg.l-1 de AgNO3 en combinación (Ozden-Tokatli et al., 2005).
Cruz de Carvalho et al. (2000) encontraron que cuando las citoquininas fueron usadas solas en el medio de cultivo el 63.8% de los brotes desarrollaron con una longitud entre 1.3 y 1.7 cm, mientras cuando se utilizaron en combinación con el AgNO3, el 100% de los brotes se desarrollaron entre 1.8 y 2.9 cm de longitud.
REFERENCIAS
Aragao FJL, Barros LMG, Brasileiro ACM, Ribeiro SG, Smith FD, Sanford JC, Faria JC, Rech EL (1996) Inheritance of foreign genes in transgenic bean (Phaseolus vulgaris L.) co-transformed via particle bombardment. Theor Appl Genet 93: 142-150
Arellano, J, Fuentes S I, Castillo-España P, Hernández G (2008) Regeneration of different cultivars of common bean (Phaseolus vulgaris L.) via indirect organogenesis. Plant Cell Tiss Organ Cult 1: 11-18
Blair, MW, Caldas GV, Avila P, Lascano C (2006) Tannin content of commercial classes of common bean. Annu Rep Bean Improv Coop 49:151152
Capelle SC, Mok DWS, Turner JE (1983) Effects of thidiazuron on cytokinin autonomy and the metabolism of N6 adenosine in callus cultures of Phaseolus lunatus L. Plant Physiol 73: 796-802
Cruz de Carvalho MH, Van Lê B, Zully-Fodil Y, Pham Thi AT, Thanh Van KT (2000) Efficient whole plant regeneration of common bean (Phaseolus vulgaris L.) using thin-cell-layer culture and silver nitrate. Plant Science 159 (2): 223 232
De Clercq J, Zambre M, Van Montagu M, Dillen W. Angenon G (2002) An optimised Agrobacterium-mediated transformation procedure for Phaseolus acutifolius A Gray (Tepary bean). Plant Cell Rep. 21: 333-340
Dillen W, De Clercq J, Goznes A, Van Montagu M, Angenon G (1997) Agrobacterium-mediated transformation of Phaseolus acutifolius A Gray. Theoretical and Applied Genetics. 94 (2): 151-158
García, L, Collado-López R, Bermúdez-Caraballoso I, Veitía N, Torres D, Romero C (2008) Regeneración de plantas vía organogénesis directa en Phaseolus vulgaris L. Biotecnología Vegetal 8 (2): 109-114
Graham PH, Vance CP (2003) Legumes: importance and constraints to greater use. Plant Physiol 131: 872-877
Guidolin AF (2003) Regeneraçao de plantas de Phaseolus vulgaris L. a partir de calos e transformaçao genética via
Agrobacterium. Tesis en opción al grado de Doctor en Ciencias. PIRACICABA, Sâo Paulo, Brazil
Heinz, DJ, Mee GWP (1969) Plant differentiation from callus tissue of Saccharum spp. Crop. Science 9 (3): 346 348
Kanchiswamy, CN, Maffei M (2008) Callus induction and shoot regeneration of Phaseolus lunatus L. cv. Wonder Bush and cv. Pole Sieva. Plant Cell, Tissue and Organ Culture 92: 239 242
Nagamangala KC, Maffei M (2008) Callus induction and shoot regeneration of Phaseolus lunatus L. cv. Wonder Bush and cv. Pole Sieva Plant Cell, Tissue and Organ Culture 92 (2): 239-242
Ozden-Tokatli Y, Ozudogru EA, Akcin A (2005) In vitro response of pistachio nodal explants to silver nitrate. Scientia Horticult 106: 415-426
Russell DR, Wallace KM, Bathe JH, Martinell BJ, McCabe DE (1993) Stable transformation of Phaseolus vulgaris via electric-discharge mediated particle acceleration. Plant Cell Rep 12: 165-169
Olhoft PM Flagel LE, Donovan M, Somers DA (2003) Efficient soybean transformation using hygromycin B selection in the cotyledonary-node method. Planta 216: 723-735
Tzitzikas EN, Bergervoet M, Raemakers K, Vincken JP, Lammeren AV, Visser RGF (2004) Regeneration of pea (Pisum sativum L.) by a cyclic organogenic system. Plant Cell Rep 23: 453-460
Varisai Mohamed M, Jih-Min S, Toong-Long J, Chang-Sheng W (2006) Organogenesis of Phaseolus angularis L.: high efficiency of adventitious shoot regeneration from etiolated seedlings in the presence of N6-benzylaminopurine and thidiazuron. Plant Cell Tiss Organ Cult 86: 187-199
Veltcheva MR, Svetleva DL (2005) In vitro regeneration of Phaseolus vulgaris L. via organogenesis from petiole explants. J Central European Agric 6: 53-58
Zambre M, Goossens M, Cardona C, Van Montagu M, Terryn N, Angenon G (2005) .A reproducible genetic transformation system for cultivated Phaseolus acutifolius (tepary bean) and its use to assess the role of arcelins in resistance to the Mexican bean weevil. Theor Appl Genet 110: 914-924
Copyright (c) 2016 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
