Artículo Científico Biotecnología Vegetal Vol. 8, No. 2: 91 - 98, abril - junio, 2008
ISSN 1609-1841 (Versión impresa)
ISSN 2074-8647 (Versión electrónica)
Obtención de callos con estructuras embriogénicas de Stevia rebaudiana Bert. en medios de cultivo semisólidos
Mario Kryvenki1*, Rafael G. Kosky2, Diego Guerrero1, Martín Dominguez1, Maritza Reyes 2 * Autor para correspondencia.
1Estación Experimental Agropecuaria INTA Cerro Azul. Ruta Nacional 14 km 1085 CC 10. CP 3 315, L. N. Alem, Misiones, Argentina. e-mail: mariok@cerro.inta.gov.ar
2Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5. Santa Clara, Villa Clara, Cuba. CP 54 830
RESUMEN
El ajuste de un protocolo eficiente de embriogénesis somática en Stevia rebaudiana Bertoni serviría de apoyo a programas de mejoramiento genético por transformación genética, sobre lo cual existen hasta el momento muy pocos resultados en esta especie. Por estas razones, el objetivo de este trabajo fue obtener callos con estructuras embriogénicas de clones de yerba dulce a partir de plantas in vitro. Para la formación de callos se estudiaron variables como: el tipo de explante, condiciones de incubación e influencia del genotipo. Se empleó el medio de cultivo MS con diferentes reguladores de crecimiento solos o en combinación (2,4-D; 6-BAP; TDZ). Los callos fueron multiplicados en los mejores medios de cultivo y posteriormente fueron subcultivados a medios de cultivo que contenían 2,4-D o TDZ con 40 y 60 g.l-1 de sacarosa para inducir la formación de masas proembriogénicas. Se logró la formación de callos, luego de 45 días de cultivo en la oscuridad en medios de cultivo con 2.26 μM de 2,4-D y 2.22 μM de 6-BAP ó 1.13 μM de 2,4-D y 0.45 μM de TDZ, con el empleo de explantes foliares de plantas in vitro de yerba dulce. La multiplicación fue posible realizarla en los mismos medios de cultivo de formación de callos. Al subcultivarlos a medios de cultivo con 0.45 μM de 2,4-D más la adición de 40 g.l-1 de sacarosa se obtuvo la mayor cantidad de callos con desarrollo de masas proembriogénicas luego de 45-50 días de cultivo.
Palabras clave: cultivo in vitro, explantes foliares, yerba dulce
ABSTRACT
The adjustment of an efficient protocol of somatic embryogenesis in Stevia rebaudiana Bertoni to support programs of genetic breeding by genetic transformation is necessary. Few results are registered up to the moment in this species. The objective of this work was to obtain calli with embryogenic structures from clones of Stevia in vitro plants. Different variables were studied for the formation of calli: explants type, incubation conditions and genotype influences. Culture medium MS with different growth regulators (2,4-D; 6-BAP; TDZ) was used. These were used alone or in combination. Calli were multiplied in the best culture media. Afterwards they were subcultured to culture medium containing 2,4-D or TDZ with 40 and 60 g.l-1 of sucrose to induce proembryogenic mass formation. Calli formation was achieved after 45 days of culture in darkness and in culture media with 2.26 μM 2,4-D and 2.22 μM 6-BAP or 1.13 μM 2,4-D and 0.45 μM of TDZ. Foliar explants of in vitro plants of Stevia were used. Multiplication was achieved in the same culture media for calli formation. The largest amount of calli with development of proembryogenic mass was obtained when subcultures to culture medium with 0.45 μM 2,4-D adding 40 g.l-1 of sucrose was carried out after 45-50 days of culture.
Key words: in vitro culture, leaf explant, sweet herb
INTRODUCCIÓN
Stevia rebaudiana Bertoni es una especie originaria del Paraguay donde se le conoce con el nombre guaraní Kaa-He-é (yerba dulce), debido al intenso sabor dulce presente en sus hojas y tallos originado en la síntesis natural de una serie de glicósidos diterpénicos con un aglucón común, el steviol. El componente principal de las plantas nativas y de las plantaciones desarrolladas en la región es el Esteviósido, 300 veces más dulce que la sacarosa. En segundo lugar, habitualmente se encuentra el Rebaudiósido A, 400 veces más dulce que la sacarosa, al que le siguen en orden de importancia el Rebaudiósido C, el Dulcósido A (ambos de bajo poder edulcorante), así como trazas de Rebaudiósido D y E (Kolb et al., 2001).
El uso principal de esta especie es el aislamiento y obtención industrial de los cristales de los glicósidos para su utilización como endulzantes naturales dietéticos, debido a que su consumo no aporta calorías al organismo. También se pueden utilizar las hojas secas de la planta para endulzar alimentos, como antimicótico, estimulante, bactericida, hipertensor, vasodilatador, entre otros. Otros estudios han mostrado que el extracto de Stevia ayuda en la normalización de los niveles de insulina y azúcar en la sangre en pacientes diabéticos (Geuns, 2003).
A nivel mundial varios investigadores han incursionado en el cultivo de tejidos de la yerba dulce, pero fundamentalmente se refieren trabajos de micropropagación a partir de explantes como: ápices caulinares, segmentos nodales, hojas (Tamura, 1984; Akita et al., 1994; Sivaram et al., 2003) y anteras (Flachsland et al., 1996; Ariza, 2007). Sobre la inducción de embriogénesis somática se informan pocos trabajos (Bespalhok et al., 1993; 1997) y solamente uno presenta un protocolo ya terminado, pero en condiciones de laboratorio (Jones et al., 2003).
El ajuste de un protocolo eficiente de embriogénesis somática serviría de apoyo a cualquier programa de mejoramiento genético que se propusiera para esta especie, tanto para automatizar el proceso de micropropagación de plantas élite (a través del uso de biorreactores), como su aplicación en futuros trabajos de mejoramiento genético por transformación genética, sobre la cual existen hasta el momento muy pocos resultados en esta especie. Por estas razones, el objetivo de este trabajo fue obtener callos con estructuras embriogénicas de clones de yerba dulce a partir de plantas in vitro.
MATERIALES Y MÉTODOS
El presente trabajo fue realizado en el laboratorio de cultivo de tejidos vegetales de la Estación Experimental Agropecuaria del INTA Cerro Azul, Misiones, Argentina.
Para los diferentes experimentos se utilizaron como explantes ápices, segmentos nodales y hojas de plantas in vitro de yerba dulce de los clones 1, 3 y 13, las que se encontraban en el tercer a quinto subcultivo en cámara de cultivo con luz artificial, con 16 h de fotoperíodo y una densidad de flujo de fotones fotosintéticos de aproximadamente 40.5 μmol.m-2.s-1.
En todos los experimentos se trabajó con el medio de cultivo basal completo propuesto por Murashige y Skoog (1962), compuesto por las sales macronutrientes, micronutrientes, vitaminas y aminoácidos, mio-inositol (MS) y Agar (Britania) a razón de 6 g.l-1. El pH siempre fue ajustado a 5.8 previo a la esterilización.
Como contenedor para los medios de cultivo se utilizaron tubos de vidrio de 55 ml de capacidad y frascos de 200 ml de capacidad, los que luego de recibir la cantidad de medio de cultivo (10 ml para los tubos y 25 ml para los frascos), fueron cubiertos con papel aluminio para su posterior esterilización en autoclave a 1.2 kg.cm-2 de presión y 121 ºC durante 15 minutos para los tubos y 20 minutos para los frascos.
Análisis estadístico
En los experimentos llevados a cabo en el laboratorio se aplicó una lectura de las observaciones completamente aleatoria. Para el análisis estadístico de los resultados de cada experimento se realizaron pruebas no paramétricas de Kruskall Wallis. Los grupos homogéneos y/o significativamente diferentes fueron hallados a partir de la comparación de rangos de medias a través de la prueba de Mann Whitney para un nivel de significación que varió del 95% al 99.5%, dependiendo de las características del experimento. El procesamiento estadístico de los resultados se realizó con el programa computacional SPSS 13.0.
Formación de callos
Influencia del tipo de explante, condiciones de cultivo y genotipos
Este experimento contempló la evaluación de tres tipos de explantes: ápices, hojas y segmentos nodales. Los explantes fueron colocados en tubos de ensayo que contenían el medio de cultivo MS con 2.26 μM de ácido 2,4 diclofenoxiacético (2,4-D), 30 g.l-1 de sacarosa y 6 g.l-1 de agar.
El cultivo se realizó bajo dos condiciones, en oscuridad total o en luz artificial con 16 h de fotoperíodo y con una densidad de flujo de fotones fotosintéticos de 40.5 μmol.m-2.s-1 aproximadamente y 27 ± 2ºC.
Este experimento se realizó dos veces en el tiempo y se utilizaron 20 repeticiones por tratamiento. Las evaluaciones que se realizaron luego de 45 días de cultivo fueron las siguientes: tiempo de formación del callo (días), tipo de callo (friable, nodular, acuoso), color del callo y número de explantes que desarrollaron callo (%). También se evaluó el área del explante que formó callo según la escala de 5 grados:
1- Explante muerto,
2- Explante vivo sin formación de callo,
3- 25% del explante con formación de callo,
4- 50% del explante con formación de callo,
5- 100 del explante con formación de callo.
Efecto de los reguladores del crecimiento en la formación de callos
El objetivo de este experimento fue determinar la mejor combinación de reguladores de crecimiento para la formación de callos a partir de hojas de plantas in vitro del clon 3.
Efecto de la adición de 2,4-D y 6-BAP
Como medio de cultivo se utilizó el MS, con la siguientes concentraciones de 2,4-D: 0, 1.13, 2.26, 4.52, 9.05 μM solo o en combinación con 0.44 μM y 2.22 μM de 6-bencilaminopurina (6-BAP). En todos los casos a los medios de cultivo se le adicionaron 30 g.l-1 de sacarosa y 6 g.l-1 de agar y fueron distribuidos en tubos de vidrio de 55 ml de capacidad a razón de 10 ml por tubo.
Las evaluaciones fueron: tiempo de formación del callo (días), tipo de callo (friable, nodular, acuoso), color del callo y número de explantes que desarrollaron callo (%), lo que fue registrado a los 45 días posteriores al cultivo. Asimismo, el desarrollo de callos fue cuantificado por apreciación de su tamaño según la escala descrita anteriormente.
Efecto de la adición de 2,4-D y TDZ
Como medio de cultivo se utilizó el MS, con las siguientes concentraciones de 2,4-D: 0, 1.13, 2.26, 4.52, 9.05 μM en combinación con 0.45 μM y 2.27 μM de Tidiazurón (TDZ). En todos los casos a los medios de cultivo se les adicionaron 30 g.l-1 de sacarosa y 6 g.l-1 de agar, fueron distribuidos en tubos de vidrio de 55 ml de capacidad a razón de 10 ml por tubo.
Las evaluaciones fueron: tiempo de formación del callo (días), tipo de callo (friable, nodular, acuoso), color del callo y número de explantes que desarrollaron callo (%), lo que fue registrado a los 45 días posteriores al cultivo. Asimismo el desarrollo de callos fue cuantificado por apreciación de su tamaño según la escala descrita anteriormente.
Inducción de Embriogénesis Somática
El objetivo de este experimento fue evaluar el efecto de las altas concentraciones de sacarosa en combinación con bajas concentraciones del
regulador de crecimiento 2,4-D o en ausencia de este y en presencia de la citoquinina TDZ, para inducir la embriogénesis somática a partir de los callos obtenidos del cultivo de hojas de plantas in vitro. Para ello se conformaron cuatro tratamientos:
1- MS + 0.45 μM 2,4-D + 40 g.l-1 de sacarosa,
2- MS + 0.45 μM 2,4-D + 60 g.l-1 de sacarosa,
3- MS + 0.45 μM TDZ + 40 g.l-1 de sacarosa,
4- MS + 0.45 μM TDZ + 60 g.l-1 de sacarosa.
A los 45 días del cultivo se procedió a registrar las siguientes evaluaciones: número de callos con formación de estructuras proembriogénicas y tiempo de formación (días).
RESULTADOS Y DISCUSION
Formación de callos
Influencia del tipo de explante, condiciones de cultivo y genotipos
Se logró la formación de callos a partir del cultivo de los distintos explantes obtenidos de los tres clones y en las dos condiciones de incubación a las que fueron sometidos, no obstante se registraron diferencias entre los tratamientos.
En la tabla 1 se puede observar que los mayores valores se obtuvieron a partir del cultivo de segmentos nodales del clon 13 incubados en oscuridad y del cultivo de ápices del mismo clon incubados tanto en cámaras de cultivo con luz artificial como en oscuridad, en donde el 100% de los explantes formaron callos. También el explante hoja del clon 3 incubado en oscuridad arrojó un 95% de los cultivos con formación de callo.

Según Parrot (2002), el tipo de células presentes en el explante determina el tipo de respuesta en la especie en estudio. Si el explante posee células embriogénicas basta solamente un estímulo para que las mismas se dividan para formar un embrión, originando lo que se conoce como embriogénesis somática directa. Sin embargo, cuando el explante se trata de un tejido ya desarrollado en donde las células perdieron su carácter embriogénico, éstas pueden dividirse mitóticamente bajo condiciones que terminan induciendo un estado embriogénico, con lo que se genera un callo que adquiere embriogenicidad y consecuentemente la embriogénesis es indirecta. Los tres explantes evaluados en este experimento no evidenciaron embriogénesis directa, si se ha obtenido desarrollo de tejido calloso sin la presencia de tejido embriogénico.
Estos resultados no concuerdan con los referenciados por Bespalhok et al. (1993), quienes mencionan haber logrado el desarrollo de embriones somáticos directamente a partir del cultivo de hojas in vitro en medio de cultivo MS con 10 ó 25 ìM de 2,4-D y 1 ìM de Benciladenina, sin haber pasado por una etapa previa de formación de callo. Sin embargo, mencionan que no lograron su maduración y correcta germinación. Solo desarrollaron raíces cuando fueron puestos a germinar. En el presente trabajo el cultivo de los diferentes explantes de yerba dulce sobre el medio de cultivo MS con 2.26 μM de 2,4-D produjo desarrollo de tejido calloso en todos los casos. Se observaron estructuras nodulares que en algunos cultivos terminaron en una raíz, aspecto que es negativo en esta fase en la que se busca obtener callos con características embriogénicas.
Jones et al. (2003) mencionan resultados similares a los de este trabajo cuando cultivaron segmentos foliares de plantas in vitro sobre el medio de cultivo MS con 2.26 μM de 2,4-D y observaron que un 94% de los explantes se formaron callos.
Según Kosky (1998) y Radice (2004) en todas las fases del cultivo de callo el genotipo juega un papel importante para llegar a obtener éxito, por lo cual se debe siempre trabajar durante la investigación con 2 a 3 genotipos a la vez. Por esta causa no es posible generalizar metodologías o protocolos de trabajo. Como puede observarse en los resultados de la tabla 1, la obtención de callos a partir del cultivo de diferentes explantes de yerba dulce estuvo muy influida por el genotipo. Los cultivos del clon 3 fueron los que mostraron los mejores callos, en especial los originados a partir del explante hoja incubados en oscuridad. Estos callos fueron de tamaño mediano a grande, friables, con muchas estructuras globulares en las márgenes de la lámina foliar.
Las condiciones ambientales en las que se incuba un explante también tienen influencia en los resultados, más si como componente de los medios de cultivo figuran las auxinas, ya que estas tienen la particularidad de ser afectadas por la luz que causa un efecto destructor en el sistema enzimático que convierte el triptófano en ácido indolacético, fenómeno conocido como fotooxidación (Vázquez y Torres, 1995). Es por ello, que los explantes de yerba dulce que fueron incubados en oscuridad en general respondieron mejor que los que se cultivaron en cámaras con luz (Tabla 1).
Por todo lo expuesto, éste experimento permitió seleccionar al explante hoja del clon 3 incubado en oscuridad como las mejores condiciones para la formación de callos a partir de plantas in vitro de la yerba dulce.
Efecto de los reguladores del crecimiento en la formación de callos
Efecto de la adición de 2,4-D y 6-BAP
A excepción del tratamiento 1 (control) en todos los demás se observó la formación de callo (Figura 1). En general, se observó una mejoría con la adición de 6-BAP al medio de cultivo en donde se registraron los mejores porcentajes de explantes con formación de callos (tratamientos 6, 10, 11 y 12). Además, el efecto favorable del suministro de 6-BAP se observó en el incremento del tamaño de los callos (Tabla 2) y en el aspecto en general. Se logró obtener callos friables, con estructuras nodulares o globulares, la coloración pasó de ser pardo a presentar sectores del mismo con coloraciones más amarillas y blancas (Figura 2).
Se observó también que en los tratamientos que incluían la combinación con el regulador de crecimiento 6-BAP, el inicio en la formación de callo se registró durante la tercera semana de cultivo, en contraposición de lo que ocurre en los tratamientos con 2,4-D solo, en donde el inicio de la formación del callo se produce durante la cuarta semana del cultivo.
Bespalhok (1997) referencia un trabajo donde obtiene callos embriogénicos a partir del cultivo de explantes florales de yerba dulce en medio de cultivo MS con diferentes concentraciones de 2,4-D y Kinetina. Este autor menciona que a la concentración de 9.05 μM de 2,4-D solo obtiene un 40% de callos embriogénicos, porcentaje que se ve incrementado al 42% cuando combina 18.10 μM de 2,4-D con 2.32 μM de kinetina. En este experimento se observó que con la adición de 2,4-D solo en el medio de cultivo la formación de callos a partir del cultivo de explantes foliares no fue buena, los callos fueron pequeños y con estructuras globulares alargadas y compactas, de color pardo y que en varios casos se diferenciaron en una raíz. Sin embargo, la adición de 6-BAP mejoró notablemente el crecimiento y la calidad de los callos.


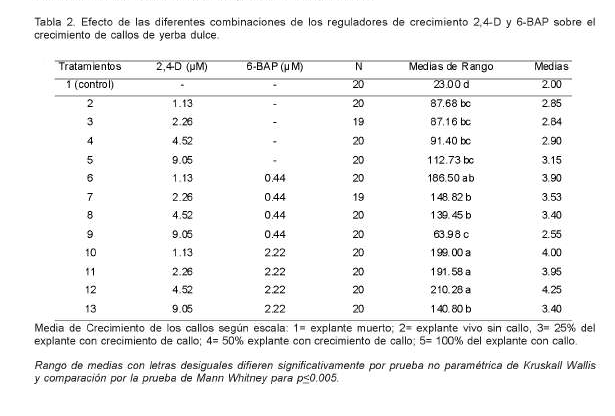
Analizando los mejores tratamientos (10, 11 y 12; Tabla 2), puede verse que los estos comparten la misma concentración de 6-BAP (2.22 µM). La diferencia entre ellos se da en las concentraciones crecientes de 2,4-D que van desde 1.13 µM para el tratamiento 10; 2.26 µM para el 11 y 4.52 µM para el 12. En función de este análisis sería lógico entonces deducir que el mejor tratamiento de este experimento sería el 10, ya que con la menor concentración de 2,4-D se lograron los mismos porcentajes de formación de callos y una de las mejores medias en el crecimiento. Sin embargo, se eligió como mejor medio de cultivo al tratamiento 11, debido a que se ha observado que con el incremento de 1.13 µM a 2.26 µM 2,4-D se logró mejorar la calidad del callo, siendo friable y mayores sectores presentaron la coloración buscada que va del blanco al amarillo (Figura 2).
Efecto de la adición de 2,4-D y TDZ
Salvo el control que no tuvo respuesta, se logró formar callos en el 100% de los cultivos correspondientes a los ocho tratamientos (Tabla 3) y se registró a partir de la tercera semana del cultivo.
Murthy et al. (1998) mencionaron que el TDZ a bajas concentraciones induce diversas respuestas de los cultivos in vitro que van desde la inducción de callos
hasta la formación de embriones somáticos. Según Murthy y Saxena (1998) generalmente esta citoquinina tiende a formar callos nodulares compactos. En este experimento el mejor tratamiento resultó ser el 1 (MS + 1.13 µM de 2,4-D + 0.45 µM de TDZ).
Inducción de embriogénesis somática
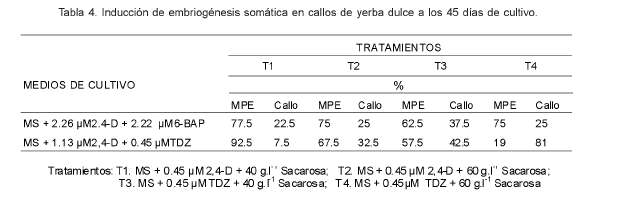
En todos los tratamientos evaluados fue posible embriogénesis somática en su fase inicial. Al reducir la concentración del 2,4-D en el medio de cultivo a 0.45 µM e incrementar la concentración de sacarosa a 40 y 60 g.l-1, se logró que los callos puestos en esas condiciones y después de 45 a 50 días de incubación evidenciaran la formación de proembriones muy pequeños y difíciles de detectar (Figura 3). Sobre la superficie del callo original se formaron pequeñas masas de estructuras globulares traslúcidas (masas proembriogénicas).
Asimismo, cuando callos provenientes de los dos medios de cultivo de multiplicación fueron transferidos a los tratamientos sin 2,4-D y en presencia de 0.45 µM TDZ, con 40 y 60 g.l-1 de sacarosa, también fue posible observar que después de 45 a 50 días de cultivados la formación de masas proembriogénicas, pero en porcentajes más bajos que los obtenidos con los tratamientos que incluían 2,4-D (Tabla 4).


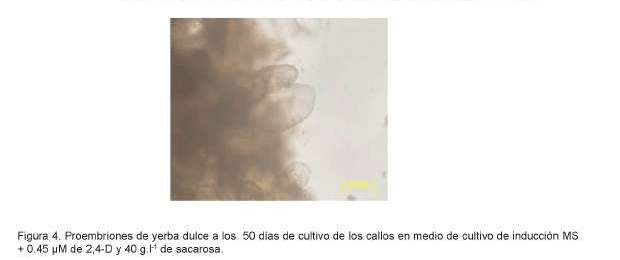
La formación de estructuras proembrionarias constituye una etapa intermedia entre las células embrionarias y la formación de los embriones en etapa globular. Observaciones microscópicas de preparados de callos de yerba dulce con 50 días de incubación en medio de cultivo de inducción de embriogénesis somática, manifestaron la presencia de estructuras globulares las que se muestran independientes del tejido calloso, con una epidermis muy marcada (Figura 4).
La disponibilidad de sacarosa en el medio de cultivo es un factor que influye de forma directa en la embriogénesis somática, esto fue determinado por Karami et al. (2006), quienes evaluaron el efecto de diferentes concentraciones de sacarosa sobre la embriogénesis somática en el clavel (Dianthus caryophyllus L). En ese estudio el incremento de las concentraciones de sacarosa en el medio de cultivo a 9 y 12%, ocasionó la máxima frecuencia de callos con estructuras embriogénicas, mientras que el desarrollo de los embriones somáticos se vió favorecido cuando se incrementó la sacarosa en el medio de cultivo libre de reguladores de crecimiento de 1.5% hasta el 12%, a partir de allí los incrementos al 15% y 18% resultaron negativos. Los autores de éste trabajo atribuyen a la sacarosa un doble efecto, por un lado sirve como fuente de energía y de reserva durante el desarrollo del embrión somático, pero además cumple un papel en la regulación osmótica del medio de cultivo, donde altas concentraciones en el medio de cultivo pueden crear un estrés osmótico que beneficiaría el desarrollo normal de los embriones, simulando las condiciones de osmolaridad que ocurren en la naturaleza durante el desarrollo de los embriones cigóticos.
Según Parrot (2002) el uso de una auxina generalmente es necesario para inducir el estado embriogénico en tejidos que no se encuentran en ese estado, pero luego la histodiferenciación a partir de las células embriogénicas ocurre cuando el nivel de auxinas en el medio de cultivo baja más de cierto umbral.Esto se observó cuando los callos provenientes del medio de cultivo con 2.26 µM 2,4-D fueron subcultivados a los medios de inducción con concentraciones decrecientes de la misma auxina, el crecimiento de tejido secundario con características embriogénicas se produjo en la menor concentración de 2,4-D (0.45 µM 2,4-D).
CONCLUSIONES
Fue posible la formación de callos a partir de los tres tipos de explantes (hojas, segmentos nodales y ápices), obtenidos de plantas in vitro de diferentes clones de yerba dulce, cultivados sobre el medio de cultivo MS + 2.26 µM de 2,4-D e incubados tanto en luz como en la oscuridad. Se definió como la mejor combinación al explante foliar del clon 3 incubado en condiciones de oscuridad.
Se logró la producción de masas proembriogénicas a partir de los callos, al subcultivarlos al medio de cultivo MS con 0.45 µM 2,4-D y adicionado con 4 ó 6% de sacarosa a los 45-50 días de cultivo.
REFERENCIAS
Akita, M, TShigeoka, Y Koizumi, M Kawamura (1994) Mass propagation of shoots of Stevia rebaudiana using a large scale bioreactor. Plant Cell Reports 13: 180-183
Ariza, JO (2007) Regeneración de plantas a partir del cultivo de anteras de la línea Py-1 de Stevia rebaudiana Bertoni. Tesis en opción al grado científico de Master en Biotecnología Vegetal. UCLV y Universidad Nacional de Misiones, Argentina
Bespalhok Filho, Joao Carlos, Kazumi Hattori (1997) Embryogenic callus formation and histological studies from Stevia rebaudiana Bertoni floret explants. Revista Brasilera de Fisiología vegetal 9(3):185-188
Bespalhok Filho, Joao Carlos, JM Hashimoto, LGE Vieira (1993) Induction of somatic embryogenesis from leaf explants of Stevia rebaudiana. Revista Brasilera de Fisiología vegetal 5(1):51-53
Geuns, J M C (2003) Stevioside, molecules of interest. Laboratory of Plant Physiology, Catholic University of Leuven, Leuven
Kosky R G (1998) Cultivo de Células y Tejidos. En: Pérez JN (ed). Propagación y Mejora Genética de Plantas por Biotecnología, pp. 25-44. IBP, Santa Clara
Jones, Aurellius Joi, D Moore, K M Knowles, S Dhir (2003) Factors affecting plant regeneration via somatic embryogenesis in Stevia rebaudiana. 13th Biennial Research Symposium. Fort Valley State University
Karami O, A Deljou, M Esna-Ashari, P Ostad-Ahmadi (2006) Effect of sucrose concentrations on somatic embryogenesis in carnation (Dianthus caryophyllus L.). Scientia Horticulturae 110 (4) 340-344
Kolb, Nicolás, E Kolb, D Ferreira, R Rodríguez (2001) Variación del contenido de esteviósido y rebaudiósido A durante el ciclo de crecimiento de la Stevia rebaudiana. Jornadas de investigación científica y tecnológica Facultad de Cs. Exactas, Químicas y Naturales. Posadas, Misiones
Murashigue, T, Skoog, F (1962) A revised medium for rapid growth and biossays with tobacco tissue culture. Physiol. Plant. 15: 173-197
Murthy, BNS, Murch SJ, Saxena PK (1998) Thidiazuron: a potent regulator of in vitro plant morphogenesis. In vitro Cellular and Development Biology- Plant 34: 267 275
Murthy, BNS, Saxena PK (1998) Somatic embryogenesis and plant regeneration of neem (Azadirachta indica A. Juss). Plant Cell Reports 17: 469 475
Parrott, W (2002) La embriogénesis somática en las angiospermas. VI Simposio Internacional de Biotecnología Vegetal. Instituto de Biotecnología de las Plantas. Villa Clara
Pérez Pérez J (2005) Embriogénesis somática en frijol tepari (Phaseolus acutifolius A. Gray cv. TB1). Tesis en opción al título académico de magíster Scientiae en Biotecnología Vegetal. IBP. Santa Clara
Radice S (2004) Morfogénesis in vitro. En: V. Echenique, C Rubinstein y L Mroginski (Eds). Biotecnología y mejoramiento vegetal. Ediciones INTA. Buenos Aires
Sivaram L, U Mukundan (2003) In vitro culture studies on Stevia rebaudiana. In vitro Cellular and Developmental Biology-plant 39 (5): 520-523
Tamura Y, S Nakamura, H Fukui, M Tabata (1984) Clonal propagation of Stevia rebaudiana Bertoni by stem-tip culture. Plant Cell Reports 3: 183-185
Vázquez, E, Torres S (1995) Fisiología Vegetal. Ed. Pueblo y Educación, Ciudad de la Habana
Copyright (c) 2016 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
