Comunicación Corta Biotecnología Vegetal Vol. 8, No. 2: 115 - 118, abril - junio, 2008
ISSN 1609-1841 (Versión impresa)
ISSN 2074-8647 (Versión electrónica)
Determinación de la concentración mínima inhibitoria de Geneticina G418 en el proceso de formación de callos de Digitalis purpurea L.
Borys Chong-Pérez*, Naivy Pérez-Alonso, Zenaida Occeguera Águila, Alina Capote, Anabel Pérez, Elio Jiménez. *Autor para correspondencia.
Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5. Santa Clara. Villa Clara. Cuba. CP 54 830. e-mail: boris@ibp.co.cu
RESUMEN
Digitalis purpurea L. produce glicósidos cardiotónicos, como digoxina y digitoxina, los cuales se utilizan para el tratamiento de enfermedades cardíacas. Los estudios genómicos en esta especie se han visto limitados por la ausencia de un sistema de transformación genética eficiente. Uno de los primeros pasos para establecer una tecnología de transformación es la obtención de un método y agente para seleccionar células transformadas de las no transformadas. En el presente estudio, se determinó la concentración mínima inhibitoria de Geneticina G-418 en la formación de callos en segmentos de hojas de esta planta. Además, se evaluó el efecto de las concentraciones entre 10-50 mg.l-1 en los segmentos de hojas, para lo que se desarrolló una escala evaluativa basada en el porcentaje de tejido que no formó callo. Ningún explante formó callos cuando los fragmentos de hojas fueron cultivados con una concentración de 50 mg.l-1 de Geneticina G-418, por lo que se consideró esta concentración como la mínima inhibitoria y fue seleccionada para futuros trabajos de transformación genética en esta especie.
Palabras clave: digoxina, NPTII, selección, transformación genética
ABSTRACT
Digitalis purpurea L. produces cardiatonic glycosides such as digoxin and digitoxin, which are widely used for congestive heart failure. Genomic studies in this specie are limited because there is not an efficient genetic transformation system. One of the first steps to launch a transgene technology is to obtain the method and agent to select transformed out of non-transformed cells. In the current study, the Geneticin G-418 minimal inhibitory concentration was determined for leaf explants on callus formation. Besides, the effect of concentrations of this antibiotic between 10 and 50 mg.l-1 on leaves fragments was evaluated. An evaluation scale, taking into account the percentage of the explants which did not form callus, was proposed. No explant developed callus when leaves fragments were cultured at 50 mg.l-1.This concentration was considered as the minimal inhibitory and was selected for future works on genetic transformation.
Key words: digoxin, genetic transformation, NPTII, selection
INTRODUCCIÓN
Digitalis purpurea L., es una de las plantas medicinales más famosas en la historia de la humanidad y se conocen sus propiedades en el tratamiento de la insuficiencia cardíaca congestiva (Schwinger et al., 2003). Contiene metabolitos secundarios de interés farmacológico, entre los más importantes se destacan la digitoxina y la digoxina de marcada actividad cardiotónica (Cowan, 2004). Sin embargo, poco se conoce acerca de los mecanismos que regulan la biosíntesis de estos compuestos. Solamente en esta especie se han aislado y caracterizado dos genes que están en la ruta biosintética de los cardenólidos a nivel molecular, ambos codifican para la progesterona 5â-reductasa (P5âR) (Gavidia et al., 2002; 2007). Los estudios de genómica funcional de esta especie se han visto limitados en parte por la carencia de un sistema de transformación eficiente, el cual es una herramienta poderosa para elucidar la función de genes de interés en plantas. La transformación genética implica una serie de pasos: disponer de un método eficiente de regeneración de plantas, una metodología de transferencia de ácido desoxirribonucleico (ADN) y un sistema de selección de células o tejidos transformados para cada una de las fases del proceso de regeneración.
En la tecnología de transformación genética de plantas se ha adoptado, generalmente, el uso de marcadores de selección como herramienta indispensable para regenerar plantas transgénicas. En los casos en que la frecuencia de transformación de las células vegetales es baja, la probabilidad de obtener plantas transgénicas sin el uso de marcadores de selección también es baja (Miki y McHugh, 2004). Es por esto, que una selección eficiente aumenta los eventos de transformación y por ende existe una mayor probabilidad de regeneración de plantas transgénicas (Ballester et al., 2008). Uno de los marcadores de selección más utilizados es el aminoglicósido 3-fosfotransferasa II, también conocido como neomicin fosfotransferasa II (NPTII). Este fue el primer marcador de selección utilizado en plantas (Bevan et al., 1983; Fraley et al., 1983; Herrera-Estrella et al., 1983). NPTII cataliza la fosforilación ATP-dependiente del grupo 3-hidroxil de la porción amino-hexosa de ciertos aminoglicósidos como son neomicina, kanamicina, geneticina (G418) y paranomicina. Según Miki y McHugh (2004), NPTII pertenece al grupo de los marcadores de selección positivos condicionales, debido a que permite el crecimiento de los tejidos transformados con la condición de que exista un sustrato, en este caso los antibióticos antes mencionados.
En D. purpurea solamente se ha informado la transformación genética por Saito et al. (1990), quienes utilizaron Agrobacterium rizhogenes para la transferencia del ADN foráneo a discos de hojas de esta planta y la posterior obtención de raíces transgénicas. Estos autores no aplicaron selección durante este periodo y solo después de formadas la raíces las transfirieron a un medio de cultivo selectivo con kanamicina, lo que trajo como consecuencia que solo siete clones expresaran los genes introducidos. Además, estos autores no lograron regenerar plantas completas. En el Instituto de Biotecnología de las Plantas se trabaja en el desarrollo de un protocolo para la obtención de plantas de D. purpurea a partir de discos de hojas, el cual se basa en la formación de embriones somáticos y la regeneración de plantas a partir de estos, como un primer paso para el desarrollo de un protocolo de transformación genética de D. purpurea. El objetivo de este trabajo fue determinar la concentración mínima inhibitoria de geneticina (G418), en el proceso de formación de callos embriogénicos de Digitalis purpurea L., para su posible uso como agente selectivo en la transformación genética de esta especie.
MATERIALES Y MÉTODOS
Se utilizaron fragmentos de hojas procedentes de plantas in vitro de aproximadamente 1 cm2, los cuales fueron colocados en el medio de cultivo compuesto por las sales propuestas por Murashige y Skoog (1962) (MS), 4 mg.l-1 de tiamina; 100 mg.l-1 de mio-inositol, 4.5 μM de ácido 2,4-diclorofenoxiacético (2,4-D), 3.0% de sacarosa y 3.0 g.l-1 de Gelrite (Duchefa). El pH fue ajustado a 5.8 previo a la esterilización por autoclave. La solución del antibiótico geneticina (G418, Duchefa), que fue preparada a 50 mg.ml-1 y esterilizada por filtración, se adicionó posterior a la esterilización, cuando la temperatura del medio de cultivo estaba entre 40-45ºC. Las concentraciones utilizadas fueron 0, 10, 20, 30, 40 y 50 mg.l-1. Cinco explantes fueron colocados en cada frasco de vidrio de 250 ml de capacidad, con 30 ml de medio de cultivo. Por cada tratamiento se utilizaron 35 explantes, los cuales fueron subcultivados cada dos semanas a medio de cultivo fresco con antibiótico. A las ocho semanas se evaluó el número de explantes que formaron callos.
El procesamiento estadístico de los datos se realizó con el programa para análisis de datos STATISTICA versión 7. Se realizó una comparación de rangos múltiples mediante la prueba no paramética de Kruskal-Wallis.
RESULTADOS Y DISCUSIÓN
Al realizar la evaluación visual de los explantes se apreciaron diferentes respuestas con respecto al área de este que formó callos. Para facilitar esta evaluación del efecto de las concentraciones de Geneticina en la formación de callos a partir de explantes foliares, se elaboró una escala descriptiva de grados. En esta se tuvo en cuenta el área de los explantes que no formó callos (Tabla 1).
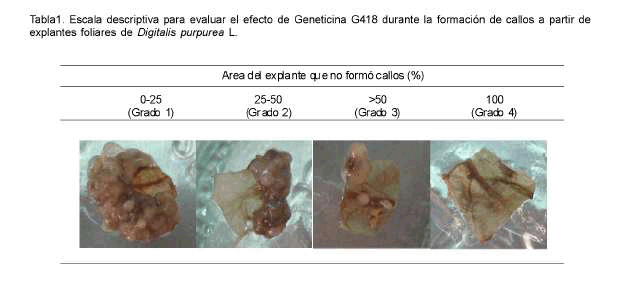
En las primeras 48 horas comenzaron a aparecer los primeros síntomas en los explantes de los tratamientos con 30, 40 y 50 mg.l-1 de Geneticina en el medio de cultivo. Se observaron pequeñas zonas cloróticas en los bordes externos y después de una semana esta decoloración se extendió, se tornaron flácidas y al cabo de las cuatro semanas ya tenían aspecto necrótico. En el control no tratado con Geneticina G418, todos los explantes formaron callos transcurrido este tiempo.
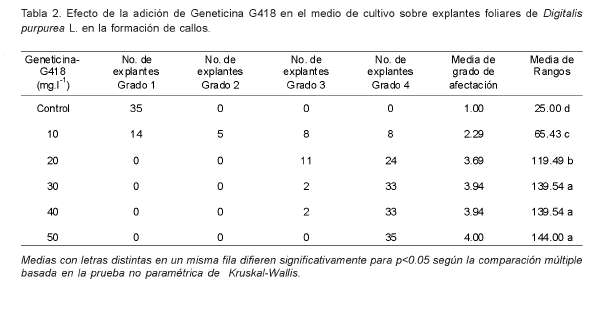
A las ocho semanas de cultivo, con la concentración de 10 mg.l-1, ocho explantes no formaron callos (22.86%), ocho tenían afectación parcial del tejido (grado 3) (22.86%) y cinco con grado 2 (14.28%), solo 14 explantes formaron callos sin afectaciones visibles (40.00%), para un promedio de grado de afectación de 2.29.
La concentración de 20 mg.l-1 aumentó el daño sobre el tejido foliar, con 3.69 grado de afectación promedio. En 30 y 40 mg.l-1 solamente dos explantes (5.71%) formaron callos en cada tratamiento (grado de afectación promedio de 3.94) y no difirió estadísticamente con 50 mg.l-1 de Geneticina G-418 (4.00) (Tabla 2).
La Geneticina G418 ha sido referida como muy efectiva como agente de selección en caña de azúcar (Saccharum spp.híbrido) (Elliot et al., 1999), cebolla (Allium cepa L.) (Eady et al., 2000) y sorgo (Sorghum bicolor) (Tadesse et al., 2003). Además, concentraciones bajas de Geneticina G418 (10 mg.l-1) fueron efectivas para inhibir la regeneración de brotes no transformados de Citrus aurantifola Swing (Peña et al., 1997).Igualmente, este antibiótico (50 mg.l-1) ha sido utilizado para la selección de células transformadas de banano cv. Three Hand Planty (Musa AAB) (Remy et al., 2005). Sin embargo, la Geneticina G-418 no ha sido efectiva para la selección en Zea mays (Spencer et al., 1990) y palma aceitera (Elaeis guineensis Jacq.) (Parveez et al., 1996). En este último caso la variación de la sensibilidad a este antibiótico como agente de selección podría deberse a diferentes niveles de resistencia endógena de los tejidos de genotipos específicos (Parveez et al., 1996).
Sreeramanan et al. (2006) informan, además, el empleo de Geneticina G-418 en el cultivo de brotes de banano (Musa spp.). Estos autores observaron mortalidad en el 100% de los brotes cultivados con 100 mg.l-1 en medio de cultivo semisólido y 50 mg.l-1 en medio de cultivo líquido. Estas concentraciones fueron seleccionadas como mínimas inhibitorias.
Los tratamientos con 30, 40 y 50 mg.l-1 de Geneticina G418 no difirieron estadísticamente entre sí, pero solo con la concentración de 50 mg.l-1 se logró el 100% de mortalidad de los explantes. Esto garantizaría en un experimento de transformación, que solamente las células transformadas tengan la capacidad de formar callos en un medio de cultivo con este agente selectivo.
Teniendo en cuenta estos resultados se seleccionó, para el proceso de formación de callos embriogénicos a partir de fragmentos de hojas de plantas de Digitalis purpurea L. cultivadas in vitro, la concentración mínima inhibitoria de Geneticina G418 de 50 mg.l-1. Se recomienda utilizar esta concentración para los futuros trabajos de transformación genética en esta especie. Además, la escala evaluativa elaborada puede servir de base para futuros trabajos de selección en los cuales se parta de segmentos de hojas para la formación de callos.
REFERENCIAS
Ballester, A, Cervera M, Peña L (2008) Evaluation of selection strategies alternative to nptII in genetic transformation of citrus. Plant Cell Report 27: 10051015
Bevan, MW, Flavell RB, Chilton MD (1983) A chimaeric antibiotic resistance gene as a selectable marker for plant cell transformation. Nature 304: 184187
Cowan T (2004) The Fourfold Path to Healing. Digitalis. [en línea]. Disponible en: http://www.fourfoldhealing.com/ Digitalis.htm [Consulta: Octubre de 2006]
Eady, CC, Weld JJ, Lister CE (2000) Agrobacterium tumefaciens mediated transformation and transgenic-plant regeneration of onion (Allium Cepa L.). Plant Cell Rep 19:376381
Elliott, AR, Campbell JA, Dugdale B, Brettell RIS, Grof CPL (1999) Green-fluorescent protein facilitates rapid in vivo detection of genetically transformed plant cells. Plant Cell Rep 18: 707714
Fraley, RT, Rogers SG, Horsch RB, Sanders PR, Flick JS, Adams S P, Bittner ML,Brand LA, Fink CL, Fry JS, Gallupi GR, Goldberg SB, Hoffman NL, Woo SC (1983) Expression of bacterial genes in plant cells. Proc Natl Acad Sci USA 80: 4803-4807
Gavidia, I, Pérez-Bermúdez P, Seitz HU (2002) Cloning and expression of two novel aldo-keto reductases from Digitalis purpurea leaves. Eur. J. Biochem. 269: 28422850
Gavidia, I, Tarrío R, Rodrðíguez-Trelles F, Pérez-Bermúdez P, Seitz HU (2007) Plant progesterone 5â-reductase is not homologous to the animal enzyme. Molecular evolutionary characterization of P5âR from Digitalis purpurea. Phytochemistry 68: 853864
Herrera-Estrella, L, De Block M, Messens E, Hernalsteen JP, Van Montagu M, Schell J (1983) Chimeric genes as dominant selectable markers in plant cells. EMBO J 2: 987995
Miki, B, McHugh S (2004) Selectable marker genes in transgenic plants: applications, alternatives and biosafety. J. Biotech 107: 193232
Murashige, T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant 15:473-497
Parveez, G, M Chowdhury, Saleh NM (1996) Determination of minimal inhibitory Concentration of selection agents for Oil Palm (Elaeis guineensis Jacq.) transformation. Asia Pac. J. Mol. Bio. Biotechnol. 4: 219-228
Peña, L, Cervera J, Juárez J, Navarro A, Pina JA, Navarro L (1997) Genetic transformation of line (Citus aurantifolia Swing.): factors affecting transformation and regeneration. Plant Cell Rep 16: 731-737
Remy, S, Thiry E, Coemans B, Windelinckx S, Swennen R, Sàgi L (2005) Improved T-DNA vector for tagging plant promoters via high-throughput luciferase screening. BioTechniques 38:763-770
Saito, K, Yamazaki M, Shimomura K, Yoshimatsu K, Murakoshi I (1990) Genetic transformation of foxglove (Digitalis purpurea)by chimeric foreign genes and production of cardioactive glycosides. Plant Cell Reports 9: 121-124
Spencer, TM, WJ Gordon-Kamm, RJ Daines WG Start, PG Lemaux (1990) Bialaphos selection of stable transformants from maize cell culture. Theor. Applied Genet 79: 625-631
Sreeramanan, S, Maziah M, Abdullah P, Rosli M (2006) Potential selectable marker for genetic transformation in banana. Biotechnology 5 (2): 189-197
Schwinger, RHG, Bundgaard H, Muller-Ehmsen J, Kjeldsen K (2003) The Na, K-ATPase in the failing human heart. Cardiovasc. Res. 57: 913920
Tadesse, Y, Sàgi L, Swennen R, Michel J (2003) Optimisation of transformation conditions and production of transgenic sorghum (Sorghum bicolor) via microparticle bombardment. Plant Cell, Tiss. Org. Cult 75: 1-18
Copyright (c) 2016 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
