Artículo Científico Biotecnología Vegetal Vol. 7, No. 3: 143 - 147, julio-septiembre, 2007
ISSN 1609-1841 (Versión impresa) ISSN 2074-8647 (Versión electrónica)
Evaluación en campo de la estabilidad genética en plantas obtenidas por embriogénesis somática del cv. híbrido FHIA 21 (Musa AAAB)
Leyanis García-Águila¹*, Miladys León¹, Rafael G. Kosky¹, Pedro Orellana¹, Ricardo González2. *Autor para correspondencia.
¹Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas, Carretera a Camajuaní km 5.5 Santa Clara, Villa Clara. Cuba, CP 54 830. e-mail: leyanis@ibp.co.cu
2Finca de Referencia Nacional La Victoria. Bayamo. Granma.
RESUMEN
El presente trabajo se realizó con el objetivo de evaluar en campo la estabilidad genética de plantas regeneradas por embriogénesis somática del cv. híbrido FHIA-21 (Musa AAAB). Para este estudio se plantaron 6 252 plantas y se utilizaron como control 2 000 plantas obtenidas por organogénesis e igual cantidad procedente de semilla asexual (cormo). La densidad de plantación fue de 3 333 plantas por hectárea, a una distancia de 3x2x1.20m. Se realizaron cuatro repeticiones en un diseño experimental de Cuadrado Latino. Las evaluaciones se efectuaron durante el primer ciclo de plantación a través de los caracteres morfológicos y agronómicos de mayor aporte a la detección de la variabilidad genética. Los resultados mostraron alta estabilidad genética en las plantas obtenidas por embriogénesis somática del cv. híbrido FHIA 21 (Musa AAAB), dado por el bajo porcentaje de variación somaclonal (0.015%). Por otra parte, la evaluación de los caracteres agronómicos (peso de los racimos, número de manos y número de frutos) no presentó diferencias estadísticas entre las plantas procedentes del cultivo in vitro (embriogénesis somática y organogénesis), pero sí con respecto a las plantas de semilla asexual. Por tanto, los resultados de este trabajo pudieran validar la embriogénesis somática para la propagación masiva del cv. híbrido de plátano FHIA-21.
Palabras clave: caracteres morfológicos y agronómicos, cultivo in vitro, variación somaclonal
ABSTRACT
The present work was carried to evaluate the genetic stability in plants obtained by somatic embryogenesis of cv. hybrid FHIA 21 (Musa AAAB) in field. A number of 6 252 plants were planted and 2 000 plants obtained by organogenesis and same quantity coming from asexual seeds were used as control for this study. The plantation density was 3 333 plants per hectare, at a distance of 3x2x1.20m each one. Four repetitions were carried out in a Latin Square experimental design. Evaluations were made during the first plantation cycle through out morphological and agronomic characters of more contribution to detection of genetic variability. Results showed high genetic stability in plants obtained by somatic embryogenesis of cv. hybrid FHIA 21 (Musa AAAB), given by the low percentage of somaclonal variation (0.015%). Besides, the evaluation of the agronomic characters (bunch weigh, number of hands/bunch and number of fruits/hands) did not present statistical differences among the plants coming from the in vitro culture (somatic embryogenesis and organogenesis), but some differences were observed when compared to plants from asexual seeds. Results of this work validate somatic embryogenesis for the massive propagation of cv. hybrid of banana FHIA-21.
Keywords: in vitro culture, morphological and agronomic characters, somaclonal variation
INTRODUCCIÓN
En el cultivar híbrido FHIA 21 (Musa AAAB) la propagación in vitro a través del cultivo de brotes axilares (organogénesis) presenta como limitante bajos coeficientes de multiplicación y crecimiento de brotes en forma de rosetas (García-Águila et al., 2002). Por ello, se ha considerado aprovechar las ventajas de la embriogénesis somática en la propagación masiva de plantas de este híbrido.
Daniels et al. (2002) propusieron un sistema de regeneración de plantas a través de la embriogénesis somática como base para la transformación genética. Sin embargo, no consideraron la evaluación en campo de la estabilidad genética como aspecto importante para conocer su competibilidad frente a la propagación organogénica y la semilla tradicional (cormo).
En el género Musa los principales estudios de variación genética a través de la evaluación de los caracteres morfológicos y agronómicos responden a proyectos de mejoramiento genético. Por esta causa, y con el objetivo de unificar criterios de evaluación la Red Internacional para el Mejoramiento del Banano y el Plátano confeccionó la Guía de Descriptores para el Banano (Musa spp.) que proporciona los parámetros a observar para el manejo general de los cultivares.
Por otra parte, la caracterización morfológica y agronómica se ha utilizado en el monitoreo de la estabilidad genética entre plantas procedentes del cultivo de tejidos in vitro, especialmente en plantas regeneradas a partir del cultivo de brotes axilares (organogénesis) (Smith y Hamill, 1993; Sandoval et al., 1997), por ser el método de propagación in vitro más utilizado. Sin embargo, existen pocos estudios de estabilidad genética en plantas obtenidas a partir de los embriones somáticos. Entre estos resultados se destacan los obtenidos por Côte et al. (2000), en una población de 500 plantas del cultivar Grande naine (Musa AAA) regeneradas a partir de suspensiones celulares embriogénicas. Además, están los resultados de López et al. (2005) en el cv. Navoleam (Musa ABB) y Kosky et al. (2006) en el cv. híbrido FHIA 18 (Musa AAAB). Estos autores observaron diferentes tipos de cambios morfológicos en las plantas regeneradas por embriogénesis somática, muchos de los cuales desaparecieron en el segundo ciclo de cultivo.
Teniendo en cuenta los aspectos anteriormente descritos y la disponibilidad de plantas regeneradas por embriogénesis somática del cv. híbrido FHIA 21 (Musa AAAB), este trabajo tuvo como objetivo evaluar en condiciones de campo la estabilidad genética de las plantas, a través de caracteres morfológicos y agronómicos.
MATERIALES Y MÉTODOS
Para este estudio se plantaron en campo 6 252 plantas procedentes de embriones somáticos y se utilizaron como control 2 000 plantas obtenidas por organogénesis e igual cantidad procedente de semilla asexual (cormo). El experimento abarcó un área 3.0 hectáreas en suelo aluvial poco diferenciado y la distancia de plantación fue de 3x 2x1.20m, para una densidad de plantación de 3 333 plantas por hectárea. Se realizaron cuatro repeticiones en un diseño experimental de Cuadrado Latino. La temperatura promedio anual durante todo el ciclo de cultivo fue de 25±3ºC. El riego y las atenciones culturales se realizaron siguiendo el Instructivo Técnico para el Cultivo del Plátano (INIVIT, 2007).
La evaluación de la estabilidad genética de las plantas se determinó a través de caracteres morfológicos y agronómicos altamente discriminantes y de mayor aporte a la detección de la variabilidad genética. Para ello se utilizó la Guía de Descriptores para el Banano (Musa spp.) propuesta por el INIBAP/IPGRI/CIRAD (1996) y el Descriptor de la FHIA para el cv. híbrido FHIA-21 (FHIA, 2002).
Los caracteres morfológicos que se evaluaron fueron: hábito foliar, apariencia del pseudotallo, tipo de bellota, forma del racimo, posición de racimo, color del fruto, forma del fruto y forma del ápice del fruto. A los diez meses se evaluó la altura de la planta (m) medida desde la base hasta la inserción en forma de V de las últimas hojas emitidas, la circunferencia del pseudotallo (cm) a un 1.0 m de la base y el número de hojas funcionales.
La evaluación de los caracteres agronómicos se realizó a los 14 meses de la plantación y para ello se seleccionaron aleatoriamente 250 plantas por cada tipo de sistema de propagación estudiado.
Las variables evaluadas se describen a continuación:
- Número de hojas funcionales a la cosecha.
- Peso neto del racimo con desmane (kg)
- Número de manos por racimo
- Número de frutos por mano
A los datos experimentales se les aplicó un análisis de varianza de clasificación simple. Mientras que la comparación de medias se realizó a través de la prueba no paramétrica de Kruskal-Wallis con nivel de significación de 0.05.
RESULTADOS Y DISCUSIÓN
Las plantas procedentes de embriones somáticos mostraron similitud en los caracteres morfológicos evaluados, con respecto a las plantas procedentes de organogénesis y semilla asexual. Se observó en las plantas un hábito foliar decumbente, pseudotallo brillante no ceroso, bellota permanente en el racimo, racimo asimétrico y ligeramente inclinado, con frutos de color verde claro y rectos en la parte discal (Figura 1). Estos caracteres morfológicos coinciden con el Descriptor de la FHIA (2002) para este cultivar.
No obstante, se observó una planta fuera de tipo en la población procedente de embriones somáticos. Esta se caracterizó por presentar menor altura, pseudotallo delgado y hojas anchas (Figura 2). Este tipo de variante morfológica relacionada con la altura se conoce como planta de tipo Grele. Por esta causa, los resultados en campo mostraron un porcentaje de variación somaclonal de 0.015% en las plantas regeneradas de embriones somáticos del cv híbrido FHIA-21.


A los 10 meses las plantas procedentes del cultivo in vitro (embriogénesis y organogénesis) presentaron menor altura y mayor número de hojas funcionales que las plantas obtenidas de semilla asexual, con diferencias significativas entre ellas. Sin embargo, para la variable circunferencia del pseudotallo no se encontraron diferencias entre las plantas correspondientes a los tres sistemas de propagación (Tabla 1).
En la literatura científica se describen diferentes tipos de cambios morfológicos en plantas procedentes del cultivo in vitro. La variación de tipo Grele fue observada por Marie (1993), Morpurgo et al. (1997) y Sandoval et al. (1997) en otros genotipos de Musa.
Los resultados de la evaluación de los caracteres morfológicos muestran que la población de plantas obtenidas por embriogénesis somática del cv. híbrido FHIA-21 presenta gran estabilidad genética, dado por el bajo porcentaje de variación somaclonal (0.015%). En este trabajo de 6 252 plantas se observó solo una planta con cambio morfológico. Este porcentaje es bajo cuando se compara con los resultados descritos por otros autores en diferentes genotipos de Musa.
Por ejemplo, Grapin et al. (1996) obtuvieron de 16 a 22.1% de variantes somaclonales en plantas del cv. French Sombra (Musa AAB). Mientras que Shchukin et al. (1998), señalaron valores entre 1.6 a 7.9% de variación somaclonal en el cv. Grande naine (Musa AAA) cuando emplearon la embriogénesis somática en la regeneración de plantas, siendo el enanismo y el mosaico las variaciones más frecuentes.
En estudios similares, López et al. (2005), detectaron 1.1 y 8.6% de variantes somaclonales del cv. de plátano Navolean (Musa ABB), en poblaciones de plantas regeneradas de embriones somáticos y observaron cambios en la morfología del racimo correspondiente a la regresión a tipo French. Posteriormente, Kosky et al. (2006) anunciaron 1.0% de variación somaclonal en 1 000 plantas del cv. híbrido de banano FHIA-18 (AAAB) regeneradas a partir de embriones somáticos. Estos autores observaron plantas con retardo del crecimiento (enanas) durante dos ciclos de cultivo.
Por otra parte, la evaluación de los caracteres agronómicos en las plantas del cv. FHIA 21 (peso de los racimos, número de manos y número de frutos) no mostraron diferencias estadísticas entre las plantas procedentes del cultivo in vitro (embriogénesis somática y organogénesis), pero sí con respecto a las plantas procedentes de semilla asexual. Sin embargo, el mayor número de hojas funcionales, en el momento de la cosecha, se presentó en las plantas obtenidas de embriones somáticos (Tabla 2).
Los resultados de la evaluación de las variables agronómicas demostraron mejor desempeño en las plantas procedentes del cultivo in vitro que las plantas procedentes de semilla asexual en el cv. híbrido FHIA-21.

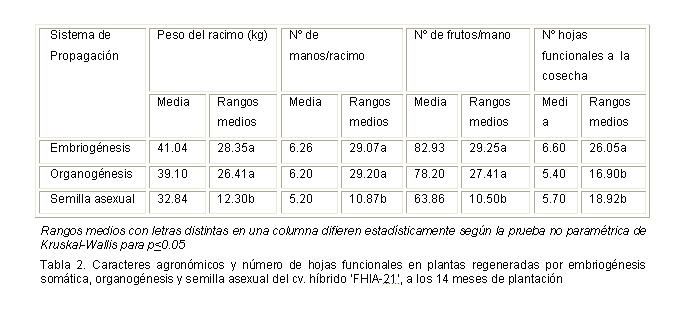
Estos resultados al igual que los descritos por Côte et al. (2000) durante la evaluación en campo de 500 plantas de Grande Naine (Musa AAA), mostraron que no existía diferencias morfológicas y agronómica entre las plantas procedentes de la técnica convencional de cultivo in vitro (organogénesis) y las obtenidas a partir de suspensiones celulares embriogénicas. Al respecto, López et al. (2005), durante la evaluación en campo de plantas del cv. Navolean obtuvieron una respuesta agronómica similar entre las plantas procedentes del cultivo in vitro con respecto a las plantas procedentes de semilla asexual.
CONCLUSIONES
Los resultados de la evaluación en campo a través de los caracteres morfológicos y agronómicos mostraron alta estabilidad genética en plantas obtenidas por embriogénesis somática del cv. híbrido FHIA 21 (Musa AAAB). Por tanto, los resultados de este trabajo pudieran validar la embriogénesis somática para la propagación masiva in vitro en este cultivar.
REFERENCIAS
Côte F, Folliot M, Domergue R, Dubois C (2000) Field performance of embryogenic cell suspension-derived banana plants (Musa AAA, cv. Grand Naine). Euphytica 112: 245-251
Daniels D, Kosky RG, Vega M (2002) Plant regeneration system via somatic embryogenesis in the hirbid cultivar FHIA 21 (Musa spp. AAAB Gropl). In Vitro Cell. Dev. Biol.38:330 333
FHIA (2002) [En línea] http://www.fhia.hn. Consultado: 23 de enero 2006
García-Aguila L, Pérez B, Sarría Z, Clavero J (2002) Alternativas para la propagación in vitro del cultivar híbrido FHIA-20. Infomusa 11(1):35-38
García LR, Pérez J, Bermúdez I, Orellana P, Veitía N, García L, Padrón Y, Romero C (2002) Estudio comparativo de la variabilidad producida por la inducción de mutaciones y el cultivo de tejidos en banano (Musa sp.) cv Grande naine. Infomusa 11(2):4-6
Grapin A, Schwendiman J, Teisson C (1996) Somatic embryogenesis in plantain banana. In vitro Plant Cell. and Dev. Biol. 32: 66-71
Kosky RG, Barranco L A, Chong B, Daniels D, Reyes M, De Feria M (2006) Trueness-to-type and yield components of banana Irbid cultivar FHIA-18 plants regeneration via embryogenesis in a bioreactor. Euphytica 150: 63-68
INIBAP/IPGRI/CIRAD (1996) Descriptores para el banano (Musa spp.). Instituto internacional de recursos filogenéticos, Roma Italia; Red Internacional para el mejoramiento del banano y el plátano. Montpellier, Francia; y Center de Coopération internationale en recherche agronomique pour le développement, Montpellier, Francia
INIVIT (2007) Instructivo técnico del cultivo del plátano. Instituto de Investigaciones de Viandas Tropicales. Asociación Cubana de Técnicos Agrícolas y Forestales. Biblioteca ACTAF, primera edición. pp. 21
Marie P (1993) Utilization des vitroplants de bananiers aux Antilles francaises: atouts et contraintes. Fruits 48(2):89-94
Morpurgo R, Brunner H, Grasso G, van Duren M, Roux N, Afza R (1997) Enigma of banana breeding. Achallenge for biotechnology. Agro-Food-Industry Hi-Tech. Plant Breeding Unit, FAO/IAEA Agriculture and Biotechnology Laboratory, Austria. pp. 16-21
Sandoval J, Pérez L, Côte F (1997) Estudio morfológico y de la estabilidad genética de plantas variantes de banano (Musa AAA cv. Gran Enano). Etapas de cultivo in vitro, aclimatización y campo. CORBANA 22(48): 41-60
López J, Kosky RG, Toledo H, Montano N, Rayas A, Reinaldo D, Chong B, Cabrera M, Santos A, Ventura J, Medero V, García M, Basail M, Cantero A y Arbel J (2005) Evaluación en campo de plantas regeneradas por embriogénesis somática a partir de ápices de brotes de yemas axilares en cv. Navolean (Musa spp., AAB). Biotecnología Vegetal 5(2):115-120
Smith M, Hamill S (1993) Banana tissue culture. Banana industry protection board of Strategic Plan 1994-99/Annual report 1993-1994. pp. 27-29. Queensland. Australia
Shchukin A, Ben-Bassat D, Israeli Y (1998) Somaclonal variation and horticultural performance of Grand Nain bananas multiplied via somatic embryogenesis or shoot-tip culture. Abstracts in IX international congress on plant tissue and cell culture. Jerusalem, Israel
Copyright (c) 2016 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
