Artículo Científico Biotecnología Vegetal Vol. 7, No. 3: 181 - 186, julio-septiembre, 2007
ISSN 1609-1841 (Versión impresa) ISSN 2074-8647 (Versión electrónica)
Evaluación de la actividad fitotóxica sobre plantas de Musa spp. y contenido de proteínas totales de fitrados de cultivo de Fusarium oxysporum f. sp. cubense raza 1
Nayanci Portal1*, Bárbara Companioni2, Christelle Achade1, Beaufray Mvila1, Mayda Arzola2, Indira Persaud1, Mayra Acosta-Suárez3, Cynthia Sánchez-García3, Michel Leiva-Mora3, Belkis Roque3, Yelenys Alvarado-Capó3, Ramón Santos 2 *Autor para correspondencia
1Facultad de Agronomía. Universidad de Ciego de Ávila. Carretera a Morón km 1/2. Ciego de Ávila. e. mail: nayanci@agronomia.unica.cu, nayansi@bioplantas.cu
2Centro de Bioplantas. Universidad de Ciego de Ávila. Carretera a Morón km 1/2. Ciego de Ávila.
3Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5. Santa Clara. Villa Clara. Cuba. CP 54 830
RESUMEN
La enfermedad conocida como Mal de Panamá, ocasionada por Fusarium oxysporum f. sp cubense, está considerada como una de las que causan mayores daños en el cultivo de bananos y los plátanos a nivel mundial. Los programas de mejoramiento genético para la búsqueda de resistencia a la misma requieren de herramientas para la selección de genotipos promisorios. El presente trabajo se desarrolló con el objetivo de determinar la actividad fitotóxica y las proteínas totales de filtrados de cultivo de Fusarium oxysporum f. sp. cubense raza 1. Se utilizó la cepa de Fusarium oxysporum f. sp. cubense raza 1 perteneciente al grupo de compatibilidad vegetativa 01210, y los cultivares Gros Michel (susceptible) y FHIA -01 (resistente). Se determinó la masa fresca del micelio en cada momento de evaluación, la absorbancia del filtrado crudo de cultivo en un rango de 200-300nm, la concentración de proteínas totales presente en el filtrado crudo de cultivo y la actividad fitotóxica de los filtrados de cultivo del microorganismo concentrados al 80% de su volumen inicial. Las principales moléculas excretadas al medio de cultivo registraron sus mayores absorbancias a los 270nm. El máximo crecimiento del microorganismo se registró a los 21 días posteriores a la inoculación. El microorganismo fue capaz de excretar los mayores tenores de proteínas luego de 13 días de la inoculación y alcanzó niveles de 1.698mg.ml-1. Se evidenció que F. oxysporum f. sp. cubense raza1 produce los mayores niveles de actividad fitotóxica extracelular en la fase logarítmica de su crecimiento. La máxima actividad fitotóxica se obtuvo a los 15 días de crecido el hongo filamentoso, con una respuesta genotípica diferencial de los cultivares susceptible y resistente frente a los filtrados de cultivos concentrados al 80% de su volumen inicial.
Palabras clave: bananos, Mal de Panamá, mejoramiento de plantas, plátanos, respuesta diferencial
ABSTRACT
Fusarium wilt, caused by Fusarium oxysporum f. sp cubense, is considered the disease that causes most of damages to bananas and plantains worldwide. The present work was developed with the objective to determine the phytotoxic activity and protein total of filtrates of Fusarium oxysporum f. sp. cubense race 1. The strain of Fusarium oxysporum f. sp. cubense race 1, which belongs to the vegetative compatibility group 01210 and genotypes Gros Michel and FHIA -01, susceptible and resistant to host, was used. Fresh weight of the mycelia, absorbance of raw culture filtrate in a range between 200-300nm, total proteins concentration present in raw culture filtrate and phytotoxic activity of culture filtrates of the microorganism concentrated to 80% of its initial volume were determined at every moment of evaluation. The principal molecules excreted to culture medium registered the highest absorbance to 270nm. Maximum growth was observed 21 days after inoculation. The microorganism was able to excrete the highest value of proteins after 13 days of inoculation and reached levels of 1.698mg.ml-1. The highest levels of extra cell phytotoxic activity are produced at the Fusarium oxysporum f. sp. cubense race 1 logarithmic stage of growth. The maximum phytotoxic activity was obtained 15 days after filament fungus was grown with a differential genotype of the susceptible and resistant cultivars in relation to the concentration of culture filtrates to 80% of its initial volume.
Key words: bananas, differential response, Fusarium wilt, plantains, plant breeding
INTRODUCCIÓN
El plátano es el quinto cultivo más importante a nivel mundial, después del arroz, el trigo, el maíz y la papa. Es el alimento básico de millones de personasen los países tropicales en vías de desarrollo, además, representa una importante fuente de empleo e ingresos para los mercados locales e internacionales. El marchitamiento de plátano o enfermedad de Panamá causada por Fusarium oxysporum f. sp. cubense es una de las enfermedades de mayor importancia económica y dañina del género Musa (Pérez, 2004). Parece evidente que la clave del desarrollo sostenible de la producción del plátano y banano reside en el uso de variedades resistentes. Una importante vía lo constituye el uso de herramientas biotecnológicas desarrolladas a partir de estudios de la interacción hospedero-patógeno.
El presente trabajo se desarrolló con el objetivo de determinar la actividad fitotóxica y la concentración de proteínas totales de filtrados de cultivo de Fusarium oxysporum f. sp. cubense raza 1.
MATERIALES Y MÉTODOS
La cepa (cultivo monospórico) de Fusarium oxysporum f. sp. cubense (Foc) raza 1 perteneciente al grupo de compatibilidad vegetativa (GCV) 01210, fue aislada a partir de la corteza exterior y del cilindro central de plantas enfermas del cultivar Gros Michel (Musa AAA, susceptible) del Banco de Germoplasma de Banano del INIVIT.
Los cultivares utilizados fueron: Gros Michel (Musa AAA, susceptible); FHIA -01 (Musa AAAB, resistente). Los cultivares de banano utilizados habían sido clasificados previamente en resistentes o susceptibles a Fusarium oxysporum f. sp. cubense raza 1 por Rodríguez et al. (1991), Novak et al. (1992), Pérez (1997), Silva et al. (1998), Pérez et al. (2003) y Companioni (2004).
Crecimiento de Fusarium oxysporum f. sp. cubense y producción de filtrados crudos de cultivo
El aislado de Foc raza 1 GCV 01210 que se encontraba conservado a 4°C se inoculó en placas de Petri que contenían medio de cultivo Agar Czapek (Fluka) y se dejó crecer durante siete días en condiciones de oscuridad continua a 28±2°C. Se procedió a la inoculación de un disco del micelio del hongo filamentoso, tomado próximo a la periferia de las colonias, en Erlenmeyers de 250 ml de capacidad que contenían 100 ml de medio de cultivo Caldo Czapek (Fluka) según Companioni et al. (2004). Los frascos de cultivo inoculados se colocaron en condiciones estáticas, a 28±20C, 56 μmol.m-2.s-1 de intensidad luminosa, y con un fotoperíodo de 12 horas luz/12 horas oscuridad. Se realizó la cosecha de los cultivos de Foc raza 1 cada 24 horas durante 30 días después de la inoculación. Se separó el micelio del hongo fitopatógeno del medio de cultivo líquido por el proceso de filtración por gasa y papel de filtro Whatmam Nº 1. Se determinó la masa fresca del micelio Fusarium oxysporum f. sp cubense raza 1 en cada momento de evaluación y para obtener la curva de crecimiento se graficaron valores correspondientes a las medias de las tres evaluaciones obtenidas en cada día.
Evaluación de la excreción de metabolitos microbianos al medio de cultivo durante el crecimiento de Fusarium oxysporum f. sp. cubense raza 1 en Caldo Czapek
Alícuotas de 1 ml de los filtrados de cultivo se diluyeron en 25 de agua destilada estéril. Se determinó la absorbancia en un rango de 200-300nm en un espectofotómetro UV-Vis (LKB-Pharmacia) según Novak et al. (1992).
Determinación de la concentración de proteínas totales de filtrados de cultivos de Fusarium oxysporum f. sp. cubense raza 1
Este experimento se realizó con el objetivo de determinar la concentración de proteínas extracelulares presentes en el filtrado de cultivo de Foc raza 1 GCV 01210 en cada momento de evaluación hasta 30 días. La cuantificación de la concentración de proteínas se realizó según Lowry et al. (1951). Se realizaron tres réplicas por día evaluado. Se mezclaron 0.5ml de cada muestra con 6ml de Reactivo C y 0.6ml del Reactivo de Folin Ciocalteaus diluido dos veces. Se determinó la A650 nm transcurridos 60min de la preparación de las muestras. La concentración de proteínas se determinó según la ecuación de Lambert Beer y se expresó en mg·ml-1, referido a una curva patrón de albúmina de suero bovino (BSA). Se representaron gráficamente las medias de las concentraciones diarias obtenidas en las muestra.
Determinación de la actividad fitotóxica de filtrados de cultivo de Fusarium oxysporum f. sp. cubense raza 1
Este experimento se realizó con el objetivo de determinar la actividad fitotóxica del filtrados de cultivo de Fusarium oxysporum f. sp. cubense raza 1 GCV 01210. El filtrado de cultivo obtenido en cada momento de evaluación de de Foc razas 1 se centrifugó a 8 000 rpm durante 20 minutos en una centrífuga Sigma-201M para eliminar los restos de micelio y conidios y el sobrenadante se pasó a través de filtros con poros de 0.22 μm de diámetro (Sartorius).
La determinación de la actividad fitotóxica de los filtrados de cultivo de Foc raza 1 se realizó según el bioensayo de punteadura en hojas propuesto por Companioni et al. (2003). Los filtrados de cultivo obtenidos se concentraron al 80% (v/v) del volumen inicial por rotoevaporación a presión reducida y a una temperatura de 45°C, en rotoevaporador Heidolph (Bioblock) teniendo en cuenta protocolos anteriores (Gómez, 1998; Borrás et al., 2001).
Se colectaron las hojas de mediana edad según la posición en la planta (hojas 3, 4, 5) de plantas adultas cultivadas en campo de los cultivares Gros Michel y FHIA-01. La expresión sintomatológica de necrosis y/o halo clorótico formada alrededor de los puntos de aplicación se consideró como prueba positiva de actividad fitotóxica. Se evaluó el desarrollo del área de la lesión elíptica (mm2) formada a las 48 horas, después de tratadas las hojas de banano con el filtrado del cultivo concentrado del hongo, y se calculó teniendo en cuenta la fórmula A= ð ·a·b [(A= Área de la elipse (mm2), a= semi- eje mayor (mm) y b= semi- eje menor (mm), ð= 3.14)]. Se determinó el día de mayor actividad fitotóxica del filtrado de cultivo concentrado de F. oxysporum sp. cubense raza 1.
RESULTADOS Y DISCUSIÓN
Evaluación de la excreción de metabolitos al medio de cultivo durante el crecimiento de Fusarium oxysporum f. sp. cubense raza 1 en Caldo Czapek
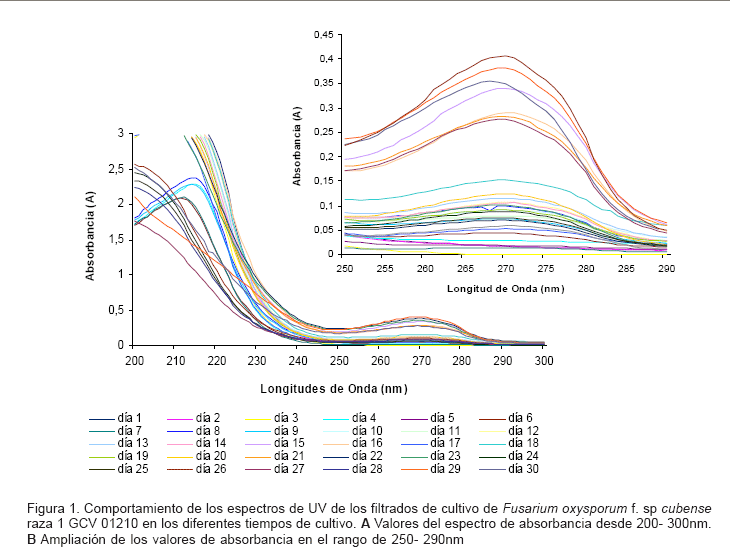
En la Figura 1 se muestra el comportamiento de los espectros de UV de los filtrados de cultivo de Fusarium oxysporum f. sp cubense raza 1 en los diferentes tiempos de cultivo. Los mayores valores de absorbancia registrados en la zona equivalente a los 270- 280 nm están asociados a los filtrados crudos de cultivo obtenidos a los 29 y 22 días de cultivo (0.406 y 0.381 respectivamente). Se observaron diferencias de absorbancia en la región equivalente a los 210- 220 nm, estas estuvieron probablemente asociadas a las ligeras desproporciones en la dilución final de la muestra, dado el consumo diferencial del medio de cultivo y sus componentes durante el crecimiento del microorganismo. De cualquier modo, fue evidente el cambio en la composición química del medio de cultivo, lo cual sugiere la excreción al medio de metabolitos fúngicos.
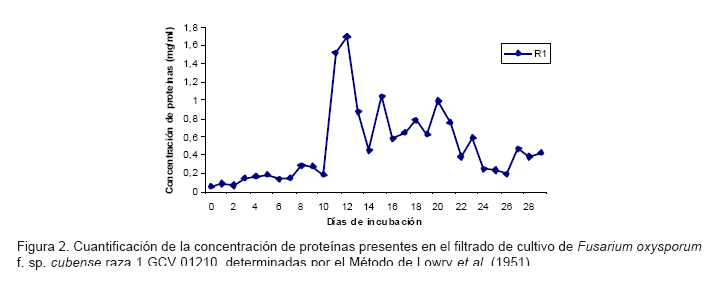
Determinación de la concentración de proteínas totales de filtrados de cultivos de Fusarium oxysporum f. sp. cubense raza 1
En la figura 2 se muestra la cuantificación de la concentración de las proteínas presentes en el filtrado de cultivo de Foc raza 1 GCV 01210. A partir de los 11 días el microorganismo es capaz de excretar al medio de cultivo moléculas de naturaleza proteica con varios patrones de excreción y máximos en los 13, 16, 19, 21, 24 y 28 días. Aunque los mayores niveles se alcanzaron a los 13 días con valores de 1.698 mg.ml-1, las proteínas excretadas en cada momento no tienen necesariamente que ser similares y por ende pudieran participar en eventos diferentes de reconocimiento y señalización para la resistencia de la planta al patógeno, al tiempo que pudieran ser útiles en el establecimiento de utilitarios moleculares para estudios de aislados diferentes del patógeno.
En trabajos realizados en la interacción piña-Fusarium subglutinans, Santos (2001) demostró la excreción al medio de cultivo de niveles equivalentes a 0.5 mg·ml-1 de filtrado de cultivo, determinado por el método de Lowry et al. (1951), a los 21 días de crecimiento del microorganismo en Caldo Czapek y aparecieron ocho proteínas diferentes en la resolución de la muestra por electroforesis bidimensional.
Las respuestas de defensa en las plantas pueden ser inducidas por moléculas presentes en la pared celular de microorganismos fitopatógenos o en su medio extracelular (Bottin et al., 1994).
Se ha demostrado la producción de numerosos elicitores por hongos o como parte de las interacciones planta-hongo. Estos son responsables de la inducción de la respuesta defensiva o la susceptibilidad, sirviendo como señales en la interacción entre la planta y el patógeno. En este contexto, Huet et al. (1993) mostraron que tales moléculas son proteínas de diferentes masas moleculares.
Determinación de la actividad fitotóxica de filtrados de cultivos de Fusarium oxysporum f. sp. cúbense raza 1
En la figura 3 se muestra el comportamiento de la actividad fitotóxica del filtrado de cultivo concentrado de Foc raza 1 GCV 01210 durante su crecimiento en medio de cultivo líquido por 30 días, frente a los cultivares susceptibles y resistentes respectivamente. La máxima actividad fitotóxica se obtuvo a los 15 días de crecido el hongo con una respuesta genotípica diferencial frente a los filtrados de cultivos concentrados a 80% de su volumen inicial. El genotipo FHIA 01, resistente a la enfermedad, se mostró más tolerante y exhibió una respuesta fitotóxica menor frente al filtrado de cultivo. El genotipo Gros Michel mostró alta susceptibilidad al filtrado y mayor rapidez de expresión de los síntomas. Se evidenció, además, que Foc raza 1 produce los mayores niveles de actividad fitotóxica extracelular en la fase logarítmica de su crecimiento aunque no existió un incremento acelerado del crecimiento del microorganismo medido en masa fresca del mismo hasta el día 15, se alcanzó el máximo crecimiento el día 21 posterior a la

Aunque Matyn (1991) plantea que en la fase de crecimiento logarítmico normalmente no se producen los metabolitos secundarios, otros autores (Durbin, 1983) postulan que la producción de compuestos fitotóxicos está estrechamente relacionada a una fase en particular en la curva de crecimiento de los microorganismos, aunque esto difiere para organismos diferentes.
Varios investigadores en varias interacciones planta-patógeno han descrito la obtención de filtrados de cultivos con actividad fitotóxica, e incluso han desarrollado esquemas para el aislamiento y purificación de los metabolitos involucrados (Ritieni et al., 1995; Capasso et al., 1997, Borrás et al., 2001; Santos, 2001; Companioni et al., 2003). La producción de estos metabolitos ocurre en diferentes fases de la curva de crecimiento de los microorganismos, pero estrechamente relacionada a una fase en particular para cada uno de ellos y muy influenciada por las condiciones de cultivo (Alberts et al., 1990; Jackson y Freer, 1991).
Las especies del género Fusarium producen una amplia variedad de metabolitos durante su crecimiento en medio de cultivo líquido (Logrieco et al., 1993; Altomare et al., 1995; Moretti et al., 1995; Ritieni et al., 1995), algunos de los cuales se han descrito como los responsables de la acción fitotóxica causada por el microorganismo que los produce.
Por otra parte, los metabolitos secundarios se han recomendado como caracteres para la separación de especies en trabajos de sistemática y muy útiles para la identificación de grupos particulares de aislados dentro de una especie (Lauren y Ringrose, 1997; Matsuyama, 1998; Cantalejo et al., 1999).
La producción de filtrados de cultivos y la determinación de la actividad fitotóxica incluye el momento óptimo para la cosecha del mismo, siendo este un paso indispensable para la obtención de agentes de selección precoz de resistencia a las enfermedades, avalado por el empleo de un bioensayo reproducible que permita seleccionar en grandes poblaciones genotipos resistentes y susceptibles a la enfermedad causada por el microorganismo en cuestión (Li et al., 1999).
CONCLUSIONES
Se obtuvo un filtrado de cultivo Fusarium oxysporum f. sp. cubense raza 1 GCV 01210 que concentrado al 80% de su volumen inicial mostró actividad fitotóxica diferencial sobre dos genotipos de Musa spp., produciendo los mayores niveles de actividad fitotóxica extracelular en la fase logarítmica de su crecimiento, con un valor máximo a los 15 días de crecido el hongo y la mayor concentración de proteínas totales fue cuantificada para el día 13 luego de la inoculación del hongo filamentoso alcanzando niveles de 1.698 mg.ml-1.
REFERENCIAS
Alberts, JF, WCA Genderblom, PG Thiel, WFO Marasas, DJ Van Schalkwyk, Y Behrend (1990) Effects of temperature an incubation period on production of Fumonisin B1 by Fusarium moniliforme. Applied and Environmental Microbiology 56(6):1729-1733
Altomare, C, A Logrieco, A Bottalico, G Mulé, A Moretti, A Evidente (1995) Production of type A Trichothecenes and ennientin B by Fusarium sambucinum Fuckel sensu lato. Mycopathologia 129:177-181
Borrás, O, R Santos, AP Matos, RS Cabral, M Arzola (2001) A first attempt to use Fusarium subglutinans culture filtrate for the selection of pineapple cultivars resistant to fusariose disease. Plant Breeding 120: 435-438
Bottin, A, C Véronési, D Pontier, MT Esquerré-Tugayé, JP Blein, C Rusterucci, P Ricci (1994) Differential responses of tobacco cells to elicitors from two Phytophthora species. Plant Physiol. Biochem. 32(3):373-378
Cantalejo, MJ, P Torondel, L Amate, JM Carrasco, E Hernández (1999) Detection of fusarin C and trichotecenes in Fusarium strains from Spain. J. Basic Microbiol. 39(3):143-153
Capasso, R, G Cristinzio, A Evidente, C Visca, A Parente (1997) Phytophorin, a phytotoxic peptide, and its phytotoxic agregates from Phytophthora nicotianae. Phytopath. Medit. 36:67-73
Companioni B, N Mora, L Díaz, A Pérez, M Arzola, P Espinosa, M Hernéndez, J Ventura, MC Pérez, R Santos, JC Lorenzo (2004) Identification of discriminant factors after treatment of resistant and susceptible banana leaves with Fusarium oxysporum f. sp. cubense - culture filtrates. Plant Breeding 123: 1-8
Companioni B, N Mora, M Arzola, J Ventura, MC Pérez, R Santos, JC Lorenzo (2004) Improved technique for rapid and non-destructive in vitro differentiation between resistant and susceptible banana clones of F. oxysporium f. sp cubense. Biotechnology Letters 26: 213 216
Companioni B, Arzola M, Rodríguez Y, Mosqueda M, Pérez MC, Borrás O, Lorenzo JC, Santos R (2003) Use of culture-derived Fusarium oxysporum f. sp. cubense, race 1 filtrates for rapid and non-destructive in vitro differentiation between resistant and susceptible clones of field-grown banana. Euphytica. 130:341-347
Durbin RD (1983) The Biochemistry of Fungal and Bacterial Toxins and their mode of action. En: JA Callow (Ed.) Biochemical Plant Pathology, pp.137-163. Springer. Dordrech
Gómez, R (1998) Selección in vitro a enfermedades. En: Pérez, P (Ed.) Propagación y mejora de plantas por biotecnología, pp. 327- 353. Instituto de Biotecnología de las Plantas. IBP. Santa Clara.
Huet, JC, JC Pernollet (1993) Sequences of acidic and basic elicitin isoforms secreted by Phytophthora megasperma megasperma. Phytochemistry 33(4):797-805
Hwang, S C (1984) Cultivation of banana using plantlets from meristem cultures. HortScience 19: 231-233
Jackson, MA, SN Freer (1991) The influence of carbon and nitrogen nutrition on Fusarin C biosynyhesis by Fusarium moniliforme. FEMS Microbiology Letters 82: 323-328
Lauren DR, MA Ringrose (1997) Determination of the fate of three Fusarium mycotoxins through wet-milling of maize using an improved HPLC analytical technique. Food Additives and Contaminants 14(5): 435-443
Li, S, GL Hartman, JM Widholm (1999) Viability staining of soybean suspension-cultured cells and a seedling stem cutting assay to evaluate phytotoxicity of Fusarium solani f. sp. glycines culture filtrate. Plant Cell Reports 18:375-380
Logrieco, A, A Moretti, C Altomare, A Bottalico, E Carbonell (1993) Occurrence and toxicity of Fusarium subglutinans from Peruvian maize. Mycopathologia 122:185-190
Lowry, OH, NJ Rosebrough, AI Farr, RJ Randall (1951) Protein measurement with the Folin phenol reagent. Journal Biol. Chem. 193: 265
Martyn, RD, Biles CL, Dillard EA (1991) Induced resistance to Fusarium wilt of watermelon under simulated field conditions. Plant Disease 75 (9): 874- 877
Matsuyama, N (1998) Presumptive identification of several phytopathogenic bacteria by novel diagnostic tests. J. Fac. Agr., Kyushus Univ. 43(3-4): 337-343
Moretti, A, A Logriego, A Bottalico, A Ritieni, G Randazzo, P Corda (1995) Beauvericin production by Fusarium subglutinans from different geographical areas. Mycol. Res. 99(3): 282-286
Novak, F J, H Brunner, R Afza, R Morpurgo, R K Upadhyay, M Van Duren, M Sacchi, J S Hawa, A Khatri, G Kahl, D Kaemmer, J Ramser, K Weising (1992) Improvement of Musa through biotechnology and mutation breeding. Proceeding of the workshop on Biotechnology applications for banana nd plantain improvement. 1992. San José. Costa Rica, pp. 143-158. INIBAP. Montpellier
Pérez, L, A Batlle, J Fonseca, V Montenegro (2003) Fusarium oxysporum f. sp. cubense in Cuba: reaction of cultivars and biocontrol. 2nd International Symposium on Fusarium wilt on banana. PROMUSA-INIBAP/EMBRAPA. Salvador de Bahía, Brasil. 22- 26 Sept. INIBAP. Montpellier
Pérez L (2004) Marchitamiento por Fusarium (Mal de Panamá) en bananos: una revisión actualizada del conocimiento presente sobre su agente causal. Fitosanidad 8(4): 27- 38
Pérez, V, JC Huet, C Nespoulous, JC Pernollet (1997) Mapping the elicitor and necrotic sites of Phytophthora elicitins with synthetic peptides and reporter genes controlled by Tobacco defense gene promoters. Molecular Plant-Microbe Interactions 10(6):750-760
Ritieni, A, V Fogliano, G Randazzo, A Scarallo, A Logrieco, A Moretti, L Mannina, A Bottalico (1995) Isolation and characterization of Fusaproliferin, A new toxic metabolite from Fusarium proliferatum. Natural Toxins 3:17-20
Rodríguez, A A, J C Ventura, R Rodríguez, J Pino, J López, M I Román (1991) Avances en el programa de mejoramiento genético del banano y el plátano en el INIVIT en Cuba: un avance de investigación. Infomusa 1 (1): 3-5
Rowe, P R, D L Richardson (1975) Breeding bananas for disease resistance, fruit quality and yield. Bull. 2. La Lima, Honduras. Tropical Agriculture Research Service (SIATSA), C.A.
Santos, R (2001) Aislamiento y purificación de metabolitos microbianos involucrados en la interacción piña-Fusarium subglutinans y su contribución al mejoramiento genético. Tesis presentada en opción al grado científico de Doctor en Ciencias. Universidad de Ciego de Ávila. Cuba
Silva, S, A. Pires de Matos, M D F Borgues, Z (1998) Cordeiro. Response of banana genotypes after Fusarium attack in field conditions of Brazil. Memorias Proceeding: XIII Reunión ACORBAT. Quito, Ecuador 98, 23-29 November
Simmonds, N W (1966) Bananas. 2nd. Ed., Longman. London
Sun, E S, H J Su (1984) Rapid method for determinig differential pathogenicity of Fusarium oxysporum f. sp. cubense using banana plantlets. Trop. Agric. 61: 7-8
Copyright (c) 2016 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
