Reseña bibliográfica Biotecnología Vegetal Vol. 15, No. 4:195 - 206, octubre - diciembre, 2015
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
Instituto de Biotecnología de las Plantas. UCLV. MES.
Organogénesis in vitro en el género Digitalis
Randel Martín, Borys Chong-Pérez, Naivy Pérez-Alonso*. *Autora para la correspondencia
Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas, Carretera a Camajuaní km 5.5. Santa Clara, Villa Clara, Cuba. e-mail: naivy@ibp.co.cu
RESUMEN
El género Digitalis es de especial interés gracias a las propiedades terapéuticas de sus metabolitos secundarios, conocidos genéricamente como cardenólidos. Estos son empleados en el tratamiento de enfermedades cardiovasculares y recientemente se han descrito sus propiedades anticancerígenas y antivirales dando respuesta a las principales causas de muerte a nivel mundial. Sin embargo, la producción en campo requiere de dos años para la obtención de semillas y además la variación de las condiciones ambientales influye en el contenido de cardenólidos. Por estas razones y las ventajas que ofrece el cultivo in vitro es que su producción mediante técnicas biotecnológicas ha sido objeto de estudio. La organogénesis ha arrojado resultados positivos, los cuales motivaron la realización del presente trabajo. El objetivo fue presentar una revisión de literatura científica en torno a la regeneración vía organogénesis en el género Digitalis, con atención especial a los factores que han determinado el éxito en la consecución de dicho proceso morfogenético.
Palabras clave: cardenólidos, morfogénesis, regeneración, reguladores de crecimiento
In vitro organogenesis in Digitalis genus
ABSTRACT
The genus Digitalis have special interest due to the therapeutic properties of its secondary metabolites, known generically as cardenolides. These compounds are commonly used in the treatment of cardiovascular disease. Moreover, anticancer and antiviral properties have been described recently. However, field production of this plant requires two years to obtain seeds and also changes in environmental conditions influencing the cardenolide content. For these reasons and the advantages of in vitro culture techniques have been studied. Organogenesis has shown very positive results, which led to the realization of this work. The aim was to present a review of the scientific literature about regeneration via direct and indirect organogenesis in Digitalis genus, with particular attention to the factors that have determined the success in achieving this morphogenetic process and its possible applications.
Key words: cardenolides, growth regulators, morphogenesis, regeneration
CONTENIDO
INTRODUCCIÓN
MÉTODO DE REGENERACIÓN IN VITRO: ORGANOGÉNESIS Material vegetal inicial
Organogénesis indirecta
Organogénesis directa Efecto de la composición del medio de cultivo
Organogénesis indirecta
Organogénesis directa Enraizamiento in vitro
DESARROLLO DE LA ORGANOGÉNESIS PARA LA PRODUCCIÓN DE CARDENÓLIDOS APLICACIONES DE LA ORGANOGÉNESIS
REFERENCIAS
INTRODUCCIÓN
A finales del siglo XVIII el médico británico William Withering descubrió propiedades terapéuticas en plantas del género Digitalis, desde ese entonces se han usado con fines farmacéuticos (Wu et al., 2012). Estas producen un arsenal de metabolitos secundarios conocidos genéricamente como cardenólidos para los cuales el hombre ha encontrado numerosos usos terapéuticos. Entre ellos, en enfermedades cardiovasculares (Feussner y Feussner, 2010), contra líneas celulares cancerígenas por su actividad anti-proliferativa y apoptótica (e.g., mama, próstata, melanoma, mieloma, páncreas, pulmón, leucemia, neuroblastoma, y adenocarcinoma renal) y la inflamación de pulmón en la fibrosis quística (Elbaz et al., 2012; Kreis et al., 2015). En los últimos años además se han empleado como antivirales y se ha descrito su uso potencial en el tratamiento de enfermedades neurodegenerativas (Kreis et al., 2015). Las propiedades medicinales de estas plantas dan respuesta a las principales causas de muerte a nivel mundial (cáncer y enfermedades cardiovasculares). Es por ello, que el desarrollo de estrategias biotecnológicas que permitan aumentar su producción es una necesidad actual (Sales et al., 2011).
El género Digitalis se encuentra extendido por diferentes regiones geográficas como: Europa occidental, el mediterráneo, el noroeste de África y se ha naturalizado en otras regiones subtropicales y templadas de Europa, Asia, América del Sur, Canadá, Estados Unidos (Warren, 2005). Sin embargo, a pesar de su amplia distribución, la producción de metabolitos secundarios varía considerablemente en condiciones de campo, donde varios factores ambientales condicionan esta respuesta. Además, es afectada por la variabilidad de los caracteres morfofisiológicos asociados a su producción debido a la gran capacidad de hibridación de estas plantas (Sales et al., 2011).
El cultivo in vitro de plantas de interés farmacéutico para el hombre, ha cobrado auge durante las últimas décadas. Esto se debe a sus ventajas, sobre todo por constituir una vía efectiva para producir un gran número de individuos en un tiempo relativamente corto comparado con los métodos convencionales de cultivo (Mohammed et al., 2015). Al mismo tiempo se puede lograr uniformidad del cultivo y aumento del rendimiento, con una producción continua durante todo el año, bajo condiciones ambientales controladas y optimizadas independientemente del clima y de la ubicación geográfica (Vanisree y Tsay, 2007). Por lo cual, el cultivo in vitro pudiera constituir una alternativa prometedora que permitiría estandarizar y satisfacer las demandas productivas del género en la industria farmacéutica. La producción in vitro del género Digitalis es muy importante al considerar que son plantas bianuales y la obtención de semillas tardan dos años después de plantadas (Mohammed et al., 2015).
En este campo se han realizado un gran número de investigaciones, mediante diversas estrategias biotecnológicas: la embriogénesis somática (Lindemann y Luckner, 1997), sistemas de inmersión temporal (Pérez-Alonso et al., 2009; Pérez-Alonso et al., 2012), la adición de precursores y elicitación (Patil et al., 2013; Pérez-Alonso et al., 2014a) y la organogénesis (Hagimori et al., 1982; Pérez-Bermúdez et al., 1984; Cacho et al., 1991; Fatima et al., 2009; Córdük y Aki, 2010; Gurel et al., 2011; Verma et al., 2011a,b; Patil et al., 2013; Karimi y Kazemitabar, 2013; Li et al., 2014; Pérez-Alonso et al., 2014b; Yücesan et al., 2014; Kreis et al., 2015; Mohammed et al., 2015). Esta última ha arrojado resultados positivos, los cuales motivaron la realización del presente trabajo, cuyo objetivo fue presentar una revisión de literatura científica en torno a la regeneración vía organogénesis en el género Digitalis, con atención especial a los factores que han determinado el éxito en la consecución de dicho proceso morfogenético.
MÉTODO DE REGENERACIÓN IN VITRO: ORGANOGÉNESIS
Los métodos de regeneración in vitro podrían lograrse en todas las especies de plantas, si se proveen las condiciones ambientales, se selecciona el explante y el medio de cultivo apropiados (George y Debergh, 2008).
La organogénesis, uno de los principales métodos de regeneración de plantas, puede clasificarse en indirecta y directa. La primera tiene lugar cuando la formación de brotes ocurre mediante una fase intermedia de formación de callos, mientras que la organogénesis directa, consiste en la propagación a partir de explantes, sin fases intermedias de callo (George y Debergh, 2008). Este proceso morfogenético se induce artificialmente por medio de reguladores del crecimiento (RC). Generalmente se emplean auxinas como: ácido naftalenacético (ANA), ácido indolacético (AIA), ácido indol-3-butírico (AIB), 2,4-diclorofenoxiacético (2,4-D) y citoquininas como bencilaminopurina (6-BAP), zeatina, kinetina y tidiazurón (TDZ) (Machakova et al., 2008). La respuesta in vitro puede variar debido a múltiples factores, entre ellos: el contenido endógeno y la biodisponibilidad de RC, la edad fisiológica del explante, así como la especie en estudio.
La organogénesis indirecta es un proceso morfogenético explorado en el género Digitalis, se ha logrado en D. obscura (Pérez-Bermúdez et al., 1984), D. purpurea (Hagimori et al., 1982; Pérez-Alonso et al., 2014b), D. lanata (Fatima et al., 2009), D. lamarkii (Verma et al., 2011b, Yücesan et al., 2014), y recientemente en D. mariana (Kreis et al., 2015). Mientras que la organogénesis directa se ha desarrollado con éxito en D. thapsi (Cacho et al., 1991), D. trojana (Córdük y Aki, 2010), D. davisiana (Gurel et al., 2011), D. lamarkii (Verma et al., 2011a), D. nervosa (Karimi y Kazemitabar, 2013), D. purpurea (Patil et al., 2013; Li et al., 2014) y en D. cariensis (Mohammed et al., 2015). Para su obtención se han empleado diferentes condiciones de cultivo in vitro, explantes y RC. En el presente trabajo se realiza un breve análisis de algunos resultados científicos de esta línea de investigación.
Material vegetal inicial
La adecuada selección del explante inicial marca el éxito en el cultivo de tejidos. Los principales tipos de explantes usados para el desarrollo de protocolos para la regeneración de plantas tanto por organogénesis directa como indirecta en Digitalis han sido: segmentos radicales, foliares, nodales, hipocotilos y los explantes denominados FBT (del inglés: flamingo bill-type) por autores como Gurel et al. (2011) y Mohammed et al. (2015). De ellos los más empleados han sido los segmentos foliares. Estos se obtienen de plantas formadas de semillas germinadas in vitro o explantes ex vitro como yemas o segmentos foliares. Sin embargo, cada proceso morfogenético y especie vegetal tiene sus particularidades.
Organogénesis indirecta
Para lograr la organogénesis indirecta en investigaciones donde se ha comparado el potencial regenerativo de varios tipos de explantes incluyendo el segmento foliar, se ha concluido que estos tejidos son menos sensibles a los reguladores del crecimiento que los radicales, hipocotilos y cotiledonales (Pérez-Bermúdez et al., 1984). Estos resultados han sido confirmados en D. davisiana, donde, además, se ha comprobado la eficiencia regenerativa de los explantes FBT (Gurel et al., 2011). Estos autores sugieren que una vez que los meristemos son eliminados de los tejidos jóvenes, el desarrollo de brotes ocurre en el explante en el cual las células regenerativas reciben los RC y nutrientes requeridos para su diferenciación.
En D. mariana, las raíces se consideran como los explantes más favorables para la formación de callos y posterior regeneración de brotes (Kreis et al., 2015). Sin embargo, para D. lanata se han informado resultados contrastantes. En esta especie los segmentos foliares se consideraron ideales para el cultivo in vitro por su alto poder regenerativo, al com pararlos con tallos, hipocotilos y raíces (Fatima et al., 2009). Los segmentos foliares también han sido efectivos en D. purpurea (Pérez-Alonso et al., 2014b) y D. lamarckii (Yücesan et al., 2014). Evidentemente la morfogénesis tiene un fundamento genotípico y la respuesta diferencial del material vegetal de partida va a estar condicionada por esto. Cada especie presenta respuestas diferentes bajo las mismas condiciones de cultivo.
Organogénesis directa
En la organogénesis directa los principales materiales vegetales de partida utilizados han sido segmentos foliares en diversas especies e.g., D. trojana (Córdük y Aki, 2010), D. lamarckii (Verma et al., 2011a), D. purpurea (Li et al., 2014). Patil et al. (2013) describieron los segmentos nodales como los más efectivos para la regeneración de plantas en D. purpurea. Mientras que en D. thapsi la mejor respuesta la obtuvieron con hipocotilos, superior a la obtenida con explantes foliares y radicales (Cacho et al., 1991). Estos resultados coinciden con los referidos por Karimi y Kazemitabar (2013) en D. nervosa, los cuales definieron el hipocotilo como el mejor explante para lograr la organogénesis directa, independientemente de las concentraciones de los reguladores de crecimiento estudiados. Estos resultados fueron similares en D. davisiana donde identificaron a los hipocotilos y los FBT como los mejores explantes para la regeneración (Gurel et al., 2011). En D. cariensis estos últimos (FBT) fueron los únicos que permitieron la obtención de brotes (Mohammed et al., 2015), mientras que los hipocotilos, los segmentos cotiledonales así como las raíces fueron ineficientes en el desarrollo de la organogénesis directa.
A través de estos ejemplos se comprueba una vez más que cada genotipo, fuente de explante y fase de desarrollo de este último determinan la respuesta morfogenética in vitro. Cada tipo de explante además de expresar una respuesta diferencial parece tener umbrales de sensibilidad diferentes (Cacho et al., 1991).
Los resultados informados en las diferentes especies del género Digitalis corroboran la importancia del genotipo y el tipo de explante en interacción con los reguladores del crecimiento y nutrientes empleados en el medio de cultivo para lograr la organogénesis.
Efecto de la composición del medio de cultivo
En la literatura científica se ha descrito el efecto de los elementos del medio de cultivo basal sobre la respuesta morfogenética. Cada uno de ellos influye de manera coordinada sobre el ciclo celular y por tanto son responsables de los fenómenos observados durante el cultivo in vitro (George y Debergh, 2008). En el género Digitalis, el elemento más estudiado por su importancia ha sido el efecto de los RC sobre la morfogénesis.
Las auxinas y citoquininas son RC importantes en el crecimiento y la morfogénesis en el cultivo de tejidos y órganos de plantas. Gracias a los efectos fisiológicos de los RC, es posible inducir respuestas morfofisiológicas de interés durante el cultivo in vitro. Esto se debe a su influencia sobre el ciclo celular. La combinación de auxinas con citoquininas promueve procesos como la formación y el crecimiento de callos, suspensiones celulares, órganos entre otros (Machakova et al., 2008).
En el género Digitalis se describe el empleo de ambos tipos de RC durante los procesos de organogénesis directa e indirecta que a continuación serán referidos.
Organogénesis indirecta
En la organogénesis indirecta se han utilizado para la formación de callos auxinas como AIA (Hagimori et al., 1982) y 2,4-D (Pérez-Alonso et al., 2014b) ambos trabajos en D. purpurea para lograr la formación de callos. Sin embargo, un numeroso grupo de investigadores apunta que la combinación de auxinas y citoquininas durante este proceso es más efectiva en varias especies del género y se destaca que se requiere en todos los casos estudiados de una alta relación citoquinina/auxina (Pérez-Bermúdez et al., 1984; Fatima et al., 2009; Verma et al., 2011b; Yücesan et al., 2014; Kreis et al., 2015).
Por ejemplo, en D. obscura se comprobó que las auxinas 2,4-D y ANA promueven la formación de callos que al ser combinadas con 6-BAP se obtiene un mejor resultado en el proceso morfogenético (Pérez-Bermúdez et al., 1984). En este trabajo la formación de brotes se logró solamente con la combinación de ANA y 6-BAP, cuando la proporción de la citoquinina fue mayor que la de auxina. Los autores refieren que una vez obtenidos los callos, fueron transferidos a un medio de cultivo sin reguladores del crecimiento donde el 50.0% formó brotes. Resultados similares en D. lanata demostraron que el uso de ANA fue estímulo suficiente para la formación de callos, sin embargo cuando se empleó en combinación con 6-BAP igual que en el caso anterior, este proceso fue más efectivo (Fatima et al., 2009). No obstante, para la formación de brotes, la adición de 6-BAP al medio de cultivo fue suficiente y el número de brotes se incrementó con la concentración de citoquinina. Estos autores, además, comprobaron que la presencia de carbohidratos (sacarosa, maltosa, fructosa y glucosa) en el medio de cultivo influye en la producción de callos y en el potencial de regeneración.
Por otra parte, en D. lamarckii fue efectiva la combinación de ANA con 6-BAP en proporciones casi iguales para la formación de callos (Verma et al., 2011b), mientras que el balance hacia las citoquininas fue el detonador para la formación de brotes. El aumento de la concentración de citoquininas, informaron estos investigadores, fue proporcional a la producción de brotes, de modo que en solo seis semanas estos alcanzaron de 1.5-2.0 cm de longitud. Por otro lado, Pérez-Alonso et al. (2014b) desarrollaron un protocolo de regeneración vía organogénesis indirecta en D. purpurea. En este, los autores describen que la formación de callos se logró con el empleo de 2,4-D y que la adición de 6-BAP tuvo un efecto negativo en este proceso; mientras que al combinar 6-BAP con AIA lograron la formación de plántulas a partir de callos.
Combinar más de una auxina con citoquinina también ha sido una estrategia positiva. Tal es el caso en D. mariana, especie endémica de Portugal e importante por su contenido de cardenólidos. Kreis et al (2015) desarrollaron un protocolo de propagación vía organogénesis indirecta para dicha especie. Estos autores informan que la formación de callos, se logró a partir de explantes radicales en un medio de cultivo con 2.0 mg l-1 de kinetina, 10.0 mg l-1 de AIA y 0.3 mg l-1 de 2,4-D. Bajo estas mismas condiciones los explantes foliares mostraron menor eficiencia. Además, con el objetivo de obtener plantas completas a partir de los callos usaron 6-BAP y AIA en medio de cultivo líquido.
La tabla 1 muestra las condiciones en las que se ha desarrollado el proceso organogénico indirecto en diferentes especies del género donde la combinación de auxinas con citoquininas ha sido eficaz en numerosas investigaciones.
Organogénesis directa
La organogénesis directa se ha logrado en el género Digitalis también mediante el empleo de auxinas y citoquininas. Se ha informado que el proceso se puede lograr con citoquininas solamente, por ejemplo con 6-BAP en D. purpurea (Patil et al., 2013). No obstante, numerosos trabajos concluyen que se obtienen mejores resultados al combinar ambos reguladores del crecimiento (Cacho et al., 1991; Córdük y Aki, 2010; Gurel et al., 2011; Verma et al., 2011a; Karimi y Kazemibatar, 2013; Patil et al., 2013; Li et al., 2014; Mohammed et al., 2015).
En D. thapsi, Cacho et al. (1991) añadieron las auxinas 2,4-D, AIA y ANA a diferentes concentraciones (0.1, 0.5, 1.0 y 2.0 mg l-1) por separado. Concluyeron que el empleo de AIA no indujo respuestas morfogenéticas en los explantes foliares. Por otra parte, en los explantes radicales estas auxinas indujeron primeramente hinchazón con posterior necrosis; mientras que en los hipocotilos indujeron la formación de callos y raíces. Sin embargo, el empleo de 6-BAP indujo la formación de brotes. Este resultado se observó en todos los explantes estudiados, en los foliares hasta en el 50%, en los hipocotilos hasta en el 45% mientras que en los radicales esta respuesta fue inversa y disminuyó con la concentración del regulador con 13% como el máximo valor alcanzado. Estos mismos autores describen que al combinar ANA tanto con 6-BAP como con kinetina resultó ser la auxina más efectiva para la regeneración en explantes foliares; mientras que la combinación de AIA con 6-BAP fue la más efectiva para explantes radicales e hipocotilos. Este constituye otro ejemplo donde se puede observar que la interacción entre el material vegetal de partida y las condiciones de cultivo definen las respuestas morfogenéticas observadas, que son además específicas para cada genotipo.
El efecto positivo de la citoquinina TDZ en la organogénesis directa en el género Digitalis ha sido descrito por varios autores. Por ejemplo, en D. davisiana, Gurel et al. (2011) observaron que dicho RC indujo organogénesis directa en los explantes cultivados en presencia de todas las concentraciones por ellos evaluadas (0.10, 0.25 y 0.50 mg l-1) y aumentó el número de brotes por explante. No obstante, en la literatura científica se describe que el efecto del TDZ es usualmente dependiente de las concentraciones, lo que significa que bajas concentraciones inducen la proliferación de brotes axilares mientras que altas concentraciones inducen el desarrollo de yemas adventicias (Yildirim y Tucker, 2009). En este sentido, Mohammed et al. (2015) sugieren que el éxito en el proceso de regeneración vía organogénesis directa en D. cariensis se debe a la respuesta del explante FBT al TDZ en combinación con una auxina como el AIA. Estos resultados son homólogos a los descritos en D. davisiana cuando se combinó TDZ con AIA a 0.25 y 0.50 mg l-1 y obtuvieron vía organogénesis directa los mejores rendimientos en cuanto a brotes por explante (Gurel et al., 2011). Con esta combinación también obtuvieron el mayor número de brotes por explantes en D. cariensis (Mohammed et al., 2015).
Por otra parte, en D. lamarckii se evaluó el efecto de varias citoquininas (6-BAP, kinetina, zeatina y TDZ) y la combinación de estas con AIB durante la organogénesis directa (Verma et al., 2011a). Tanto la zeatina como la kinetina resultaron inefectivas para la regeneración. Por otra parte, el 6-BAP y el TDZ indujeron dicho proceso morfogenético. La actividad de las citoquininas, teorizan los autores, varía de acuerdo con la tasa de absorción, velocidad de translocación a los centros meristemáticos y a determinados procesos metabólicos en los cuales las citoquininas pueden ser degradadas o conjugadas con azúcares o aminoácidos para formar compuestos biológicos inertes. El TDZ resultó más efectivo sobre todo cuando se combinó con AIB, lo cual fue atribuido a su estabilidad en el medio de cultivo y a su permanencia en los tejidos vegetales. Li et al (2014) también usaron TDZ para la regeneración directa de D. purpurea y observaron que al aumentar la concentración de TDZ de 0.1-1.0 mg l-1 se promovió la formación directa de brotes. En cambio, al combinar el TDZ con ANA los resultados fueron los mejores.
Por su parte, Córdük y Aki (2010) en D. trojana evaluaron el efecto sobre la regeneración del 6-BAP y ANA, los que tuvieron mayor éxito con 0.1 mg l-1 de ANA en combinación con 3.0 mg l-1 de 6-BAP. Conjuntamente extendieron el tiempo de cultivo a 12 semanas y obtuvieron un promedio de 28 brotes en el 32.0% de los explantes. Al respecto, Karimi y Kazemitabar (2013) en D. nervosa, a pesar de que usaron las mismas condiciones de cultivo empleadas por Córdük y Aki (2010), obtuvieron menor rendimiento (6-9 brotes) durante cinco semanas de cultivo.
Otro aspecto a considerar es el efecto de la formulación basal del medio de cultivo sobre la organogénesis. En este sentido, Mohammed et al. (2015) en la organogénesis directa en D. cariensis concluyeron que la formulación LS (Linsmaier y Skoog, 1965) fue más efectiva que la MS (Murashige y Skoog, 1962) y la B5 (Gamborg et al. 1968) y lo atribuyeron a la alta concentración de tiamina, característica del medio. Estos resultados coinciden con los obtenidos por Gurel et al. (2011) quienes probaron el efecto de diferentes formulaciones basales en la organogénesis directa de D. davisiana. Este grupo de investigadores comprobó que la formulación LS, fue la más efectiva en la regeneración, resultado que también atribuyen a la alta concentración de tiamina del medio correlacionada con el vigor y la longevidad del tejido cultivado durante la formación de órganos.
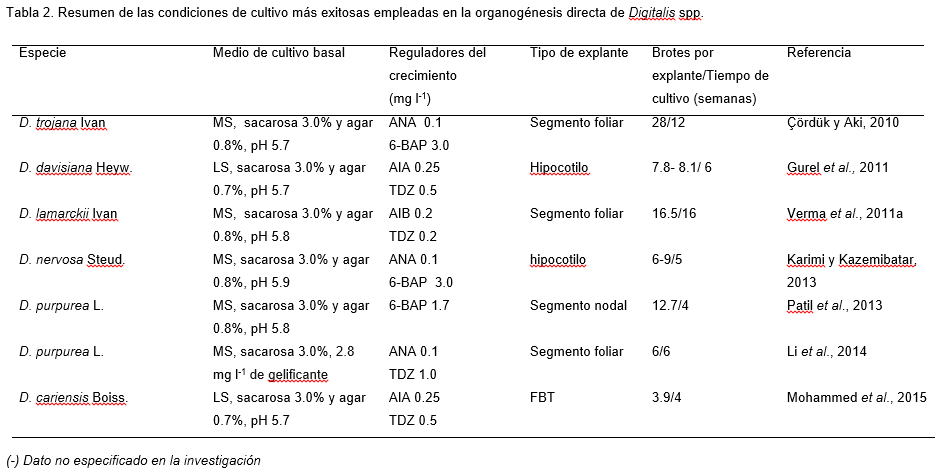
De los resultados descritos en la literatura científica en el género Digitalis se puede concluir que la respuesta a las condiciones de cultivo in vitro depende en gran medida de la especie de la que se trate. A pesar de que se conocen algunas respuestas inducidas por los RC, cada genotipo determina la magnitud y ruta a seguir, sin importar que el estímulo sea el mismo. Las tablas 1 y 2 contienen un resumen de las condiciones más exitosas para la consecución de la organogénesis directa e indirecta respectivamente.
Enraizamiento in vitro
Durante los procesos de propagación vía organogénesis en el género Digitalis se ha estudiado el efecto de los RC en esta fase. Estos órganos se forman con facilidad durante el cultivo in vitro independientemente del método de regeneración. Tal es el caso, que en varias especies del género se ha notificado su formación en medio de cultivo sin necesidad de reguladores del crecimiento (Cacho et al., 1991; Li et al., 2014).
Al respecto, Gurel et al. (2011) transfieren plantas de D. davisiana regeneradas vía organogénesis directa, a medio de cultivo para formación de raíces con auxinas, donde evalúan el efecto de AIA (0.1 o 0.5 mg l-1) y AIB (0.1 o 0.5 mg l-1). En todos los tratamientos incluso en los que no se utilizan auxinas formaron raíces, sin embargo el mejor tratamiento fue 0.5 mg l-1 de AIA, donde se produjo el mayor número de raíces por brote (8.1). Este mismo tratamiento fue empleado en plantas de D. lamarckii regeneradas por organogénesis indirecta, con un enraizamiento de más del 90% (Verma et al., 2011b). De igual manera, en D. cariensis Mohammed et al. (2015) evalúan también el efecto de AIA ampliando el rango de concentraciones (0.1, 0.5 y 1.0 mg l-1). El mayor número de raíces por brote (5.6) se obtuvo cuando se adicionó al medio de cultivo 1.0 mg l-1 de AIA en un período de tres semanas. Otras auxinas utilizadas para el desarrollo de raíces son AIA yANA. Al respecto, en D. purpurea se comprobó que aumentan la eficiencia del mencionado proceso en solo cuatro semanas (Patil et al., 2013).

A pesar de la marcada influencia de los RC, otra estrategia empleada para una adecuada formación y crecimiento de la raíz es un medio de cultivo con bajo potencial osmótico. Este se logra disminuyendo los niveles de sales inorgánicas (e.g. 14 o 14 MS), pues es conocido que altos niveles de las mismas inhiben la formación de raíces. En plantas de D. purpurea regeneradas via organogénesis directa se obtuvo con éxito la formación de raíces en medio de cultivo sin RC empleado 14 MS y disminuyendo la sacarosa al 2% (Li et al., 2014). Por su parte Cördük y Aki (2010) en D. trojana implementaron una estrategia diferente para el enraizamiento. Para ello trasplantaron brotes regenerados a un medio de cultivo con las sales MS y carbón activado 1.0% (m/v); lo cual favorece notablemente el desarrollo de las raíces.
DESARROLLO DE LA ORGANOGÉNESIS PARA LA PRODUCCIÓN DE CARDENÓLIDOS
El desarrollo de técnicas biotecnológicas comenzó en especies de Digitalis desde hace varias décadas por el entusiasmo que representaba la posibilidad de utilizar sus facilidades para la producción de cardenólidos. Debido a su potencial farmacológico se han realizado consistentes esfuerzos para dilucidar las rutas biosintéticas que rigen la producción de los mismos aunque sigue siendo limitado el conocimiento de dichas vías metabólicas (Kreis y Müller-Uri, 2013). Según Eisenbeiß et al. (1999) este proceso es básicamente dependiente de la diferenciación morfológica, lo que indica que es necesario desarrollar métodos organogénicos.
Investigaciones realizadas en diferentes especies del género Digitalis han correlacionado el contenido de cardenólidos con las diferentes condiciones de cultivo estudiadas. Estas enmarcan el efecto de la luz, de sales minerales, el pH del medio de cultivo, adición de precursores y con mayor importancia el empleo de RC durante los procesos de organogénesis (Hagimori et al., 1982; Cacho et al., 1991; Gurel et al., 2011).
Hagimori et al. (1982) evaluó el efecto de los reguladores del crecimiento 6-BAP, AIA, ANA y 2,4-D sobre la formación de digitoxina. De este trabajo concluyen que el 6-BAP estimula la formación de digitoxina a la vez que estimula la formación de brotes, sin embargo, una alta concentración (10 mg l-1) inhibe dicha producción aunque no afecta el crecimiento. Lo mismo ocurre con el AIA y la producción de digitoxina, mientras a 10 mg l-1 esta auxina también inhibe el crecimiento. La producción de digitoxina se favoreció con 0.1 mg l-1 de ANA. Por otro lado las menores concentraciones de 2,4-D (0.01 mg l-1) fueron las que estimularon la producción de este cardenólido. Finalmente concluyeron que el grado de diferenciación del brote, fue paralelo al grado de producción de digitoxina. De modo que la concentración de RC que favoreció la organogénesis, favoreció a su vez la producción de digitoxina.
En D. davisiana la producción de cardenólidos (lanotosido C y digoxina) in vitro fue correlacionada con la composición nutricional y de RC del medio de cultivo (Gurel etal., 2011). La mayor acumulación de digoxina se obtuvo de la regeneración en medio de cultivo LS o B5 con 0.5 mg l-1 TDZ y 0.25 mg l-1 de AIA, produciéndose 12.59 y 11.93 mg gMS-1 de digoxina, respectivamente. Estos autores además destacan que se acumula mayor contenido de cardenólidos en composición total de sales que reducidas a la mitad, lo cual parece estar relacionado con la mayor cantidad de nutrientes presentes en el medio de cultivo. Respecto a los tratamientos con RC por ellos evaluados concluyen que la combinación de auxina (ANA) con citoquinina (TDZ) fue más efectiva que el empleo de las mismas por separado. En D. nervosa se comprobó de igual modo que al combinar auxinas con citoquininas (ANA y 6-BAP) para la regeneración vía organogénesis directa, se favorece la producción de cardenólidos, no obstante los mejores resultados se obtienen cuando la proporción de ANA es menor que la de 6-BAP (Karimi y Kazemitabar, 2013).
Incorporar auxinas (ANA, AIA y 2,4-D) al medio de cultivo promueve la acumulación de cardenólidos en D. purpurea. Sin embargo, un medio de cultivo con 1.7 mg l-1 6-BAP produce los mejores resultados en la organogénesis directa y en la acumulación de cardenólidos paralelamente (Patil et al., 2013). Mientras, en D. nervosa durante la organogénesis directa, la auxina ANA tuvo un efecto negativo sobre la producción de cardenólidos, mientras que la citoquinina 6-BAP resultó positiva. Al combinar las máximas concentraciones de 6-BAP con pequeñas concentraciones de ANA lograron los mejores resultados para la producción de cardenólidos y la organogénesis (Karimi y Kazemibatar, 2013).
El contenido de cardenólidos en condiciones de cultivo in vitro de manera general se ha comportado con resultados inferiores a los observados en campo, por lo que numerosas investigadores han sugerido el empleo de estrategias biotecnológicas que optimicen la producción bajo condiciones controladas. En estos trabajos la organogénesis extiende sus horizontes hacia aplicaciones que trascienden la micropropagación y albergan esperanzas ante esta polémica.
APLICACIONES DE LA ORGANOGÉNESIS
La organogénesis directa e indirecta constituye un método de regeneración de gran valor en varios géneros incluyendo Digitalis. Su aplicación más antigua se ha enmarcado en la propagación masiva de plantas convirtiéndose en una técnica popular en la micropropagación comercial. A la vez, se ha extendido su uso para la conservación de germoplasma sobre todo en especies endémicas del género que se encuentran en peligro de extinción y que por su importancia farmacológica lo requieren como D. lamarckii (Verma et al., 2011b).
Por otra parte, las investigaciones más recientes describen el empleo de protocolos de regeneración vía organogénesis en los programas de mejoramiento genético (Pérez-Alonso et al., 2014; Yücesan et al., 2014). Tal es el caso, que la literatura científica refiere la necesidad de utilizarlos en el desarrollo de la ingeniería metabólica donde la transformación genética juega un papel fundamental en el estudio de la producción de cardenólidos (Pérez-Alonso et al., 2014; Kreis et al., 2015). Sin embargo, las aplicaciones de la ingeniería metabólica en el estudio de las rutas biosintéticas de metabolitos secundarios de interés se han visto frustradas por los fracasos en los procesos biológicos básicos relacionados con los métodos de regeneración (Verpoorte, 2007). Por tanto, es de especial interés en la comunidad científica el desarrollo de manera eficiente de métodos de regeneración.
Hasta la fecha, en el género Digitalis existen pocos estudios realizados en programas de mejoramiento genético (Sales et al., 2007). En D. minor se empleó un protocolo de transformación vía A. tumefasciens, el cual permitió introducir el gen foráneo de Arabidopsis thaliana HMG1, clave en la ruta del ácido mevalónico. Estos autores regeneraron las plantas vía organogénesis y fue posible obtener transformantes con mayor producción de esteroles y cardenólidos aunque en estos últimos no fueron tan exitosos.
Recientemente un grupo de investigadores desarrolló otro protocolo de transformación genética en D. purpurea, para cuya regeneración de transformantes emplean un protocolo de organogénesis directa (Li et al., 2014). A la par en esta misma especie también se desarrolló un protocolo de transformación cuya regeneración ocurre vía organogénesis indirecta (Pérez-Alonso et al., 2014). Ambos autores describen su empleo para el desarrollo de estrategias que permitan alcanzar un incremento notable en el contenido de cardenólidos así como el estudio de las rutas metabólicas que rigen su biosíntesis.
Hoy las aplicaciones de la organogénesis en el género Digitalis trascienden la micropropagación y además de que han brindado conocimientos de la morfogénesis, están inmersas en programas de mejoramiento genético. La producción in vitro de cardenólidos es una meta que se hace alcanzable mediante la concurrencia de alternativas biotecnológicas. Mientras, la organogénesis continúa siendo una necesidad sin la cual dicho objetivo no podrá ser posible.
REFERENCIAS
Cacho M, Morán M, Herrera MT, Fernández-Tárrago J, Corchete MP (1991) Morphogenesis in leaf, hypocotyl and root explants of Digitalis thapsiL. cultured in vitro. Plant Cell Tiss Organ Cult 25: 117-123
Cördük N, Aki C (2010) Direct shoot organogenesis of Digitalis trojana Ivan, an endemic medicinal herb of Turkey. African J of Biotech 9: 1587-1591
Eisenbeiß M, Kreis W, Reinhard E (1999) Cardenolide biosynthesis in light- and dark-grown Digitalis lanata shoot cultures. Plant Physiol Biochem 37: 13-23
Elbaz HA, Stueckle TA, Wang HL, O'Doherty GA, Lowry DT, Sargent LM, Wang L, Dinu CZ, Rojanasakul Y (2012) Digitoxin and a synthetic monosaccharide analog inhibit cell viability in lung cancer cells. Toxicol Appl Pharmacol 258: 51-60
Fatima Z, Mujib A, Fatima S, Arshi A, Umar S (2009) Callus induction, biomass growth, and plant regeneration in Digitalis lanata Ehrh: influence of plant growth regulators and carbohydrates. Turk J Bot 33: 393-405
Feussner JR, Feussner DJ (2010) Reassessing the efficacy of digitalis: from routine treatment to evidence-based medicine. Am J Med Sci 339: 482484
George EF, Debergh PC (2008) Micropropagation: Uses and Methods. En: George, EF, Hall M A, De KlerK GJ (Eds) Plant propagation by tissue culture 3rd Edition, pp. 29-64. Springer. Dordrecht
Gurel E, Yücesan B, Aglic E, Gurel S, Verma SK, Sokmen M, Sokmen A (2011) Regeneration and cardiotonic glycoside production in Digitalis davisiana Heywood (Alanya Foxglove). Plant Cell Tiss Organ Cult 104: 217-225
Hagimori M, Matsumoto T, Obi Y (1982) Studies on the production of Digitalis cardenolides by plant tissue culture. II Effects of light and plant growth substances on digitoxin formation by undifferentiated cells and shoot-forming cultures of Digitalis purpurea L. grown in liquid media. Plant Physiol 69: 653-656
Karimi M, Kazemitabar SK (2013) Study on the production of cardiac glycosides in direct regenerated shoots of Foxglove (Digitalis nervosa). Intl J Agron Plant Prod 4: 204-211
Kreis W, Haug B, Yücesan B (2015) Somaclonal variation of cardenolide content in Heywood's foxglove, a source for the antiviral cardenolide glucoevatromonoside, regenerated from permanent shoot culture and callus. In Vitro Cell Dev Biol-Plant 51: 35-41
Kreis W, Müller-Uri F (2013) Cardenolide aglycone formation in Digitalis. En: Bach TJ, Rohmer M (Eds) Isoprenoid synthesis in plants and microorganisms: new concepts and experimental approaches, pp. 425-438. Springer Science + Business Media. New York
Li Y, Gao Z, Piao C, Lu K, Wang Z, Cui ML (2014) A stable and efficient Agrobacterium tumefaciens-mediated genetic transformation of the medicinal plant Digitalis purpurea L. Appl Biochem Biotechnol 172: 1807-1817
Lindemann P, Luckner M (1997) Biosynthesis of pregnane derivatives in somatic embryos of Digitalis lanata. Phytochemistry 46: 507-513
Linsmaier E, Skoog F (1965) Organic growth factor requirements of tobacco tissue cultures. Physiol Plant 18: 100-127
Machakova I, Zazimalova E, George EF (2008) Plant Growth Regulators I: Introduction; Auxins, their Analogues and Inhibitors. En: George E, Hall M, De Klerk G-J (Eds) Plant Propagation by Tissue Culture 3rd Edition, pp. 175-204 Springer. Dordrecht
Mohammed A, Yücesan B, Demir-Ordu Ö, Cihangir C, Eker I, Kreis W, Gürel E (2015) In vitro regeneration and cardenolide determination of an endemic foxglove, Digitalis cariensis. In Vitro Cell Dev Biol-Plant 51: 438-44
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant 15: 473-497
Patil JG, Ahire M, Nitnaware K, Panda S, Bhatt V, Kishor P, Nikam T (2013) In vitro propagation and production of cardiotonic glycosides in shoot cultures of Digitalis purpurea L. by elicitation and precursor feeding. Appl Microbiol Biotechnol 97: 2379-93
Pérez-Alonso N, Arana Labrada F, Capote A, Pérez A, Sosa R, Mollineda A, Jiménez E (2014a) Estimulación de la producción de cardenólidos en brotes de Digitalis purpurea L. cultivados in vitro mediante la adición de elicitores. Revista Colombiana de Biotecnología XVI (1): 51-61
Pérez-Alonso N, Chong-Pérez B, Capote A, Pérez A, Izquierdo Y, Angenon G, Jiménez E (2014b) Agrobacterium tumefaciens-mediated genetic transformation of Digitalis purpurea L. Plant Biotechnol Rep 8: 387-397
Pérez-Alonso N, Capote-Pérez A, Gerth A, Jiménez E (2012) Increased cardenolides production by elicitation of Digitalis lanata shoots cultured in temporary immersion systems. Plant Cell Tiss Organ Cult 110: 153-162
Pérez-Alonso N, Wilken D, Gerth A, Jähn A, Nitzsche H-M, Kerns G, Capote-Pérez A, Jiménez E (2009) Cardiotonic glycosides from biomass of Digitalis purpurea L. cultured in temporary immersion systems. Plant Cell Tiss Organ Cult 99: 151-156
Pérez-Bermúdez P, Brisa MC, Cornejo MJ, Segura J (1984) In vitro morphogenesis from excised leaf explants of Digitalis obscura L. Plant Cell Rep 3: 8-9
Sales E, Müller-Uri F, Nebauer SG, Segura J, Kreis W, Arrillaga I (2011) Digitalis. En: Kole, C (Ed) Wild Crop Relatives: Genomic and Breeding Resources, Plantation and Ornamental Crops, pp. 73-112. Heidelberg Springer-Verlag. Berlin
Sales E, Munoz-Bertomeu J, Arrillaga I, Segura J (2007) Enhancement of cardenolide and phytosterol levels by expression of an N-terminally truncated 3-hydroxy-3-methyglutaryl CoA reductase in transgenic Digitalis minor. Planta Med 73: 605-610
Vanisree M, Tsay H-S (2007) Plant cell cultures: Production of biologically important secondary metabolites from medicinal plants of Taiwan. En: Kayser O, Quax W (Eds) Medicinal plant biotechnology. From basic research to industrial application, pp. 267-285. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim
Verma S, Yücesan B, Gürel S, Gürel E (2011a) Direct shoot regeneration from leaf explants of Digitalis lamarckii, an endemic medicinal species. Turk J Biol 35: 689-695
Verma S, Yücesan B, Sahin G, Gürel S, Gürel E (2011b) Indirect somatic embryogenesis and shoot organogenesis from cotyledonary leaf segments of Digitalis lamarckii Ivan, an endemic medicinal species. Turk J Biol 35: 743-750
Warren B (2005) Digitalis purpurea. Am J Cardiol 95: 544
Wu B, Li Y, Yan H, Ma Y, Luo H, Yuan L, Chen S, Lu S (2012) Comprehensive transcriptome analysis reveals novel genes involved in cardiac glycoside biosynthesis and mlncRNAs associated with secondary metabolism and stress response in Digitalis purpurea. BMC Genomics 13: 1-23
Yildirim AB, Turker AU (2009) In vitro adventitious shoot regeneration of the medicinal plant meadowsweet (Filipendula ulmaria (L.) Maxim). In Vitro Cell Dev Biol Plant 45: 135-144
Yücesan B, Müller-Uri F, Kreis W, Gürel E (2014) Cardenolide estimation in callus-mediated regenerant of Digitalis lamarckii Ivanina (dwarf foxglove). In Vitro Cell Dev Biol-Plant 50: 137-142
Recibido: 19-06-2015
Aceptado: 23-09-2015
Copyright (c) 2016 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
