Artículo original Biotecnología Vegetal Vol. 15, No. 4: 217 - 225, octubre - diciembre, 2015
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
Instituto de Biotecnología de las Plantas. UCLV. MES.
Efecto del ácido salicílico sobre la formación de callos en tres clones de Theobroma cacao L.
Lillien Fajardo Rosabal*, Juan J. Silva Pupo, Yosvel Viera Tamayo, Yoeldis Cobas Rodríguez. *Autora para correspondencia
Centro de Estudios de Biotecnología Vegetal. Facultad de Ciencias Agrícolas. Universidad de Granma. Carretera Bayamo-Manzanillo, km 17 1/2. Apdo 21 Bayamo. Granma. Cuba. CP 85 100. e-mail: lfajardor@ udg.co.cu
RESUMEN
El cacao es un cultivo de gran importancia económica que resulta de interés como fuente de compuestos de origen natural. El cultivo de tejidos con empleo de elicitación metabólica es una alternativa para la producción a gran escala de estos metabolitos secundarios. El presente trabajo tuvo como objetivo determinar el efecto del ácido salicílico como elicitor para la producción de biomasa celular de Theobroma cacao L. en tres clones. Para la formación de callos se utilizaron estaminoides de los clones ‘UF-613’, ‘UF-650’ y ‘Pound-7’. Se adicionaron 0.02; 0.05; 0.10 y 0.15 mg l-1 de ácido salicílico al medio de cultivo. A los 15 y 28 días de cultivo se cuantificó el número de explantes que formaron callos y se calculó el porcentaje de formación de callos. En el clon de mejores resultados se identificaron los metabolitos secundarios presentes en callos y medio de cultivo mediante tamizaje fitoquímico. La adición de ácido salicílico aceleró la formación de callos en los clones de cacao ‘UF-613’, ‘UF-650’ y ‘Pound-7’. Los resultados dependieron del clon y de las concentraciones utilizadas. La identificación de metabolitos secundarios en callos del clon ‘UF-650’ y en el medio de cultivo es punto de partida para futuras investigaciones.
Palabras clave: cultivo in vitro, metabolitos secundarios, tamizaje fitoquímico.
Effect of salicylic acid on callus formation in three Theobroma cacao L. clones
ABSTRACT
Cocoa is a crop of great economic importance and it has interest as a source of naturally occurring compounds. The tissue culture using metabolic elicitation is an alternative for large scale production of secondary metabolites. This study aimed to determine the effect of salicylic acid as elicitor for the production of cell biomass of Theobroma cacao L. in three clones. For callus formation staminodes of ‘UF-613’, ‘UF-650’ and ‘Pound-7’ clones were used. It were added 0.02, 0.05, 0.10 and 0.15 mg l-1 salicylic acid to the culture medium. At 15 and 28 days of culture the number of explants formed callus were quantified and the percentage of callus formation was calculated. In the best results clone the secondary metabolites in callus and culture medium were identified by phytochemical screening. The addition of salicylic acid accelerated callus formation in the cocoa clones ‘UF-613’, ‘UF-650’ and ‘Pound-7’. The results depended of the clone and the concentrations used. The identification of secondary metabolites in callus of ‘UF-650’ clone and in the culture medium is the starting point for future research.
Key words: tissue culture, phytochemical screening, secondary metabolites.
INTRODUCCIÓN
El cacao (Theobroma cacao L.) es un cultivo de gran importancia económica, del cual se obtienen múltiples productos empleados en la confitería, la industria de los cosméticos, la alimentación animal y en la industria farmacéutica.
Entre los metabolitos secundarios identificados en plantas de cacao se encuentran los polifenoles. Dentro de estos, los del grupo de los flavonoides, como las catequinas (37%), antocianinas (4%) y procianidinas (58%) han despertado interés por sus posibles aplicaciones para el cuidado de la salud humana (Wollgast, 2000). Usualmente estos compuestos cumplen un rol ecológico en la interacción de la planta con su ambiente y se encuentran en muy bajas concentraciones, por lo cual se hace necesario utilizar elevados volúmenes de material vegetal para obtener cantidades significativas de un compuesto de interés (Foley y Moore, 2005).
Frente a las dificultades existentes para sintetizar principios activos, tanto de uso farmacéutico como fitosanitario, el cultivo de tejidos se convierte en una alternativa para su producción. Además, el uso de elicitores metabólicos durante este proceso puede incrementar la producción de los metabolitos de interés (Zabala et al., 2009).
Las investigaciones en el campo de la fitoquímica de los clones productivos de cacao propagados mediante métodos biotecnológicos son escasas (Jalal y Collin, 1979; Alemanno et al., 2003; Rojas et al., 2008, Rojas et al., 2012). Generalmente, no han estado encaminadas a la obtención de principios activos con actividad biológica y se hace cada vez más necesaria la búsqueda de alternativas de producción de metabolitos secundarios a partir de cultivos celulares, debido a que la síntesis de estos compuestos resulta muy difícil, o en ocasiones, no viable económicamente. En Cuba no se encontraron referencias de estudios al respecto.
La elicitación de rutas metabólicas con sustancias químicas es una vía para incrementar la producción de metabolitos secundarios. Entre estos se encuentra el ácido salicílico que ha sido utilizado en diferentes especies de plantas. Por ejemplo, se ha comprobado su acción en la producción de isoflavonoides (AS 20µM) en suspensiones celulares de Pueraria tuberosa (Shaily y Ramawat, 2008), ácidos fenólicos (6.25 mg l-1 SA) en Salvia miltiorrhiza (Dong et al., 2010), flavonoides totales (0.05 mM AS) en Andrographis aniculata (Mendhulkar y Moinuddin, 2013) y alfa tocoferol en cultivo de suspensiones celulares de Elaeagnus angustifolia L. (1.0 mM AS) (Badrhadad et al., 2013).
Teniendo en cuenta lo anterior, este trabajo tuvo como objetivo determinar el efecto del ácido salicílico como elicitor para la producción de biomasa celular de Theobroma cacao L. en tres clones.
MATERIALES Y MÉTODOS
Material vegetal
Las plantas de Theobroma cacao L. seleccionadas como donadoras pertenecen al banco de germoplasma de la Estación Experimental del III Frente Oriental, Santiago de Cuba, Cuba. Como material vegetal inicial se utilizaron estaminoides (explantes) tomados de botones florales, antes de la antesis, de los clones ‘UF-613’, ‘UF-650’ y ‘Pound-7’.
Desinfección
Para la desinfección del material vegetal, se siguió la metodología descrita por Silva et al. (2002). Los botones florales se sumergieron en solución de detergente al 1.0% durante 30 min en agitación (zaranda), seguido de tres enjuagues con agua destilada estéril. Luego, en área aséptica los explantes se sumergieron en solución de hipoclorito de sodio (NaClO) al 2.0% durante 20 minutos, seguido de cuatro enjuagues con agua destilada estéril.
Efecto del ácido salicílico
Para determinar el efecto del ácido salicílico en la formación de callos se empleó el medio de cultivo propuesto por Silva et al. (2002) que contiene Sales MS (Murashige y Skoog, 1962) (4.32 g l-1), vitaminas LB (López-Báez, 1993)(10 ml l-1), mio-inositol (100 mg l-1), agua de coco (50 ml l-1), glicina (3.0 mg l-1), sacarosa (40 g l-1), kinetina (0.25 mg l-1), ácido 2,4-Diclorofenoxiacético (2,4-D) (2.0 mg l-1) y agar E (6.0 g l-1). El medio de cultivo fue distribuido, en frascos de 25 ml de capacidad, a razón de 10 ml por frasco.
Los tratamientos consistieron en la adición al medio de cultivo de ácido salicílico (0.02, 0.05, 0.10 y 0.15 mg l-1) y un tratamiento control sin este compuesto. Se colocaron cinco estaminoides por frasco de cultivo, cada frasco representó una réplica, y se realizaron 35 réplicas por tratamiento con dos repeticiones en el tiempo.
Transcurridos 15 y 28 días de cultivo se describió la coloración y consistencia de los callos. Se cuantificó el número de explantes que formaron callos y se calculó el porcentaje de formación de callos.
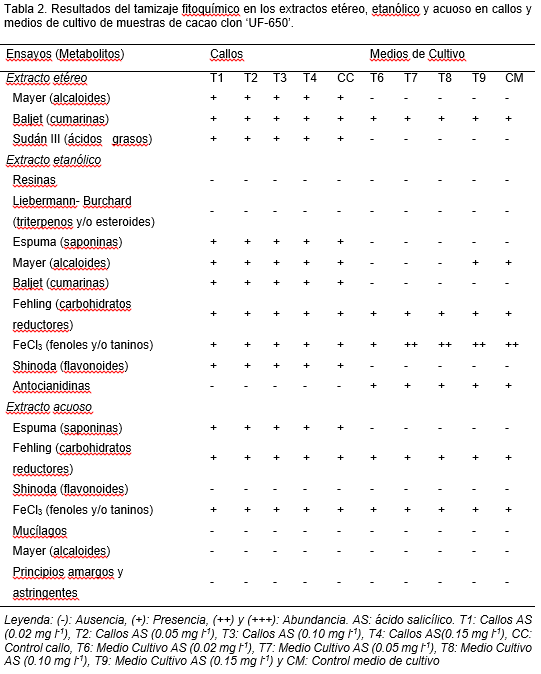
Posteriormente, se seleccionó el clon que mostrara mayor respuesta a la formación de callos en el menor tiempo evaluado y se identificaron los metabolitos presentes en callos y medio de cultivo. Para ello, se realizó un tamizaje fitoquímico por agotamiento de la muestra mediante extracción sucesiva con solventes de polaridad creciente: éter etílico, etanol y agua (Sandoval y Suárez, 1990; Evans, 1991; Payo, 2001). Se identificaron en cada extracto, los metabolitos secundarios que de acuerdo con su solubilidad, podían ser extraídos en estos solventes.
Para la formación de los extractos, se tomaron callos y por separado, el medio de cultivo donde se encontraban, por cada tratamiento. La extracción se realizó por maceración, realizando las filtraciones transcurridas 48 horas, para los extractos etéreos, etanólicos y acuosos, respectivamente.
Se pesó 1.0 g de callo, procedente de cada tratamiento y por separado 1.0 g del medio de cultivo correspondiente, se adicionaron 3.0 ml de éter etílico, transcurridas 48 h, se procedió a la filtración del extracto. En el caso de los callos la filtración se realizó por gravedad y para los medios de cultivo, debido a su estado físico, se filtró a presión reducida o vacío. Para obtener el extracto alcohólico, al remanente, se le adicionaron 15 ml de etanol al 82% (v/v) y se procedió de igual forma. Posteriormente, se adicionaron 15 ml de agua destilada, y se efectuó la extracción a 4-8ºC durante 48 h. Los ensayos para el análisis fitoquímico correspondiente a cada filtrado (Tabla 1) se hicieron por triplicado.
Análisis estadísticos
Los análisis estadísticos se realizaron en el programa estadístico computacional Statistica versión 6.0; con plataforma para sistema operativo Windows®. A la variable expresada en forma porcentual, se le realizó pruebas de comparación de proporciones para un nivel de significación del 5.0%.
RESULTADOS Y DISCUSIÓN
En los tres clones de cacao evaluados, se observó la formación de un callo por explante, el cual comenzó a desarrollarse a partir de su base. Los callos (Figura 1), fueron generalmente de color amarillo, friables, en ningún caso se observó hiperhidricidad. Estos resultados fueron similares a los referidos por López –Báez (1993), quienes para este cultivo, describen, a partir de la base del explante, la formación de callos nodulares y de color amarillo- crema, lo que plantean como característico de los callos con estructuras embriogénicas.
p0103415
En la formación de callos en el clon ‘Pound-7’, a los 15 días de cultivo se observaron diferencias significativas con el control a partir de 0.10 mg l-1 de ácido salicílico adicionado en el medio de cultivo y se obtuvo la máxima respuesta biológica (100%) con 0.15 mg l-1. Esto demuestra que a la mayor concentración evaluada se aceleró la formación de callos; pues se ha referido que la callogénesis sin elicitación culmina a los 28 días en este cultivo (López –Báez, 1993) (Figura 2).

En el clon ‘UF-613’ (Figura 3), a los 15 días de cultivo se logró una mayor formación de callo por explante, a partir de 0.05 mg l-1 de ácido salicílico en el medio de cultivo sin diferencias significativas entre los tratamientos que contenían el elicitor. A los 28 días se igualó la respuesta biológica (100% de formación de callos) para estos tratamientos con diferencias significativas con los dos tratamientos restantes.

En el clon ‘UF-650’, la formación de callos difirió de lo obtenido en los dos clones anteriores (Figura 4). La mejor respuesta al elicitor se mostró al utilizar la menores concentraciones evaluadas (0.02 y 0.05 mg l-1). A mayor concentración disminuyó significativamente la formación de callos, lo que demuestra que a partir de estas concentraciones puede existir un efecto inhibitorio de la callogénesis.
Para este clon se observó un 100% de formación de callos a los 15 días de cultivo con la adición de 0.02 mg l-1; concentración que mostró ser suficiente para inducir la formación de callos y obtener un valor máximo en la respuesta biológica. A los 28 días se igualó al resultado obtenido con 0.05 mg l-1 de ácido salicílico y al control.

Estos resultados fueron superiores a los alcanzados por Silva et al. (2002) quienes lograron la mejor respuesta en el clon ‘UF-650’ (51.1%, de formación de callos a partir de estaminoides), con 22.7μM de tidiazurón (TDZ) y un 82.1% de formación de callos con la combinación de 2,4-D (13.56μM) y kinetina (1.17μM).
Resultados similares fueron obtenidos por Lingakumar et al. (2014) al evaluar el efecto de este precursor metabólico sobre la callogénesis en Vigna mungo (L.) Hepper donde el ácido salicílico a una concentración muy baja (0.001 mg l-1) indujo un 70% de inducción de callo y su acción se potenció combinada con ácido naftalenacético (ANA) y bencilaminopurina (BAP).
La respuesta en la formación de callos se favoreció con la adición del ácido salicílico en dependencia de la concentración utilizada del elicitor. Estos resultados fueron similares a los obtenidos por Gadzovska et al. (2012) al evaluar la influencia del ácido salicílico en el cultivo in vitro de brotes, callos y células en suspensión de la especie medicinal Hypericum perforatum L. Estos autores plantearon que el elicitor no tuvo efecto negativo sobre el crecimiento y desarrollo de los explantes y aumentó la concentración de la hipericina (principio activo obtenido de esta especie).
Los resultados mostraron que la mejor respuesta en cuanto a formación de callos se obtuvo en el clon ‘UF-650’, con la menor concentración de ácido salicílico evaluada (0.02 mg l-1) y 100% de formación de callos, a los 15 días de cultivo, lo que evidenció una aceleración en el proceso de inducción de la callogénesis. En diferentes especies vegetales se ha demostrado que la producción de metabolitos secundarios puede ser reforzada por el tratamiento de células indiferenciadas con elicitores metabólicos. Debido a que las interacciones elicitor-receptor, se generan señales que activan genes responsables de reacciones de defensa, proceso en que la concentración del elicitor juega un papel importante (Vasconsuelo, 2007). En este sentido, el clon ‘UF-650’ es promisorio para la obtención de mayor biomasa celular en menor tiempo y pudiera ser utilizado para la producción de metabolitos secundarios con estas condiciones de cultivo. Por lo anterior, se utilizó para identificar los metabolitos presentes.
El análisis fitoquímico de los callos y el medio de cultivo en este clon permitió identificar varios metabolitos secundarios (Tabla 2). El solvente en el cual se extrajo la mayor diversidad fue el etanol.

En los callos se identificó presencia de alcaloides, cumarinas, ácidos grasos saponinas, carbohidratos reductores, fenoles y/o taninos y flavonoides. Estos metabolitos han sido referidos por Quiñones et al. (2013) quienes cuantificaron fenoles totales en extractos de callos provenientes de explantes florales de cacao (estaminoides, pétalos y nucelas).
Los resultados de esta investigación mostraron que al medio de cultivo difunden fenoles y/o taninos y en menor abundancia cumarinas, alcaloides, antocianidinas y carbohidratos reductores. En cuanto a los metabolitos de mayor interés farmacológico; los fenoles y/o taninos, fueron abundantes en el extracto etanólico, pero también se obtuvieron en extracto acuoso en callos y medios de cultivo. Las cumarinas fueron mayormente extraídas en extracto etéreo y las antocianidinas difunden totalmente al medio de cultivo en extracto etanólico.
Estos resultados son promisorios, ya que dependiendo de las concentraciones que se logren obtener de estos metabolitos, los extractos derivados del cultivo in vitro, luego de estandarizados y comprobada su actividad, pudiesen ser utilizados desde el punto de vista farmacológico. En este aspecto, diferentes investigaciones biomédicas muestran que los compuestos fenólicos, contribuyen a la prevención de enfermedades cardiovasculares, cáncer, osteoporosis, diabetes y enfermedades neurodegenerativas (Fremont, 2000; Roupe et al., 2006).
De igual forma, los flavonoides han sido ampliamente estudiados por su actividad antioxidante, además exhiben efectos beneficiosos en la permeabilidad capilar, antiplaquetaria, antiviral, anti-inflamatoria, antineoplásica (Scalbert y Williamson, 2000; Pietta, 2000), entre otras. Dentro del grupo de los flavonoides, los flavonoles se inhiben la peroxidación lipídica y afectan a la producción de moléculas de lípidos o derivados de lípidos que regulan la respuesta inmune (Franco et al., 2013), y se ha demostrado en bioensayos su acción sobre la reducción de la obesidad (Gu et al., 2013). Igualmente, algunos de los representantes de la familia de los alcaloides tienen actividad antibacteriana frente a bacterias Gram-negativas y las saponinas tienen actividad antiestafilocócica (Gurinder y Daljit 2009).
Con el método de tamizaje fitoquímico, no fue posible observar un efecto elicitor del ácido salicílico a las concentraciones evaluadas. Esto pudo estar dado a que para observarse un cambio cualitativo, en este caso de cambio de coloración, debe existir un salto cuantitativo muy significativo, debido a la baja sensibilidad de los ensayos. Sin embargo, los resultados pueden ser punto de partida para posteriores investigaciones que promuevan la producción de algunos metabolitos de interés en el medio de cultivo, de donde se pueden extraer sin afectar la producción de biomasa. Atendiendo a este resultado deben realizarse análisis químicos cuantitativos y promover la producción de biomasa en medios de cultivo líquidos para su escalado.
Son conocidas las implicaciones fisiológicas del ácido salicílico en la planta, como en la germinación de las semillas (Rate et al., 1999), la respiración (Norman et al., 2004), la reducción de la síntesis de etileno (Martínez et al., 2004). Pero una de funciones más estudiadas es su participación como molécula señal en defensas locales y regulación de la respuesta sistémica adquirida (Shah, 2003). Se ha comprobado su acción en la expresión de proteínas PR (Rangel et al., 2010) y en la regulación de genes relacionados con la biosíntesis de metabolitos secundarios como respuesta a la inducción de la resistencia (Mendhulkar y Moinuddin, 2013). Por todo ello, el ácido salícilico, se ha utilizado como elicitor metabólico en el cultivo in vitro de plantas. Sin embargo, no se encontró en la literatura científica evidencias del uso de este compuesto en el cultivo in vitro de cacao. En este trabajo se comprobó que el ácido salicílico adicionado al medio de cultivo puede acelerar el proceso de formación de callos que puede ser fuente de biosíntesis de metabolitos secundarios.
CONCLUSIONES
El ácido salicílico adicionado al medio de cultivo acelera el proceso de formación de callos en los clones de cacao ‘UF-613’, ‘UF-650’ y ‘Pound-7’. Los resultados dependen del clon y de las concentraciones utilizadas. La identificación de metabolitos secundarios en callos del clon ‘UF-650’ y en el medio de cultivo es punto de partida para futuras investigaciones.
REFERENCIAS
Alemanno L, Ramos T, Gargadenec A, Andary C, Ferriere N (2003) Localization and identification of phenolic compounds in Theobroma cacao L. somatic embryogenesis. Ann Bot 92:613–623
Badrhadad A, Piri K, Ghiasvand T (2013) Increasing of alpha tocopherol in cell suspension cultures Elaeagnus angustifolia L. International Journal of Agriculture and Crop Sciences 5: 1328-1331
Dong J, Wan G, Liang Z (2010) Accumulation of salicylic acid-induced phenolic compounds and raised activities of secondary metabolic and antioxidative enzymes in Salvia miltiorrhiza cell culture. Journal of Biotechnology 148: 99-104
Evans WC (1991) Farmacognosia. 13ra Ed, Interamericana. México
Foley W, Moore B (2005) Plant secondary metabolites and vertebrate herbivores from physiological regulation to ecosystem function. Current Opinion in Plant Biology 8(4): 430-435
Franco R Oñatibia A, Martínez E (2013) Health Benefits of Methylxanthines in Cacao and Chocolate. Nutrients 5: 4159-4173
Fremont L (2000) Biological effects of resveratrol. Life Sciences 66: 663 –673
Gadzovska S, Maury S, Delaunay A, Spasenoski M, Hagège D, Courtois D, Joseph C (2012) The influence of salicylic acid elicitation of shoots, callus, and cell suspension cultures on production of naphtodianthrones and phenylpropanoids in Hypericum perforatum L. Plant Cell Tiss Org 113: 25 – 39
Gu Y, Yu S, Lambert JD (2013) Dietary cocoa ameliorates obesity related inflammation in high fat fed mice. European Journal of Nutrition 53:149-58
Gurinder JK, Daljit SA (2009) Antibacterial and phytochemical screening of Anethum graveolens, Foeniculum vulgare and Trachysper mumammi. BMC Complementary and Alternative Medicine 9: 30.
Jalal M, Collin H (1979) Secondary metabolism tissue culture of Theobroma cacao. New Phytologist 83(2):343–349
Lingakumar K, Asha A, Vairamathi SP (2014) Comparative effects of auxins, jasmonic acid and salicylic acid on callus initiation and organogenesis in Vigna mungo (L.) Hepper using hypocotyl explant. Journal of Stress Physiology & Biochemistry 10 (1): 262- 267
López-Báez O, Bollon H, Esque S (1993) Embryogénese somatique de cacaoyer Theobroma cacao L. à partir de pièces florales. Compte-Rendus de l’Acadèmie des Sciences París 316: 579-584
Martínez C, Pons E, Prats G, Leon J (2004) Salicylic acid regulates flowering time and links defense responses and reproductive development. Plant Journal 37: 209-17
Mendhulkar V, Moinuddin M (2013) Elicitation of flavonoids by salicylic acid and Penicillium expansumin, Andrographis aniculata (Burm.f.) Nees. cell culture. Research in Biotechnology 4: 01-09
Murashige T, Skoog F (1962) A Revised Medium for Rapid Growth and Bioassays with Tobacco Tissue Cultures. Physiol. Plant. 15: 473-497
Norman C, Howell KA,Millar AH,Whelan JM,Day DA (2004) Salicylic acid is and inhibitor of mitocondrial electron transport. Plant Physiology 134: 492-501
Payo A (2001) Tamizaje Fitoquímico del Croteun L. Revista Cubana de Farmacia 35 (3):78-84
Pietta PG (2000) Flavonoids as antioxidants. Journal of Natural Products 63: 1035 –1042
Quiñones J, Trujillo R, Capdesuñer Y, Quirós Y, Hernández M (2013) Potencial de actividad antioxidante de extractos fenólicos de Theobroma cacao L. (cacao). Revista Cubana de Plantas Medicinales. 18 (2):201-215
Rangel G, Castro E, Beltran E, Reyes de la Cruz, Ernesto GP (2010) El ácido salicílico y su participación en la resistencia a patógenos en plantas. Biológicas 12: 90 – 95
Rate DN, Cuenca JV, Bowman GR,Guttman DS,Greenberg JT (1999) The gain of function Arabidopsis acd 6 mutant reveals novel regulation and fuction of salicylic acid signaling pathway in controlling cell death, defenses and cell growth. Plant Cell 11: 1695-1708
Rojas L, Florez C, Atehortúa L, Gil A, Londoño J (2012) Application of a new method to obtain cell biomass of Theobroma cacao seeds for metabolites production in flasks and bioreactor cultures. Acta Horticult 961:435–440
Rojas LF, Londoño J, Gallego A, Herrera AL, Aguilera C, Atehortúa L (2008) Total polyphenols analysis of mature seeds and tissue cultures of some Colombian cocoa varieties. Actual Biol 30:117–123
Roupe KA, Remsberg CM, Yáñez JA, Davies NM (2006) Pharmacometrics of stilbenes: Segueing towards the clinic . Current Clinical Pharmacology 1: 81 –101
Samman S, Wall PM, Cook NC (1999) Flavonoids and coronary heart disease: dietary perspectives. En: Manthey J, Buslig B (Eds) Flavonoids in the Living System, pp. 469 –481. Plenum Press, New York.
Sandoval D, Suárez O (1990) Estudio Fitoquímico preliminar de detección de alcaloides y saponinas en plantas que crecen en Cuba. Revista Cubana de Farmacia 24 (2): 288-296
Scalbert A, Williamson G (2000) Dietary intake and bioavailability of polyphenols. Journal of Nutrition 130: 2073 –2085
Shah J (2003) The salicylic acid loop in plant defense. Current Opinion in Plant Biology 6: 365–371.
Shaily G, Ramawat KG (2008) Increased isoflavonoids accumulation in cell suspensions cultures of Pueraria tuberosa by elicitors. Indian Journal of Biotechnology 7: 378-382
Silva JJ, Acosta L, Montes Silvia, Oliva E (2002) Callus and somatic embryo formation in different clones of cocoa.INGENIC Newsletter Cocoa 7: 12-15
Vasconsuelo AB (2007) Molecular aspects of the early stages of elicitation of secondary metabolites in plants. Plant Science 5: 861-875
Wollgast JA (2000) Review on Polyphenols in Theobroma cacao: Changes in composition during the manufacture of chocolate and methodology for identification and quantification. Food Research International 33: 423-47
Zabala M, Angarita M J, Aguirre A M, Restrepo J M, Montoya C (2009) Estrategias para incrementar la producción de metabolitos secundarios en cultivos de células vegetales. Rev.Fac.Nal.Agr.Medellín 62 (1): 4881-4895
Recibido: 09-10-2015
Aceptado: 20-10-2015
Copyright (c) 2016 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
