Artículo original
Biotecnología Vegetal Vol. 16, No. 1: 21 - 29, enero - marzo, 2016
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Caracterización de la respuesta de cultivares de caña de azúcar a la roya naranja en casa de cultivo
Characterization of sugarcane cultivars response to orange rust in greenhouse
Borys Luis Valdés1,2, Osmany Aday1, Bárbara Ocaña2, Luís Rojas2, Marilin Hernández2, Mayra Acosta-Suárez2, Víctor Gil3, Annia González4, Leonardo Rivero2, María Ileana Oloriz2
1Instituto de Investigaciones de la Caña de Azúcar. Carretera al CAI Martínez Prieto km 1½. Boyeros. La Habana. Cuba. CP 19390.
2 Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.e-mail: maria@ibp.co.cu
3 Centro de Investigaciones Agropecuarias, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.
4 Centro de Información y Gestión Tecnológica. Buen viaje 18 e/ Maceo y Parque. Santa Clara. Villa Clara. Cuba. CP 50100.
RESUMEN
La roya naranja de la caña de azúcar (Saccharum spp.), causada por Puccinia kuehnii (Krüguer) Butler, es considerada una de las enfermedades más importantes debido a las pérdidas en el rendimiento agrícola en plantaciones comerciales susceptibles. Este trabajo tuvo como objetivo caracterizar la respuesta de cultivares de caña de azúcar a esta enfermedad en condiciones de casa de cultivo. Se inocularon plantas de dos meses de cultivo con una suspensión de esporas obtenidas a partir de pústulas en hojas del cultivar ‘C01-227’ colectadas en la región central de Cuba. Previo a la preparación del inóculo, fue confirmado al microscopio óptico y por reacción en cadena de la polimerasa la presencia de P. kuehnii. Las condiciones empleadas para el experimento permitieron identificar respuestas diferenciales de los cultivares a la infección por P. kuehnii. Algunos cultivares mostraron resistencia al hongo a través de interacciones no compatibles con una típica respuesta hipersensible. En otros casos se observaron diferentes grados de susceptibilidad en los que varió el período de latencia de la enfermedad.
Palabras clave: Puccinia kuehnii, resistencia, Saccharum spp.
ABSTRACT
Sugarcane orange rust, caused by Puccinia kuehnii (Krüguer) Butler, is considered one of the most important diseases, due to losses in agricultural yields in susceptible commercial plantations. The objective of this work was to characterize the response of sugarcane cultivars to orange rust in green house conditions. Sugarcane plants of two months old were inoculated with spore suspension obtained from pustules on sugarcane leaves (‘C01-227’) with orange rust symptoms. Previously to inoculum preparation, P. kuehnii occurrence were confirmed by optical microscopy and polymerase chain reaction techniques. The experimental conditions used allow identify differential response between sugarcane cultivars to P. kuehnii infection. Some cultivars showed to be resistant to the fungus through interactions incompatible with a typical hypersensitive response. In other cultivars, different grades of susceptibility with significant differences in latency period of the disease was observed.
Key words: Puccinia kuehnii, resistance, Saccharum spp.
INTRODUCCIÓN
La caña de azúcar (Saccharum spp.) es uno de los cultivos más productivos en todo el mundo debido a su mayor eficiencia en la actividad fotosintética y su capacidad para almacenar sacarosa en el tallo. Su cultivo cubre un área de más de 25.4 millones de hectáreas en más de 130 países y territorios, con una producción de más de 1 800 millones de toneladas anuales (Gómez–Merino et al., 2014).
Este cultivo semiperenne cuenta con una amplia gama de cultivares en explotación, lo cual unido a la extensa área que ocupa, hace que esta poácea se encuentre expuesta de manera continua a la acción de factores ambientales y agentes biológicos que afectan negativamente su producción y rendimientos (Cortegaza, 2013).
El número de patógenos detectados en la caña de azúcar se ha incrementado considerablemente en los últimos años, además de extenderse de manera notable a los que existían con anterioridad (Perera, 2011).
Una de las enfermedades que ha presentado mayores niveles de propagación en las últimas décadas es la roya naranja de la caña de azúcar causada por Puccinia kuehnii (Krüguer) Butler. Posee una amplia distribución, y se ha informado su presencia en más de 35 países ubicados en varios continentes. Su propagación desde que fue informada por primera vez en Norteamérica hasta Sudamérica, fue rápida (dos años y medio) en comparación con la distribución de la roya parda (Funes et al., 2010).
En Cuba, Aday et al. (2010) y Pérez et al. (2012), confirmaron en condiciones naturales la infección por P. kuehnii en varios cultivares comerciales y progenitores de interés en áreas experimentales y de producción. Sin embargo, no se conoce cuál es la respuesta fenotípica de los cultivares comerciales de importancia en el país a esta enfermedad.
Aunque la roya naranja no constituye por el momento una enfermedad principal en Cuba, es necesario desarrollar estudios que brinden mayor conocimiento sobre la resistencia y permitan mejorar las estrategias de prevención y control. El objetivo de este trabajo fue caracterizar la respuesta de cultivares de caña de azúcar a P. kuehnii de ocho cultivares de importancia comercial en Cuba y otros cinco en estudio mediante inoculación artificial en condiciones de casa de cultivo.
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon plantas de los cultivares ‘Q124’ y ‘CP72-2082’ como controles susceptibles (Magarey et al., 2005; Ovalle et al., 2010), los cultivares comerciales ‘CP52-43’, ‘SP70-1284’, ‘C323-68’, ‘C1051-73’, ‘C86-12’, ‘C86-56’, ‘C90-469’, ‘C95-414’, el cultivar en estudio ‘C01-227’ . También se incluyeron el cultivar ‘B4263’ y los mutantes de este ‘IBP8518’, ‘IBP8830’, ‘IBP8719’ y ‘IBP8917’ resistentes a Puccinia melanocephala H. Sydow y P. Sydow según Oloriz et al. (2011).
El material vegetal para la plantación de los cultivares se obtuvo del banco de semilla original de la Estación Territorial de Investigaciones de la Caña de Azúcar Centro Villa Clara (ETICA Centro Villa Clara) perteneciente al Instituto de Investigaciones de la Caña de Azúcar (INICA). Los mutantes de ‘B4362’ se obtuvieron del Instituto de Biotecnología de las Plantas (IBP) de la Universidad Central Marta Abreu de las Villas.
Se prepararon 320 bolsas plásticas con una mezcla de compost y zeolita como sustrato en una proporción 80:20. De cada cultivar se plantaron 20 yemas (una por bolsa). El manejo agronómico de las plantas se realizó según las normas y procedimientos del programa de mejoramiento genético de la caña de azúcar en Cuba (Jorge et al., 2011) bajo condiciones de casa de cultivo en el IBP. A los 60 días posteriores a la plantación se seleccionaron 10 plantas por cultivar para su inoculación con P. kuehnii.
Diagnóstico de P. kuehnii
Las muestras se tomaron de hojas de plantas adultas del cultivar ‘C01-227’ con síntomas característicos de roya naranja colectadas en el Bloque experimental de la ETICA Centro Villa Clara. Previo a la preparación del inóculo, se realizó un diagnóstico por microscopía óptica a muestras procedentes de campo para confirmar la presencia de P. kuehnii. Para ello se analizaron las características de las uredosporas (color, tamaño y forma) con el empleo de un microscopio óptico (Olympus).
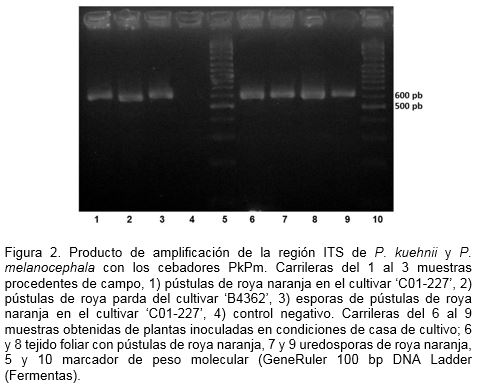
También se realizó el análisis molecular de P. kueehnii por Reacción en Cadena de la Polimerasa (RCP) con los cebadores PkPm-F (AAGAGTGCACTTAATTGTGGCTC) y PkPm-R (TCCCACCTGATTTGAGGTCT) (Glynn et al., 2010). Estos cebadores permiten amplificar la región intergénica (ITS) de las dos especies de roya de la caña de azúcar con productos esperados de tamaños diferente: 585 pb (pares de base) para P. melanocephala y 606 pb para P. kuehnii. El ADN se extrajo de tejido foliar con presencia de pústulas y de uredosporas acorde con el protocolo de extracción in situ propuesto por Xin et al. (2003).
El análisis molecular se repitió a las plantas infectadas en condiciones de casa de cultivo después de la última evaluación.
Inoculación de P. kuehnii
El inóculo se preparó a partir de uredosporas colectadas de pústulas en hojas del cultivar ‘C01-22’7. Se aplicaron 250 µl de una suspensión acuosa (4-5x105 uredosporas ml-1) con una micropipeta en la hoja enrollada. El riego de agua por microaspersión se aplicó a partir de las 2 horas posteriores a la inoculación y continuó con una frecuencia de dos veces al día y una duración de 10 min cada uno. Las condiciones de la casa de cultivo fueron luz solar y temperaturas media de 20-25°C. Se inocularon diez plantas por cultivar y el experimento se repitió tres veces.
Evaluaciones
Después de la inoculación, las plantas fueron observadas diariamente para determinar el periodo de incubación (días comprendidos entre la inoculación y la aparición de los primeros síntomas visibles observados en más del 50% de las plantas) y el periodo de latencia (días transcurridos entre la inoculación y la esporulación en al menos una pústula en el 50% o más de las plantas) (Martins, 2010; Pérez, 2013).
Para las evaluaciones de la respuesta de los cultivares a la inoculación artificial con el patógeno se tomó como referencia la escala de cinco grados descrita por Sood et al. (2013) que se presenta en la tabla 1. El grado asignado fue el de mayor frecuencia de aparición en la población y superior al 80% de los individuos inoculados. Las plantas se evaluaron a los 30 días posteriores a la inoculación.

A los 30 días de la inoculación, se realizó el conteo de pústulas. Para ello, se empleó una cámara digital (Cannon) con la cual se tomaron imágenes de las hojas +1 y +2 (Van Dillewijn, 1952), en el área de inoculación. Las imágenes fueron procesadas en el programa ImageJ 1.43u (Abramoff et al., 2004; Ferreira y Rasband, 2012), para cuantificar el número de pústulas por cm2, medir las dimensiones (largo y ancho) (mm) y calcular el área que ocupa la pústula.
El procesamiento estadístico de los datos se realizó mediante el programa STATGRAPHICS Plus 4.1. Al no cumplirse los supuestos de normalidad de los datos y homogeneidad de varianzas se emplearon las pruebas de Kruskall–Wallis y Mann-Whitney, para un grado de significación de p<0.05. Para agrupar los cultivares infectados por P. kuehnii de acuerdo con las dimensiones de las pústulas, se realizó un análisis de clasificación automática, donde se utilizó el método de la Mediana y la distancia Euclidiana, como criterio de agrupamiento se tuvo en cuenta no fusionar grupos demasiado lejanos.
RESULTADOS Y DISCUSIÓN
El diagnóstico de P. kuehnii tanto por microscopía óptica como por la reacción en cadena de la polimerasa confirmó la presencia del patógeno en las hojas del cultivar ‘C01-227’. Las uredosporas observadas al microscopio óptico presentaron las características típicas de P. kuehnii con un color naranja-amarilllo, abundantes espinas, dimensiones entre 29.21-40.87 µm de largo y 14.6-26.76 µm de ancho (Figura 1) lo cual coincidió con la descripción realizada por Tamayo et al. (2014) en la región oriental de Cuba y Dixon et al. (2010).

El empleo de los cebadores PkPm propuestos por Glynn et al. (2010), amplificó una banda de talla esperada de 606 pb correspondiente al fragmento ITS de P. kuehnii y que fue ligeramente superior en talla al fragmento amplificado a partir del ADN de P. melanocephala (Figura 2). La banda de 606 pb se obtuvo tanto para las muestras de roya naranja colectadas en el campo como para las pústulas obtenidas como resultado de la inoculación en las condiciones de este experimento.
Las condiciones empleadas para el experimento y el método de inoculación permitieron observar diferencias en la respuesta de los cultivares a la infección por P. kuehnii (Tabla 2). Para todos los cultivares estudiados, los primeros síntomas visibles (puntos cloróticos) fueron observados después de los 4 días posteriores a la inoculación (dpi), y osciló entre 4 y 8 dpi. En el cultivar ‘IBP8518’ se retardó la presentación de los primeros síntomas hasta el octavo día posterior a la inoculación, antecedido por ‘IBP88-30’, ‘C323-68’, ‘C1051-73’ y ‘CP52-43’, en los cuales fueron observados al sexto.
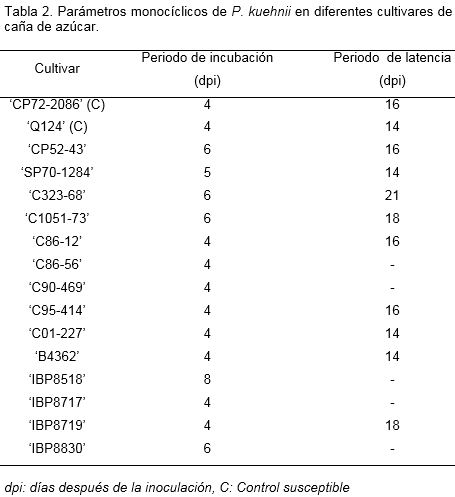
El período de latencia de la enfermedad, varió entre 14 a 21 dpi para aquellos cultivares que completaron el ciclo de infección de P. kuehnii. La duración de este período se extendió a 18 dpi en ‘IBP8719’ y ‘C1051-73’ y hasta 21 dpi en ‘C323-68’. Los cultivares ‘C90-469’, ‘C86-56’, ‘IBP87-17’, ‘IBP8830’ e ‘IBP8518’ se caracterizaron por presentar respuestas similares a la hipersensibilidad y no completaron el ciclo de la enfermedad en el periodo evaluado.
Estos resultados no concuerdan con los informados por Pérez (2013) quien evaluó los parámetros monocíclicos de dos cultivares de caña de azúcar en Brasil bajo dos regímenes de temperatura (22 y 25ºC). Este autor encontró que el periodo de incubación fue 9 dpi, mientras que el periodo de latencia para rangos similares de temperatura fue de 11 dpi. Sin embargo, Giacomini (2013) halló diferencias significativas entre cultivares brasileños en cuanto al período de incubación (15 a 17 dpi) y latencia (18-22 dpi), y atribuyó sus resultados a las bajas temperaturas referidas durante la investigación, que influyeron en la germinación de las esporas y desarrollo inicial del patógeno. Comparando los resultados previamente informados con los encontrados en este trabajo se consideró que los períodos de incubación y latencia para el desarrollo de la roya naranja deben estar influenciados además por otros factores ambientales como la intensidad de la luz y en gran medida las bases genéticas de cada cultivar en estudio.
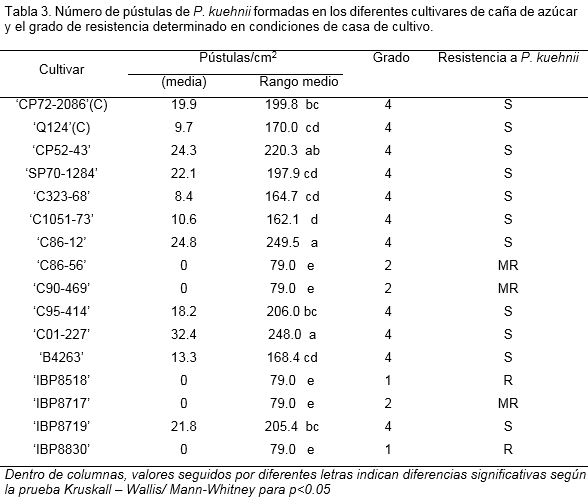
Los resultados del conteo de pústulas/cm2 unido a las características de las lesiones observadas en cada cultivar permitieron asignar el grado de resistencia a P. kuehnii (Tabla 3). Los cultivares con mayor producción de pústulas resultaron ‘C01-227’, ‘C86-12’ y ‘CP52-43’, con diferencias significativas con el cultivar control de susceptibilidad ‘Q124’.
Se observaron diferencias significativas entre los cultivares en relación con las dimensiones de las pústulas formadas en cada uno de ellos después de la inoculación bajo condiciones de casa de cultivo, ello indica una expresión diferencial en la interacción hospedante patógeno (Tabla 4).
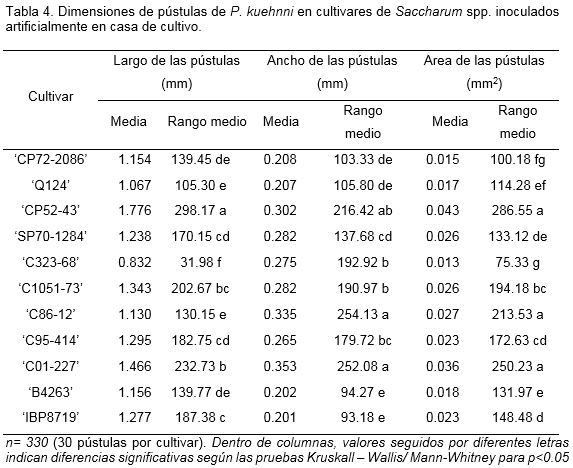
De particular interés fue el hecho de que las dimensiones de las pústulas de P. kuehnii (largo, ancho, área) de los cultivares controles de susceptibilidad ‘Q124’ y ‘CP72-2086’ fueron significativamente menores que en el cultivar comercial ‘CP52-43’ y que el cultivar en estudio ‘C01-227’. Según el análisis de conglomerado (Figura 3), los cultivares ‘C01-227’ y ‘CP52-43’ formaron un grupo de susceptibilidad superior a los controles. Estos últimos se agruparon junto a los cultivares comerciales ‘C1051-73’, ‘C95-414’, ‘SP70-1284’ y ‘C86-12’, en este grupo de menor susceptibilidad se encontraron, además, ‘B4362’ y el mutante ‘IBP87-19’.

El 69% de los cultivares estudiados resultaron susceptibles a la enfermedad con diferencias entre ellos en cuanto a las dimensiones, área de las pústulas, así como el número de estas. Una respuesta diferente caracterizó a los cultivares ‘C90-469’ y ‘C86-56’ con moderada resistencia, apreciándose el desarrollo de pequeñas lesiones sin esporulación. Los cultivares ‘IBP8518’ y ‘IBP8830’ fueron resistentes a P. kuehnii ya que el desarrollo de los síntomas fue limitado a pequeños puntos cloróticos que posteriormente formaron bandas o manchas cloróticas (similar a una respuesta hipersensible) sin formación de pústulas (Figura 4).

Aunque existen insuficientes estudios sobre la herencia de la resistencia a la roya naranja de la caña de azúcar, Klosowski et al. (2013) planteó que es determinada por un gen principal y varios genes que actúan cuantitativamente. Teniendo en cuenta este conocimiento, se pudiera explicar la respuesta hipersensible de estos cultivares, probablemente determinada por un gen de resistencia R, así como aquellos moderadamente resistentes puede ser el resultado de la contribución cuantitativa de otros genes que aportan a la resistencia a la roya naranja en caña de azúcar. No obstante, es necesario continuar los estudios que profundicen en aspectos de la genética de la resistencia en caña de azúcar a P. kuehnii.
CONCLUSIONES
El método de inoculación empleado y las condiciones del experimento permitieron la caracterización de los cultivares de caña de azúcar según su respuesta a la infección por P. kuehnii. Se encontraron variaciones en el período de incubación y el período de latencia, así como el grado de resistencia a la enfermedad entre los cultivares. El cultivar ‘C01-227’ presentó mayor número de pústulas por cm2, mayores dimensiones y área de las pústulas, con respecto a los controles susceptibles ‘Q124’ y ‘CP72-2086’, por lo que puede ser considerado un control para experimentos similares. Los cultivares ‘IBP8518’ y ‘IBP8830’ resistentes a P. kuehnii, y aquellos con moderada resistencia (‘C90-469’ y ‘C86-56’), pueden ser fuente de resistencia a la roya naranja de la caña de azúcar para el mejoramiento genético del cultivo.
AGRADECIMIENTOS
El colectivo de autores agradece a la Dra Novisel Veitía por la revisión de los análisis estadísticos realizados.
REFERENCIAS
Abramoff MD, Magalhaes PJ, Ram SJ (2004) Image Processing with Image. J Biophotonics International 11 (7): 36-42
Aday O, Barroso FJ, Díaz FR, Martín EL, Pérez L, Alfonso I, Pérez J (2010) Presencia de la roya naranja Puccinia kuehnii (Krüger) Butler en áreas experimentales de caña de azúcar (Sacharum spp. híbrido) de la región central de Cuba. Fitosanidad 14 (2): 83-89
Cortegaza AL (2013) Guía para la micropropagación in vitro de la caña de azúcar. Fundación Produce Sinaloa AC, Culiacán
Dixon L, Castlebury L, Aime MC, Glynn NC, Comstock JC (2010) Phylogenetic relationships of sugarcane rust fungi. Mycol Progress 9 (4): 459-468; doi: 10.1007/s11557-009-0649-6
Ferreira T, Rasband W (2012) ImageJ User Guide IJ146r. Publisher. Disponible en: http://imagej.nih.gov/ij/docs/guide. Consultado 25/5/2015
Funes C, Rago AM, Perera MF, Pérez SGG, Fernández de Ullivarri R, Cuenya MI (2010) Roya naranja de la caña de azúcar: situación actual en el continente americano. Avance Agroindustrial 32 (1): 13-17
Giacomini RCh (2013) Reação de variedades de cana-de-açúcar à ferrugem alaranjada (Puccinia Kuehnii). Tese apresentada para obtencão do titulo de Doutor em Ciências, Universidade de São Paulo, Escola Superior do Agricultura Luiz de Queiroz, Piracicaba, Brasil
Glynn NC, Dixon LJ, Castlebury LA, Szabo LJ, Comstock JC (2010) PCR assays for the sugarcane rust pathogens Puccinia kuehnii and P. melanocephala and detection of a SNP associated with geographical distribution in P. kuehnii. Plant Pathology 59(4): 703-711; doi: 10.1111/j.1365-3059.2010.02299.x
Gómez–Merino FC, Trejo-Tellez LI, Sentíes-Herrera (2014) Innovaciones biotecnológicas en la caña de azúcar para potenciar su uso como biofábrica. Revista ATAM 27: 33- 41
Jorge H, Jorge I, Mesa JM, Bernal N (2011) Normas y procedimientos del programa de mejoramiento genético de la caña de azúcar en Cuba. PUBLINICA, La Habana
Klosowski AC, Bespalhok Filho JC, Ruaro L, May De Mio LL (2013) Inheritance of Resistance to Orange Rust (Puccinia kuehnii) in Sugarcane families from crosses between parents with different orange rust reactions. Sugar Tech 15 (4): 379-383; doi: 10.1007/s12355-013-0233-x
Magarey R, Staier T, Bull J, Croft B, Willcox T (2005) The Australian sugarcane orange rust epiphytotic. Proceeding International Society Sugar Cane Technologists 25: 648–654
Martins TD (2010) Aspectos epidemiológicos da ferrugem alaranjada da cana-de-acucar. Tese apresentada para obtencao do título de Doutor em Ciencias, Universidad de São Paulo, Escola Superior do Agricultura Luiz de Queiroz, Piracicaba, Brasil
Oloriz MI, Gil V, Rojas l, Veitía N, Höfte M, Jiménez E (2011) Selection and characterization of sugarcane mutants with improved resistance to brown rust obtained by induced mutation. Crop Pasture Sci 62: 1037-1044; doi: 10.1071/CP11180
Ovalle W, Orozco H, Fong E, Garcia S (2010) The effect of orange rust (Puccinia kuehnii) on sugar yield in six sugarcane varieties in Guatemala. Proceeding International Society Sugar Cane Technologists 27: 1-9
Perera MF (2011) Biotecnología en caña de azúcar: identificación varietal, estimación de la diversidad genética, diagnóstico molecular de patógenos y caracterización de virus relacionados con la enfermedad del mosaico. Trabajo de Posgrado para la obtención del grado académico superior de Doctor A en Ciencias Biológicas, Universidad Nacional de Tucumán, Instituto Superior de Investigaciones Biológicas (INSIBIO, CONICET-UNT), Tucumán, Argentina
Pérez JR, Rufín Y, Pérez Y, Alfonso I (2012) Desarrollo alcanzado por la roya naranja Puccinia Kuehnii (Krüger) Butler de la caña de azúcar en Cuba evaluado a partir de la evolución de focos de la enfermedad. Cuba & Caña 1: 35-40
Pérez SG (2013) Quantificação de parãmetros monocíclicos da ferrugem alaranjada (Puccinia kuehnii) em cana de açúcar. Dissertação apresentada para obtenção do título de Mestre em Ciências, Universidade São Paulo, Escola Superior do Agricultura Luiz de Queiroz, Piracicaba, Brasil
Sood S, Comstock JC, Raid RN (2013) Evaluation of sugarcane clones in the CP-cultivar program for resistance to Puccinia kuehnii, the pathogen of orange rust. Proc Int Soc Sugar Cane Technol 28: 1-7
Tamayo M, Puchades Y, La O Echavarría M, Rodríguez R, Chacón V, Alfonso I (2014) Caracterización morfológica y morfométrica del organismo causal de la roya naranja de la caña de azúcar. Revista Cuba & Caña 1: 12-16
Van Dillewijn C (1952) Botany of Sugarcane. Chronica Botanica, New York
Xin Z, Jeff PV, Melvin JO, John JB (2003) High throughput DNA extraction method suitable for PCR. BioTechniques 34: 820-826; doi: 10.1.1.453.6278
Recibido: 09-11-2015
Aceptado: 22-12-2015
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
