Artículo original
Biotecnología Vegetal Vol. 16, No. 1: 37 - 43, enero - marzo, 2016
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Reducción del impacto ambiental negativo generado por los residuales en un laboratorio de cultivo de tejidos vegetales
Reduction of negative environmental impact generated by residues of plant tissue culture laboratory
Yusleidys Cortés Martínez, Jesús D Luis Orozco, Juana Zoila Junco Horta
Universidad de Matanzas Camilo Cienfuegos. Vía Blanca km 3. Matanzas. Matanzas. Cuba. CP 40100. e-mail: yusleidys.cortes@umcc.cu
RESUMEN
La investigación se basó en la actividad que desarrollan laboratorios docentes e investigativos con fines biotecnológicos con un enfoque ambiental para determinar los potenciales de riesgo de contaminación y analizar los residuales que se generan. Se realizó la caracterización físico – química de los residuales a partir de indicadores de contaminación que pueden incidir en el vertimiento del agua residual. Para identificar los riesgos ambientales y las fuentes de contaminación microbiana del material vegetal propagado por cultivo in vitro que generan residuales se puntualizaron todas las actividades de riesgo, se analizó el tipo de riesgo que implicaba cada actividad, así como si se cumplían o no las normas de asepsia. Se propuso la operación de dilución y neutralización para residuales con valores extremos de pH. A partir de los resultados del trabajo se propuso un conjunto de medidas para reducir el impacto ambiental negativo de los residuales del laboratorio.
Palabras clave: bioseguridad, contaminación microbiana, gestión ambiental
ABSTRACT
The research is based on the activity developed by teaching and research laboratories for biotechnology purposes with an environmental approach to determine potential contamination risk and analyze the residuals generated. The physical - chemical characterization of the residuals was carried out from contamination indicators that can affect the dumping of residual water. In order to identify the environmental risks and sources of microbial contamination of plant material propagated by in vitro culture that generate residuals, all the risk activities were identified, the type of risk involved in each activity was analyzed, as well as whether or not the standards were met of aseptic normative. The dilution and neutralization was proposed for residuals with extreme values of pH. Since the results of the work a set of measures was proposed to reduce the negative environmental impact of the laboratory residuals.
Key words: biosafety, environmental management, microbial contamination
INTRODUCCIÓN
En los países en vías de desarrollo la atención de la problemática vinculada a los residuos peligrosos ha sido más lenta que en países desarrollados. Desde el punto de vista ambiental han persistido carencias de infraestructuras adecuadas para gestionarlos (Álvarez, 2005; Martínez et al., 2005). Ello ha potenciado el vertido incontrolado de residuos, así como la operación de plantas de reciclaje y tratamiento en condiciones inadecuadas. Esta situación ha ocasionado impactos ambientales y a la salud a largo plazo, con costos asociados extremadamente altos. Los sitios contaminados provocados por una disposición inadecuada de residuos son un ejemplo claro de esta situación. Existen numerosos ejemplos de repercusiones a la salud de la población por esta causa en diferentes partes del mundo (Díaz, 2013).
Las estrategias ambientales ya en los años 90, del siglo XX, aumentaron el enfoque hacia las cuestiones preventivas. El ámbito de la innovación se orientó al desarrollo de tecnologías que fueran capaces de generar impactos ambientales negativos cada vez menores y obtener una producción más limpia basada en el ahorro de materias primas, agua y energía. Dentro de los residuos, uno de los tipos que más atención requiere, son los peligrosos (Benavides, 1993). Los laboratorios de docencia y de investigación, hospitales, clínicas, centros sanitarios y empresas inciden en este tipo degeneración de residuos. En la minimización, debe plantearse la posibilidad de tratamiento in situ como una forma de reducción de la peligrosidad y de minimizar la contaminación del medio ambiente. Además, se debe valorar la posibilidad de reutilización de los residuos siempre que se pueda (Álvarez, 2005; Martínez et al., 2005).
Para conseguir un correcto tratamiento de los residuales (Echeverria et al., 1993) es necesario garantizar, en primer lugar, la seguridad de todos los implicados en la cadena (productores, manipuladores, transportistas, gestores y ejecutores de los tratamientos) y, en segundo lugar, el cumplimiento de los parámetros establecidos para su disposición final (Martínez et al., 2005).
El laboratorio de Cultivo de tejidos vegetales de la Universidad de Matanzas Sede “Camilo Cienfuegos” desarrolla actividades docentes e investigativas que generan residuos que se depositan al medio ambiente sin previo tratamiento. El objetivo del presente trabajo fue caracterizar los residuales y proponer medidas para reducir el impacto ambiental negativo de los residuos en dicho laboratorio.
MATERIALES Y MÉTODOS
Esta investigación se desarrolló en el laboratorio de cultivo de tejidos vegetales del Centro de Estudios Biotecnológico, en la Universidad de Matanzas Sede Camilo Cienfuegos, Cuba. Este es un laboratorio de investigación y docencia donde se realizan prácticas de laboratorio por estudiantes de las carreras afines.
Caracterización y tratamiento a los residuales
Se partió de las materias primas empleadas en las prácticas de laboratorio por los estudiantes. Se tuvieron en cuenta las propiedades físico-químicas de los residuos, así como los riesgos a los que está expuesto el personal que trabaja en el laboratorio. Para ello, se identificaron por cada una de las actividades los residuales que se generaban, se realizó un examen físico y se midió su volumen.
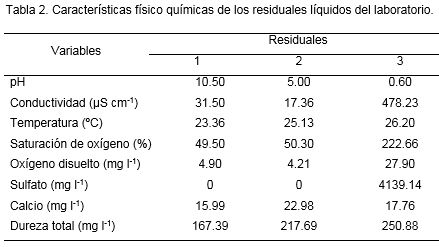
Posteriormente, se realizó una caracterización físico química de los residuales líquidos del laboratorio según los Métodos Normalizados para el análisis de Aguas Potables y Aguas Residuales (APHA, 2005) y Norma Cubana 27: 2012 (ONN, 2012).
Se tomaron tres muestras con tres réplicas por cada residual inmediatamente después de realizadas las prácticas de laboratorio. Los análisis fueron los siguientes: examen físico de las muestras, pH, conductividad eléctrica (µS cm-1), temperatura (°C), contenido de oxígeno disuelto (mg l-1), saturación de oxígeno (%), contenido de calcio y de sulfato (mg l-1).
Los residuales semisólidos se sometieron a tratamiento y se analizaron de forma similar.
Atendiendo a las características de los residuales se diseñaron y evaluaron estrategias para su tratamiento.
Identificación de riesgos ambientales y fuentes de contaminación microbiana
Para identificar los riesgos ambientales y las fuentes de contaminación microbiana del material vegetal propagado por cultivo in vitro que generan residuales se puntualizaron todas las actividades de riesgo, se analizó el tipo de riesgo que implicaba cada actividad, así como si se cumplían o no las normas de asepsia.
Por último, se realizó un análisis microbiológico ambiental por cada área del laboratorio para monitorear presencia de microorganismos en el aire de los locales. Para ello se empleó el método de las placas fijas expuestas. A 1 m de altura (en relación con el piso), se colocaron placas de Petri con Agar nutriente (BioCen) para bacterias y Agar Extracto de Malta (BioCen) para los hongos en al menos cinco puntos de cada habitación. Las placas se expusieron por 15 minutos y luego se incubaron durante 24-72h a 30 °C y oscuridad. Posteriormente se analizaron en microscopio estereoscópico para verificar la presencia de colonias de microorganismos y cuantificarlas. Los muestreos se efectuaron en el área de preparación medios de cultivo, cuarto de cabinas de flujo laminar y cámara de crecimiento.
Los microorganismos contaminantes se identificaron según los criterios de los manuales tradicionales de clasificación en el Laboratorio de Microbiología de la Planta Libertad de Colón, Matanzas.
Además, se realizaron entrevistas a trabajadores y estudiantes sobre la implementación de medidas de seguridad en el laboratorio y normas de asepsia para el cultivo in vitro de plantas así como su cumplimiento.
A partir de los resultados del trabajo se propuso un conjunto de medidas para reducir el impacto ambiental negativo de los residuales del laboratorio, lograr disminuir el riesgo ambiental de contaminación de los cultivos in vitro y mejorar la bioseguridad del personal que trabaja en el laboratorio.
RESULTADOS Y DISCUSIÓN
Caracterización y tratamiento de los residuales
Se comprobó que el trabajo en el laboratorio de cultivo de tejidos generaba residuales en varias actividades (Tabla 1). Las características de cada residual diferían al involucrar productos químicos diferentes en cada proceso. Además, el volumen de los residuales podía fluctuar en dependencia del técnico que utilizara un mayor o menor volumen de agua.

Las características físico químicas de los residuales líquidos indicaron que tanto el residual 2 como el 3 por su pH ácido (Tabla 2) requerían un tratamiento de neutralización y dilución.
Especialmente, el residual 3 tenía pH=0.6, ácido que puede provocar corrosión en los desagües y daños epidérmicos al personal por quemaduras. Se propuso una neutralización con hidróxido de sodio al 22%. Este método se aplicó a las muestras tomadas del residual. Teniendo en cuenta lo planteado por Panreac (1995) que recomiendan la dilución 1:5 para el tratamiento por neutralización y posteriormente 1:10, se realizó el tratamiento a nivel de laboratorio en un recipiente de 1 litro y se repitió a nivel de banco en uno de 5 litros para cada una de las muestras. Los residuales con pH 2 o pH 12 son considerados peligrosos por corrosividad (Environmental Protection Agency, 1980).
La aplicación de la neutralización como alternativa de tratamiento a través de la operación de mezclado permite disminuir el impacto ambiental negativo de estos residuales. Para el tratamiento de volúmenes elevados de residuales se requiere el diseño de un reactor para este fin.
Los residuales 4 y 5 contienen componentes del medio de cultivo entre los cuales se encuentra el agar que permite su solidificación. Por ello se sometieron a tratamiento en autoclave a 75 °C, por 10 minutos ya que es suficiente para que la muestra se disuelva. Inmediatamente después se diluyó como mínimo 1:8, por cada 30 ml de muestra (según resultados de ensayos preliminares).
En el caso del residual 5 se realizó el mismo procedimiento con la diferencia de que este se encuentra contaminado por microorganismos, lo que se hace obligatorio descontaminarlo en autoclave a 121 °C, 1 atm de presión por un tiempo de 45 min. Luego filtrarlo para desechar el contenido sólido.
Posterior al tratamiento térmico de los residuales 4 y 5 los resultados de los análisis físico–químicos (Tabla 3) indicaron que podían ser vertidos.

Identificación de riesgos y fuentes de contaminación microbiana
A partir del análisis realizado se comprobó que la generación del residual 5 que contenía microorganismos contaminantes tenía entre sus causas incumplimientos de las medidas de asepsia y normas de trabajo para un laboratorio de cultivo in vitro de plantas.
Por otra parte, el muestreo ambiental indicó presencia de incontables colonias de bacterias que son indicativo de la presencia de polvo en el ambiente y algunas de ellas, habitantes de la microbiota del cuerpo humano (Alvarado-Capó, 1998; Leifert y Woodward, 1998; Leifert y Cassells, 2001; Cassells, 2011). Entre las especies identificadas se encuentran: Bacillus subtilis, Micrococcus luteus, Bacillus sp., Staphyloccoccus sp. y Staphylococcus epidermidis. Además, se identificaron como contaminantes ambientales levaduras, Mucor spp. y Penicillium digitatum.
Los medios de cultivo pueden contaminarse durante su preparación, en fallos en el proceso de esterilización, mala manipulación, contaminación del aire y en general por incumplimiento de las medidas de asepsia (Alvarado-Capó, 1998; Leifert y Cassells, 2001). Esto trae consigo la contaminación de los explantes y por tanto pérdidas materiales, económicas y energéticas (Leifert y Cassells, 2001; Cassells, 2011).
El resultado de las encuestas y entrevistas arrojó que las medidas de asepsia en el laboratorio no siempre se cumplen de forma correcta. No se cuenta con información suficiente sobre los riesgos ambientales, el tratamiento de residuales o las normas de bioseguridad que deben cumplirse en el laboratorio. Aunque se conocen las normas generales de trabajo y para algunas actividades específicas, no están recogidas en un manual de procedimientos que facilite su consulta, la capacitación del personal y la exigencia de su cumplimiento. El laboratorio debe tener las condiciones de diseño e infraestructura adecuadas para el trabajo según lo indican las normas.
En correspondencia con lo expuesto por diferentes autores (Leifert y Cassells, 2001; OMS, 2005; Read y Peerce, 2008; Richmond y McKinney, 2008; Cassells, 2011) se propusieron las siguientes medidas para minimizar los riesgos en el laboratorio y para la gestión ambiental respecto a los residuales generados por la actividad docente.
Acceso y permanencia en el laboratorio
- No se autorizará el paso a la zona de trabajo del laboratorio a las personas que no hayan sido informadas sobre los posibles riesgos y satisfagan cualquier requisito que se exija para entrar.
- No se permitirá la entrada de niños en la zona de trabajo del laboratorio.
Seguridad del personal
- Los estudiantes y trabajadores del laboratorio deben estar familiarizados con los reglamentos de seguridad disponibles.
- Cuando el trabajo práctico involucre gases, vapores, humos o partículas sólo podrá realizarse en campanas de extracción de gases.
- Utilizar batas en el laboratorio para la preparación de soluciones.
- El pipeteo con la boca estará prohibido.
- No se permitirá al personal comer, beber, fumar, guardar alimentos ni aplicar cosméticos en la zona de trabajo de laboratorio.
- Utilizar guantes en todas las actividades que entren en contacto accidental directo con material vegetal o medio de cultivo contaminado con microorganismos.
- Utilizar medios de protección a la hora de exponerse a radiaciones ultravioletas.
- Trabajar con cuidado cuando se emplee mechero en la cabina de flujo laminar para evitar accidentes.
- Cuando sea necesario proteger ojos y cara de salpicaduras, mediante el uso de dispositivos de protección.
- Realizar chequeo médico a las personas expuestas a riesgos biológicos.
Disminución del riesgo de contaminación microbiana de los cultivos
- Debe mantenerse el laboratorio limpio, y retirar de él cualquier material que no tenga relación con el trabajo.
- La superficie de trabajo se descontaminará cada semana y se desinfectará siempre que haya derramamiento de sustancias tóxicas o contaminadas.
- Lavarse las manos con jabón antibacteriano y abundante agua antes de comenzar a trabajar en la cabina de flujo laminar, después de manipular los materiales vegetales, así como al abandonar el laboratorio.
- Desinfectar con alcohol la superficie de la cabina de flujo laminar.
- Debe reducirse al mínimo la cantidad de recipientes de cultivo y otros materiales introducidos en la cabina de flujo laminar y ubicarse fuera de la zona de trabajo de manera que no se interrumpa el flujo de aire.
- El técnico no debe sacar y reintroducir repetidas veces sus brazos en la cabina de flujo laminar, ni tocarse la boca y los ojos mientras esté trabajando.
- Desinfectarse las manos con el desinfectante apropiado mientras se está manipulando el material vegetal.
- Utilizar la ropa apropiada incluyendo tapabocas y gorro y esta ropa no debe ser la misma que se utiliza para preparar las soluciones.
- No hablar ni utilizar prendas en el cuarto de cabina de flujo laminar.
- No pasar para el cuarto de cabina de flujo laminar con zapatos, utilizar las botas apropiadas.
- Se limitará el paso innecesario del personal en el cuarto de cabina de flujo laminar.
- La ropa de laboratorio protectora no se guardará en los mismos armarios que la ropa de calle.
- La ropa no se llevará fuera del laboratorio, en locales tales como oficinas, bibliotecas, salas de personal y cafeterías.
- El vapor de agua a presión constituye el medio más eficaz para efectuar la esterilización de pinzas, platos, bisturíes, papel etc. por medio del empleo de autoclaves, estas deberán utilizar una temperatura de 121 °C durante un tiempo mínimo de exposición de 30 minutos.
Disposición y tratamiento de residuales
- El docente responsable debe conocer y tener prevista la forma en que dichos desechos se dispondrán.
- Se prohíbe descargar líquidos inflamables o tóxicos o corrosivos por los desagües de las piletas, sanitarios o recipientes comunes para residuos.
- En cada caso, según el tipo de residual se deberán seguir los procedimientos establecidos para su gestión ya sea neutralización o tratamiento en autoclave.
- Los líquidos o sólidos contaminados se descontaminarán antes de eliminarlos o de volver a utilizarlos, en autoclave por un tiempo de 45 min. En el caso de los medios de cultivo después de esterilizados se le agregarán 250 ml de agua para que la solución se disuelva y poderlos eliminar.
- Los cultivos derramados deben cubrirse con un paño empapado en desinfectante y luego, al cabo de los 10 minutos por lo menos continuar con la limpieza.
- Siempre que se utilice la autoclave los materiales se colocarán en pequeñas bandejas para facilitar la evacuación del aire y permitir la buena penetración del calor.
- La utilización de la autoclave y su conservación deberán confiarse a personal especializado.
CONCLUSIONES
El laboratorio de cultivo de tejidos genera residuales que pueden ser tratados previos a su vertimiento para reducir el impacto ambiental negativo. A la vez, la identificación de los principales riesgos de contaminación ambiental y la definición de medidas para minimizarlos permitirá una adecuada gestión ambiental y contribuirá a la bioseguridad del personal.
REFERENCIAS
Alvarado-Capó Y (1998) Contaminación microbiana en el cultivo in vitro. En: Pérez Ponce J N (ed). Propagación y mejora de plantas por biotecnología, pp. 81-104. IBP, Santa Clara; ISBN: 959-7122-02-2
Álvarez S (2005) Manejo de desechos peligrosos en Cuba. Situación actual y perspectivas. Medio Ambiente y Desarrollo 5 (9): 01-02
APHA (1999) Standard Methods for the Examination of Water and Wastewater. American Public Health Association, Washington
Benavides L (1993) Guía para la definición y clasificación de residuos peligrosos. CEPIS, Lima
Cassells AC (2011) Detection and elimination of microbial endophytes and prevention of contamination in plant tissue culture. En: Trigiano RN, Gray DJ (eds). Plant Tissue Culture, Development, and Biotechnology, pp.223-238. CRC Press, Boca Raton; ISBN: 978-1-4200-8326-2
Díaz MP (2013) Prevención de riesgos laborales, seguridad y salud laboral. Ediciones Paraninfo SA, Madrid; ISBN: 9788428335270
Echeverria E, Seco A, Ferrer S (1993) Control of Activated Sludge settleability using preaeration and preprecipitation. Water Research 27: 293-296
Environmental Protection Agency (1980) Hazardous Waste Management System, Part III, Identification and Listing of Hazardous Waste. Federal Register 45 (98): 33066-33071
Leifert C, Cassells AC (2001) Microbial hazards in plant tissue and cell cultures. In vitro Cell Dev Biol Plant 37(2): 133-138; doi: 10.1079/IVP2000129
Leifert C, Woodward S (1998) Laboratory contamination management, the requirement for microbiological quality assurance. Plant Cell Tiss Organ Cult 52: 85–88
Martínez J, Mallo M, Lucas R, Alvarez J, Salvarrey A, Gristo P (2005) Guía para gestión integral de residuos peligrosos, fundamentos. Centro Coordinador del Convenio de Basilea para América Latina y el Caribe, Montevideo
OMS (2005) Manual de bioseguridad en el laboratorio.OMS, Ginebra; ISBN: 92 4 354650 3
ONN (2012) Vertimiento de aguas residuales a las aguas terrestres y alcantarillado, NC 27:2012. Oficina Nacional de Normalización, La Habana
Panreac (2005) Manual de seguridad en laboratorios químicos. Panreac química SA, Barcelona
Read PE, Peerce JE (2008) Environmental management for optimizing micropropagation. Acta Hort ISHS 616: 49-57; doi: 10.17660/ActaHortic.2003.616.2
Richmond JY, McKinney RW (2008) Manual práctico para la evaluación del riesgo biológico en actividades laborales diversas. BIOGAVAL, Valencia
Recibido: 22-05-2015
Aceptado: 09-11-2015
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
