Artículo original
Biotecnología Vegetal Vol. 16, No. 2: 103 - 111, abril - junio, 2016
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Mutagénesis in vitro en suspensiones celulares embriogénicas de banano cv. Grande naine (Musa AAA)
In vitro mutagenesis in embryogenic cell suspensions of banana cv. Grande naine (Musa AAA)
Idalmis Bermúdez-Caraballoso, Mayelín Rodríguez, Maritza Reyes, Rafael Gómez- Kosky, Borys Chong-Pérez, Leonardo Rivero
Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.
e-mail: idalmis@ibp.co.cu
RESUMEN
La embriogénesis somática es un proceso útil para la propagación clonal y el mejoramiento genético por inducción de mutaciones. Este trabajo se realizó con el objetivo de determinar el efecto de radiaciones Gamma fuente 60Co en suspensiones celulares embriogénicas de banano cv. ‘Grande naine’ (Musa AAA) hasta la conversión en plantas. Se aplicaron diferentes dosis de radiación (0, 30, 40, 50, 60, 70 y 80 Gy) a suspensiones celulares embriogénicas en fase de multiplicación y posteriormente se pusieron a formar, madurar y germinar los embriones. Para determinar la respuesta ex vitro de la población de plantas obtenidas estas se transfirieron a casa de cultivo. Los resultados mostraron que con el indicador masa fresca de los embriones somáticos formados no se observaron diferencias entre el efecto de las diferentes dosis de radiación aplicadas y el control. Sin embargo, la dosis de radiación afectó el porcentaje de formación y germinación de embriones somáticos. Con el empleo de 40 Gy se regeneraron plantas con variaciones fenotípicas. Los resultados en casa de cultivo evidenciaron que a medida que aumentaron las dosis de radiación hasta 50 Gy se incrementó la frecuencia de variaciones. Con dosis de radiación superiores se afectó la supervivencia de las plantas.
Palabras clave: dosis de radiación, embrión somático, radiaciones Gamma, radiosensibilidad
ABSTRACT
Somatic embryogenesis is a useful process for clonal propagation and genetic improvement by induction of mutations. This work was carried out with the objective of determining the effect of 60Co source Gamma radiations on embryogenic cell suspensions of banana cv. 'Grande naine' (Musa AAA) until conversion to plants. Different doses of radiation (0, 30, 40, 50, 60, 70 and 80 Gy) were applied to embryogenic cell suspensions in the multiplication phase and the embryos were later formed, matured and germinated. To determine the ex vitro response of the population of plants obtained these were transferred to greenhouse. The results showed that with somatic embryos formed fresh mass no differences were observed between the effect of the different doses of radiation applied and the control. However, the radiation dose affected the percentage of somatic embryo formation and germination. Plants with phenotypic variations were regenerated with 40 Gy. The results at the greenhouse showed that as radiation doses increased up to 50 Gy, the frequency of variations increased. With higher doses of radiation the survival of the plants was affected.
Keywords: Gamma radiation, in vitro mutagenesis, radiation dose, radiosensibility, somatic embryo
INTRODUCCIÓN
Los bananos (Musa spp.) se encuentran entre las frutas más importantes en el mundo, se cultivan en más de 120 países, en su mayoría por pequeños productores (Pestana et al., 2011). Este cultivo es considerado uno de los más importantes en materia de seguridad alimentaria, ya que es una fuente de energía fácil y barata, además de ser muy rico en vitaminas A, C y B6 (Ravi et al., 2013).
La inducción de variaciones genéticas por diferentes métodos y técnicas es una herramienta básica en manos de los mejoradores de plantas para el desarrollo de nuevos cultivares con tolerancia a estrés abiótico, resistencia a plagas y enfermedades y el mejoramiento de la calidad y el rendimiento agrícola (Arene et al., 2007; Xu et al., 2012). Sobre esto se ha trabajado en el cultivo de bananos y plátanos por diferentes autores (Alves y Lima, 2000; Jain, 2005; 2010). De acuerdo con Xu et al. (2012) dichas técnicas posibilitan el aumento de la variabilidad genética, así como la rápida multiplicación de los mutantes obtenidos.
Por su uso, tanto para la propagación masiva como para el mejoramiento genético, la tecnología de la embriogénesis somática se ha ido aplicando en varios cultivos. Entre las ventajas que ofrece está el origen unicelular del embrión somático lo cual minimiza o elimina la formación de quimeras en las plantas regeneradas. Por otro lado, el empleo de suspensiones celulares embriogénicas es un material vegetal ideal para la inducción de mutaciones debido a la producción de embriones somáticos mutados. El proceso se logra automatizar, ya que los embriones somáticos pueden ser obtenidos en un biorreactor para su producción a gran escala y posterior selección in vitro. Finalmente, las células embriogénicas pueden ser almacenadas por largos períodos de tiempo en crioconservación lo cual facilita la preservación de los mutantes (Suprasanna et al., 2012).
Se han desarrollado dos sistemas de inducción de mutaciones para el mejoramiento genético de Musa spp. El primero, basado en la irradiación de los hijuelos in vivo antes de la extracción y cultivo de yemas in vitro, solo que los autores lograron un bajo número de mutantes (De Guzman et al., 1982). El segundo, apoyado en las técnicas de inducción de mutaciones de yemas in vitro, recuperación de los mutantes tratando de evitar o reducir la aparición de quimeras y la micropropagación de los mutantes deseables (García et al., 2002) con mejores resultados. Roux (2004) con el empleo de radiaciones Gamma informó la obtención de diferentes mutantes de banano con características morfológicas mejoradas como forma y tamaño del racimo (línea mutante: ‘Klue Hom Thong KU1’) en Tailandia; cambios en la altura de las plantas: ‘SH-3436-L9’ y ‘SH-3436- 6.44’ en Cuba; líneas mutantes con incremento de la tolerancia a Fusarium oxysporum (‘Mutiara’ y ‘Novaria’) desarrolladas en Malasia; así como los mutantes con tolerancia a la toxina de Mycosphaerella fijiensis (‘GN35-I y GN35-VIII’) obtenidos por la Agencia Internacional de Energía Atómica.
Hasta el momento, solo Roux (2004) ha referido el uso de suspensiones celulares embriogénicas de banano como explante para el tratamiento mutagénico in vitro en los cultivares ‘Williams’ (AAA) y ‘Three Hand Planty’ (AAB). Sin embargo, este autor encontró que la dosis de radiación a emplear varió con la constitución genética de cada cultivar, por lo que es preciso realizar estudios de radiosensibilidad al utilizar otros. Por su parte, Kulkarni et al. (2004) en ‘Grande naine’ (AAA) realizaron el estudio de sensibilidad a la radiación Gamma solo a nivel de establecimiento del cultivo de la suspensión celular. Por esta razón, esta investigación tuvo como objetivo determinar el efecto de radiaciones Gamma fuente 60Co en suspensiones celulares embriogénicas de banano cv. ‘Grande naine’ hasta la conversión en plantas.
MATERIALES Y MÉTODOS
Material vegetal
Se utilizaron flores masculinas inmaduras de inflorescencias (pámpanas) del cultivar ‘Grande naine’ (Musa AAA). Estas fueron colectadas directamente de plantas adultas que crecían en condiciones de campo en la Empresa de Cultivos Varios ‘La Cuba’, en la provincia de Ciego de Ávila, Cuba. Para la obtención de los callos con estructuras embriogénicas, establecimiento y multiplicación de la suspensión celular se siguió la metodología propuesta por Escalant et al. (1994).
Tratamiento mutagénico
Se utilizaron suspensiones celulares embriogénicas (SCE) en fase de multiplicación, con cuatro días después del último subcultivo. La suspensión celular se preparó al 25% del volumen de células sedimentadas y se adicionaron 0.5 ml de células en tubos Eppendorf de 1.5 ml de capacidad (seis por cada dosis de radiación). Para determinar la curva de dosis de radiación con rayos Gamma fuente 60Co se estudiaron siete tratamientos (0, 30, 40, 50, 60, 70 y 80 Gy). Para ello se utilizó un irradiador MPX-25, con una potencia de dosis de 11.3 Gy min-1. El equipo se encuentra en el Centro de Aplicaciones Tecnológicas y desarrollo Nuclear (CEADEN) de La Habana, Cuba.
Después de la irradiación, las células se transfirieron al medio de cultivo RD1 propuesto por Gómez-Kosky et al. (2002) para formar embriones somáticos el cual estaba compuesto por sales MS al 50% (Murashige y Skoog,1962)(Duchefa), vitaminas MS, ácido ascórbico 100 mg l-1, mio-inositol 100 mg l-1, sacarosa 30 g l-1 y Phytagel® (SIGMA) 2.2 g l-1. En todos los casos el pH se ajustó a 5.7 antes de la esterilización en autoclave.
Se adicionaron 10 ml de medio de cultivo por placa de Petri y se descargó el contenido de cada tubo Eppendorf encima de una malla de poliestireno (1 cm2) de tamaño de poro de 50 µm cada una, las cuales se colocaron encima del papel de filtro estéril para eliminar el medio de cultivo líquido y sobre estas se depositó la suspensión de células embriogénicas. En ese momento se determinó la masa fresca (mg) inicial de cada muestra (mgMF), con la ayuda de una balanza analítica (SARTORIUS).
Las condiciones de cultivo fueron oscuridad total a 27±2 ºC. A los 21 días de cultivo se realizaron observaciones de la formación de los embriones somáticos y se determinó la masa fresca (mg) y el porcentaje de formación de embriones somáticos por tratamiento.
Posteriormente el contenido de cada muestra se transfirió a placas de Petri con medio de cultivo de maduración de embriones somáticos, propuesto por Gómez-Kosky et al. (2002) compuesto por sales MS, biotina 1.0 mg l-1, 6 bencilaminopurina (6-BAP) 0.25 mg l-1, ácido indol acético (AIA) 0.75 mg l-1, sacarosa 45 g l-1 y Phytagel® 2.2 g l-1. Se tomaron grupos de 8-10 embriones somáticos y se colocaron 50 grupos por placa de Petri.
Las condiciones de cultivo fueron oscuridad total a 27±2 ºC. A los 21 días se subcultivaron los embriones somáticos maduros al medio de cultivo de germinación compuesto por sales MS, vitaminas MS, 6-BAP 0.5 mg l-1, AIA 2.0 mg l-1, mio-inositol 100 mg l-1, sacarosa 30 g l-1. Como agente gelificante se utilizó Phytagel ® 2.2 g l-1. Se colocaron 15 embriones somáticos por frasco de cultivo de 250 ml de capacidad con 30 ml de medio de cultivo. Se cuantificó el número de embriones somáticos germinados y se calculó el porcentaje de germinación a los 90 días de cultivo.
Las condiciones de cultivo fueron cámaras de crecimiento con luz solar y fotoperíodo propio de la época del año, a 27 ± 2 C y a una densidad de flujo de fotones fotosintéticas (DFFF) de 50 - 62.5 μmol m-2 s-1.
Finalmente los embriones somáticos completamente germinados se colocaron en el medio de cultivo de crecimiento (sales MS, sacarosa 30 g l-1 y Phytagel ® 2.2 g l-1) hasta lograr una altura de la planta de cuatro a cinco centímetros y más de tres hojas emitidas. Las condiciones de cultivo fueron similares a la germinación de los embriones somáticos.
Para estudiar la respuesta ex vitro de la población de plantas obtenidas a partir de las SCE irradiadas con cada dosis y un control de plantas obtenidas de SCE sin irradiar se transfirieron a casa de cultivo. El ensayo se realizó en condiciones ambientales con luminosidad reducida de 60-70% mediante una malla sarán. Se colocaron en bandejas de plástico de 35 orificios de forma cuadrada, de 120 cm3 de volumen cada uno. El sustrato usado fue una mezcla de 75% de humus de lombriz y 25% de zeolita más la fertilización con fórmula completa 8-13-21 a dosis de 2.5 kg m-3. El cultivo se realizó a temperatura ambiente, entre 32-34 ºC durante el día y entre 22-24 ºC durante la noche y el riego se realizó tres veces al día con una duración de 10 minutos por microaspersión. Se evaluó la supervivencia a los 15 días de cultivo. A los 60 días se evaluó por observación visual la aparición de cambios de color en hojas, pecíolos y pseudotallo.
Con los datos obtenidos en cada evaluación se calculó la dosis letal media (DL50) (dosis en la que el 50% del material vegetal tratado muere) y la dosis de crecimiento medio (GR50) (dosis que reduce el crecimiento en un 50%) (Suprasanna et al., 2012).
El diseño experimental empleado fue completamente aleatorizado. El procesamiento estadístico de los datos experimentales se realizó con la ayuda del Paquete estadístico Statistic Packaged for Social Science (SPSS) versión 18.0 para Windows (Microsoft ®). Se utilizó un análisis de regresión lineal, así como la prueba de Kruskall Wallis/ Mann Witney para las comparaciones entre las parejas de grupos con un nivel de significación para p≤0.05 al no cumplirse los supuestos de normalidad y homogeneidad de varianzas.
RESULTADOS Y DISCUSIÓN
A los 21 días de cultivo al utilizar como indicador la masa fresca de los embriones somáticos formados no se observaron diferencias entre el efecto de las diferentes dosis de radiación aplicadas y el control. Atendiendo a los resultados esta variable no resultó adecuada para determinar la DL50 y la GR50 al utilizar suspensiones celulares embriogénicas de banano cv. ‘Grande naine’. Sobre lo anterior, los resultados de otros investigadores han sido contradictorios. De acuerdo con Jain (2000) y Pedrieri (2001 las evaluaciones de la masa fresca y seca de callos y suspensiones celulares embriogénicas irradiadas, así como el número de plantas regeneradas permiten estimar el valor de la DL50 y GR50. Sin embargo, Roux et al. (2004) para el estudio del efecto de la dosis de radiación en suspensiones celulares embriogénicas de banano, la capacidad de regeneración es una variable más adecuada que el volumen de células sedimentadas o la masa fresca.
El porcentaje de formación de embriones somáticos reveló que la dosis de radiación afectó esta variable. A medida que estas aumentaban desde 30 Gy hasta 80 Gy se formaron menos embriones somáticos en relación con el control sin irradiar. El procedimiento más común para determinar la dosis de radiación óptima está basado en la respuesta de sensibilidad de los tejidos o células al agente mutagénico utilizado. La dosis que logró una reducción cercana al 50% de los embriones formados con respecto al control sin irradiar fue la de 40 Gy con el 51.6% de embriones somáticos formados. Por ello, para esta fase del proceso de embriogénesis somática se seleccionó como la GR50 (Figura 1). Con la dosis inferior de 30 Gy, no se observaron diferencias significativas con el control sin irradiar. Roux et al. (2004) refirieron que bajas dosis de radiación puede llegar a estimular el crecimiento de los tejidos vegetales.
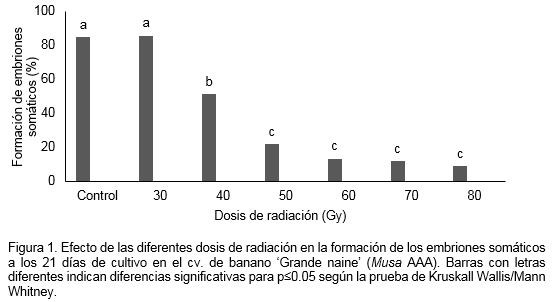
Resultados similares obtuvieron Roux et al. (2004) al irradiar suspensiones celulares de banano cv. ‘Williams’ (AAA) y ‘Three Hand Planty’ (AAB) donde encontraron la DL50 y GR50 con dosis de 50 y 75 Gy respectivamente. Contrario a estos resultados, Kulkarni et al. (2004) en banano cv. ‘Grande naine’ al emplear suspensiones celulares embriogénicas estas fueron más radiosensibles y la dosis de 40 Gy fue letal. Sin embargo, estos resultados pudieran atribuirse a que los mencionados autores luego de irradiar las suspensiones celulares embriogénicas las mantuvieron por 40 días en el medio de cultivo de multiplicación de la suspensión celular en estado líquido, lo cual puede provocar un aumento de la fenolización de las células tornándose púrpura oscuro con un aumento del grado de oscurecimiento con la dosis de radiación y no solo a las afectaciones provocadas directamente por las radiaciones.
Al respecto, Roux et al. (2004) plantearon que las suspensiones celulares embriogénicas de Musa pueden tolerar dosis más altas de radiación que las yemas axilares. Otros autores como Smith et al. (2006) al emplear yemas adventicias de banano cv. ‘Dwarf Parfitt’ (Musa AAA) encontraron la dosis de radiación de 20 Gy óptima para la selección de mutantes resistentes a Fusarium oxysporum f. sp. cubense raza 4. De acuerdo con Suprasanna et al. (2012) las células en activa división celular son más sensibles al tratamiento mutagénico que aquellas que no lo están. Estas discrepancias pueden ser atribuidas a varios factores relacionados con el genotipo, estado fisiológico del explante inicial, contenido de agua de la suspensión celular, entre otros, según Kulkarni et al. (2007).
Otros autores como, Joseph et al. (2004) al emplear la embriogénesis somática lograron inducir variabilidad en el cultivo de la yuca (Manihot esculenta Crantz). Dichos investigadores refirieron que con una dosis de 50 Gy de rayos Gamma lograron un 50% de líneas mutantes que variaron en su morfología respecto al cultivar donante.
En varios cultivares de bananos y plátanos se definen diferentes rangos de dosis de radiación. Según, Jain (2010) de 10-20 Gy de irradiación Gamma para cultivares diploides: ‘Calcuta 4’ (AA) y ‘Tani’ (BB), de 30-40 Gy para triploides: ‘Three Hand Planty’ (AAB), ‘Grande naine’ (AAA), ‘Williams’ (AAA) y ‘Kamaramasenge’ (AAB) y de 40-50 Gy para otros triploides como ‘Cachaco’ (ABB). Al respecto, Novak et al. (1990) y Reyes-Borja et al. (2010) plantearon que los cultivares en Musa muestran diferentes niveles de radiosensibilidad, así como de su recuperación posterior a la irradiación. Esas diferencias dependen del nivel de ploidía y de la constitución del genoma acuminata o balbisiana.
El análisis de regresión lineal indicó que a medida que aumentaron las dosis de radiación disminuyó el porcentaje de germinación de los embriones somáticos. La GR50 se mantuvo con la dosis de 40 Gy donde se alcanzó el 47% de los embriones somáticos germinados (Figuras 2 y 3).
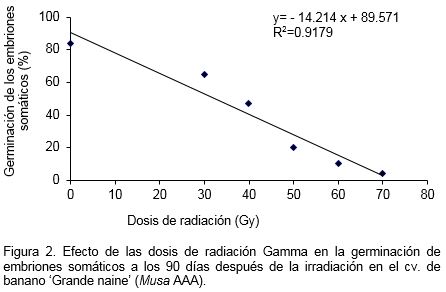

La baja capacidad de regeneración de las suspensiones celulares embriogénicas con dosis superiores a los 40 Gy, puede ser atribuida al efecto tóxico de la radiación en las células y tejidos lo que provoca una reducción de la competencia de esas células y sus progenies. En su paso a través de las células de los organismos vivos, los rayos Gamma ionizan al azar las moléculas, provocando la ruptura de enlaces químicos y la liberación de productos radiolíticos. Al ser el agua la molécula más abundante en las células, el principal producto de la radiación son especies reactivas de oxígeno que se difunden dentro del ambiente acuoso de los diferentes compartimentos celulares como por ejemplo: citoplasma, plastidios, núcleo y en el citosol. Estas especies reactivas de oxígeno reaccionan con macromoléculas en otros compartimentos celulares y esta acción indirecta de la radiación es la responsable del 99.9% de los daños a las proteínas, lo cual se traduce en decrecimiento de sus funciones y cambios en su estructura. La irradiación en los tejidos induce estrés en la supervivencia de las plantas, lo cual afecta significativamente los procesos fisiológicos y bioquímicos, que se traduce en perturbaciones de la síntesis de proteínas, actividad enzimática, balance hormonal, intercambio gaseoso y acuoso de los tejidos entre otros (Lagoda, 2012).
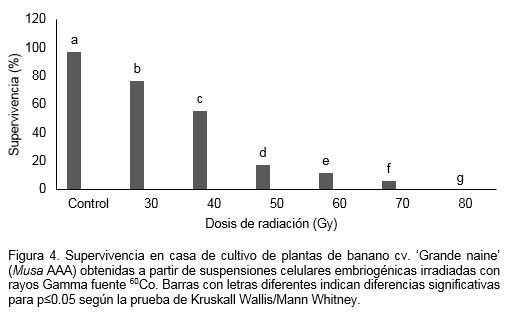
En la casa de cultivo se pudo observar que a medida que aumentaban las dosis de radiación se produjo una disminución en la supervivencia de las plantas (Figura 4). Con la dosis de 40 Gy solo el 55.5% de las plantas lograron sobrevivir y a partir de 50 Gy menos del 20%. Atendiendo a estos resultados 40Gy se consideró la DL50.
El bajo porcentaje de supervivencia a nivel de casa de cultivo después del tratamiento mutagénico es un aspecto a tener en cuenta para evitar la pérdida de los mutantes obtenidos. Al respecto, Suprasanna et al. (2012) plantearon que es necesario, durante esta fase tener especial cuidado, así como con el tiempo de cultivo in vitro que puede estar asociado con efectos epigenéticos tales como la metilación, pudiendo estos enmascarar los resultados de la investigación.
En los programas de mejoramiento genético no convencionales en bananos y plátanos se necesitan como explantes iniciales aquellos que logren una alta capacidad regenerativa, tal es el caso del empleo de suspensiones celulares embriogénicas. Según, Okole (2010) se han empleado yemas adventicias, callos, protoplastos y células en suspensión. Además, se ha comprobado que el proceso de inducción de mutaciones en estos tejidos seguido de un proceso de selección in vitro usando las toxinas del patógeno resulta una tecnología muy eficiente en la selección de genotipos mejorados en Musa a patógenos fúngicos.
En general, la frecuencia de variaciones fenotípicas se incrementó con la dosis de radiación aplicada hasta los 70 Gy (Tabla 1).
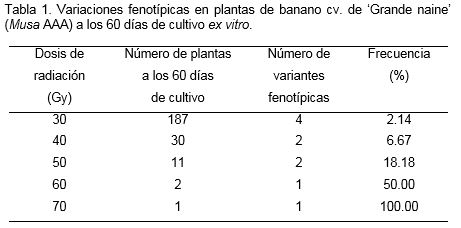
Entre los cambios fenotípicos que se observaron predominó la presencia de hojas deformadas y coriáceas así como el cambio de color en el pseudotallo a un rojo más intenso.
De acuerdo con Novak et al. (1990) en bananos y plátanos se informa la presencia de considerables variaciones fenotípicas entre las plantas regeneradas a partir de yemas irradiadas en estados tempranos de desarrollo de la planta a nivel de casa de cultivo. Entre las variaciones que predominaron aparecieron afectaciones en la emergencia y expansión de la hoja más joven, varias plantas formaron hojas en forma de roseta compacta parecido a lo observado en este trabajo. Estos autores informaron también morfología aberrante de la lámina de la hoja más joven debido al daño del meristemo apical. De igual forma, Reyes-Borja et al. (2010) mencionaron como característica más relevante la presencia de hojas dobles y enrrolladas, mientras que la más frecuente fueron hojas con manchas amarillas en los cultivares ‘FHIA-01’ (AAAB) y ‘Orito’ (AA).
Los resultados a nivel de casa de cultivo evidenciaron que a medida que aumentaron las dosis de radiación hasta 50 Gy se incrementó la frecuencia de variaciones. Con dosis de radiación superiores se afectó la supervivencia de las plantas.
CONCLUSIONES
Las radiaciones Gamma fuente 60Co aplicadas en suspensiones celulares embriogénicas de banano cv. ‘Grande naine’ (Musa AAA) afectan la formación, germinación y conversión en planta de embriones somáticos. Los indicadores porcentaje de formación y germinación de los embriones somáticos permiten determinar la GR50 y la supervivencia en casa de cultivo la DL50. Con el empleo de de 40 Gy se regeneraron plantas con variaciones fenotípicas. Los resultados a nivel de casa de cultivo corroboraron un aumento progresivo de la frecuencia de variaciones en las plantas regeneradas con el incremento de la dosis de radiación.
AGRADECIMIENTOS
Al Centro de Aplicaciones Tecnológicas y desarrollo Nuclear de la Habana, Cuba (CEADEN) por el servicio prestado en las irradiaciones del material vegetal.
REFERENCIAS
Alves GD, Lima BM (2000) Tratos Culturais. En: Cordeiro ZJM (ed). Banana Produção: Aspectos Técnicos, pp. 83-91. Embrapa. Brasília; ISBN: 85-7383-070-0 1
Arene L, Bellenot-Kapusta V, Belin J, Cadic A, Clerac M, Decourtye L, Duron M ( 2007) Breeding program on woody ornamental plants in Angers, France a collaboration of thirty two years between INRA and SAPHO. Acta Hortic 743: 35-38; doi: 10.17660/ActaHortic.2007.743.2
De Guzman EV, Del Rosario AG, Pagcaliwagan PC (1982) Production of mutants by irradiation of in vitro cultured tissues of coconut and banana and their mass propagation by tissue culture technique. En: Lubin D (ed) Induced mutations in vegetative propagated plants, pp. 113-118. Vienna, Austria; ISBN: 0074-1876
Escalant JV, Teisson C, Cote F (1994) Amplified somatic embryogenesis from male flowers of triploid banana and plantain cultivars (Musa spp.). In Vitro Cell Dev Biol 30 (4):181-186; doi: 10.1007/BF02823029
García LR, Pérez PJ, Bermúdez-Caraballoso IC, Orellana PP, Veitía NR, Padrón YM, Romero CQ (2002) Comparative study of variability produced by induced mutation and tissue culture in banana (Musa spp.) cv. ‘Grande Naine’. INFOMUSA 11:4-6
Gómez-Kosky R, de Feria Silva M, Posada LP, Gilliard T, Bernal Martínez F, Reyes MV, Chávez MM, Quiala EM (2002) Somatic embryogenesis of the banana hybrid cultivar FHIA-18 (AAAB) in liquid medium and scaled-up in a bioreactor. Plant Cell, Tissue and Organ Culture 68 (1): 21-2; doi: 10.1023/A: 1012905825307
Jain SM (2000) Mechanisms of spontaneous and induced mutations in plants. En: Moriarty M, Mothersill C, Seymour C, Edington M, Ward JF, Fry RJM (eds) Proceedings of the 11 th International Congress of Radiation Research, Dublin, 18–23/07/1999, pp. 255-258, International Association for Radiation Research, Kansas; ISBN: 189127614X
Jain SM (2005) Major mutation-assisted plant breeding programs supported by FAP/IAEA. Plant Cell Tissue Organ Cult 82 (1): 113-123; doi: 10.1007/s11240-004-7095-6
Jain SM (2010) In vitro mutagenesis in banana (Musa spp.) improvement. Acta Horticult 879: 605-614
Joseph R, Yeoh HH, Loh CS (2004) Induced mutations in cassava using somatic embryos and the identification of mutant plants with altered starch yield and composition. Plant Cell Rep 23 (1-2): 91-98; doi: 10.1007/s00299-004-0798-7
Kulkarni VM, Ganaphati TR, Bapat VA, Rao PS (2004) Establishment of cell-suspension cultures in banana cv. Grand naine and evaluation of its sensitivity to Gamma-irradiation. Current Science 86 (7): 902-904
Kulkarni VM, Ganaphati TR, Suprasanna P, Bapat VA (2007) In vitro mutagenesis in banana (Musa spp.) using Gamma irradiation. En: Jain SM, Haggman H (eds) Protocols for micropropagation of woody trees and fruits, pp. 543-559. Springer, Berlín; ISBN: 978-1-4020-6352-7
Lagoda PJ (2012) Effects of radiation on living cells and plants. En: Shu QY, Brian P, Nakagawa H (eds) Plant Mutation Breeding and Biotechnology, pp. 123-134. CABI. Italia; ISBN: 178 0640 854
Murashige T, Skoog R (1962) A revised medium for rapid growth and bio-assay with tobacco tissue culture. Physiologia Plantarum 15:473-497
Novak FJ, Afza R, Van Duren M, Omar MS (1990) Mutation induction by gamma irradiation of in vitro cultured shoot tips of banana and plantain (Musa cvs.). Tropical Agriculture 67: 21-28
Okole B (2010) Mass-screening techniques for early selection of banana and plantain crops resistant to major diseases and pests. En: Joint FAO/IAEA (eds) Mass Screening Techniques for Selecting Crops Resistant to Diseases, pp. 47-58. Vienna; ISBN: 978-92-0-105110-3
Pestana RK, Amorim EP, Ferreira CF, Amorim VBO, Oliveira LS, CAS Ledo, SO Silva (2011) Genetic dissimilarity of putative Gamma-ray-induced ‘Preciosa - AAAB-Pome type’ banana (Musa spp.) mutants based on multivariate statistical analysis. Genetics and Molecular Research 10 (4): 3976-3986; doi: 10.4238/2011.October.25.2
Predieri S (2001) Mutation induction and tissue culture in improving fruits. Plant Cell Tiss Org Cult 64 (2): 185-210; doi: 10.1023/A: 1010623203554
Ravi I, Uma S, Vaganan MM, Mustaffa MM (2014) Phenotyping bananas for drought resistance. En: Monneveux P, Ribaut JM, Okono A (eds) Drought phenotyping in crops: from theory to practice, Frontiers research topics, pp. 223-233. Frontiers E-books; ISBN: 978-2-88919-181-9
Reyes-Borja WO, Sotomayor I, Garzón I, Vera D, Cedeño M, Degi K, Nagatomi S, Tanaka A, Hase Y, Sekozawa Y, Sugaya S, Gemma H (2010) Mutation induction by Gamma-rays and carbon ion beam irradiation in banana (Musa spp.): a study with an emphasis on the response to Black sigatoka disease. En: Joint FAO/IAEA (eds) Mass Screening Techniques for Selecting Crops Resistant to Disease, pp. 59-89. IAEA, Vienna; ISBN: 978-92-0-105110-3
Roux NS (2004) Mutation induction in Musa-Review. En: Jain SM, Swennen R (eds) Banana improvement: cellular, molecular biology, and induced mutations, pp. 23-32. Science, Enfield; ISBN: 1-57808-340-0
Roux NS, Toloza A, Dolozel J, Panis B (2004) Usefulness of embryogenic cell suspension cultures for the induction and selection of mutants in Musa spp. En: Jain SM, Swennen R (eds) Banana improvement: cellular, molecular biology, and induced mutations, pp. 32-36. Science, Enfield; ISBN: 1-57808-340-0
Smith MK, Hamill SD, Langdon PW, Giles JE, Doogan VJ, Pegg KG (2006) Towards the development of a Cavendish banana resistant to race 4 of fusarium wilt: Gamma irradiation of micropropagated Dwarf Parfitt (Musa spp., AAA group, Cavendish subgroup). Aust J Exp Agric 46:107-113; doi: 10.1071/EA04175
Suprasanna P, Jain MS, Ochatt SJ, Kulkarni VM, Predieri S (2012) Applications of in vitro techniques in mutation breeding of vegetative propagated crops. En: Shu QY, Brian P, Nakagawa H (eds) Plant Mutation Breeding and Biotechnology, pp. 371-385. CABI. Italia; ISBN: 178 0640 854
Xu L, Najeeb U, Naeem MS, Wan GL, Jin ZL, Khan F, Zhou WJ (2012) In vitro mutagenesis and genetic improvement. En: Gupta SK (ed) Technological Innovations in mayor World Oil Crops, pp. 151-173. Springer, London; ISBN: 10.1007/978-1-4614-0827-7-6
Recibido: 06-01-2016
Aceptado: 01-03-2016
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
