Artículo original
Biotecnología Vegetal Vol. 16, No. 4: 215 - 222, octubre - diciembre, 2016
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Variabilidad fenotípica en campo de plantas de Saccharum spp. híbrido cv. ‘C87-51’ regeneradas vía embriogénesis somática
Phenotypic variability in the field of Saccharum spp. hybrid cv. ‘C87-51’plants regenerated via somatic embryogenesis
Marisol Freire-Seijo, Rafael Gómez-Kosky, Idalia Herrera, Maritza Reyes, Manuel de Feria, Raúl Barbón, Elio Jiménez
Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830. e-mail: marisolf@ibp.co.cu
RESUMEN
La caña de azúcar (Saccharum spp.) es un cultivo de gran importancia económica que se ha propagado por cultivo de tejidos mediante organogénesis y embriogénesis somática. La presente investigación tuvo como objetivo determinar la variabilidad fenotípica en campo de plantas de caña de azúcar cv. ‘C87-51’ obtenidas mediante embriogénesis somática en medios de cultivo líquido. Fueron plantadas en campo plantas regeneradas a partir de embriones somáticos junto a plantas propagadas vía organogénesis y de estacas que se utilizaron como control. Las evaluaciones se efectuaron a los siete meses de la plantación en caña planta y primer retoño y las variables evaluadas fueron altura del tallo, diámetro del tallo, número de tallos por plantón, número de hojas activas por tallo y Brix. Además, se describieron características morfológicas. No se encontraron plantas fuera de tipo en las poblaciones evaluadas. Los resultados demostraron que la vía de regeneración de plantas influye significativamente en el desarrollo de las plantas en condiciones de campo. La propagación de plantas de caña de azúcar cv. ‘C87-51’ por embriogénesis somática en medio de cultivo líquido solo induce variaciones fenotípicas en campo asociadas al rejuvenecimiento in vitro similares a las referidas previamente para plantas obtenidas por organogénesis y por tanto puede ser empleada como un método de propagación masiva de plantas.
Palabras clave: biorreactor, caña de azúcar, embrión somático, variación somaclonal
ABSTRACT
Sugarcane (Saccharum spp.) is a crop of great economic importance that has been propagated by tissue culture through organogenesis and somatic embryogenesis. The present research had as objective to determine the phenotypic variability in the field of sugar cane cv. 'C87-51' plants obtained by somatic embryogenesis in liquid culture media. Plants regenerated from somatic embryos were planted in the field next to plants propagated via organogenesis and from cuttings that were used as control. The evaluations were carried out seven months after planting in cane plant and first shoot and the variables evaluated were stem height, stem diameter, number of stems per seedlings, number of active leaves per stem and Brix. Besides, morphological characteristics were described. Plants out of type were not found in the evaluated populations. The results demonstrated that the plant regeneration pathway significantly influences the development of plants under field conditions. The propagation of sugarcane plants cv. 'C87-51' by somatic embryogenesis in liquid culture medium only induces phenotypic changes in field associated with in vitro rejuvenation similar to those previously reported for plants obtained by organogenesis. Therefore, it can be used as a method of mass propagation of plants.
Keywords: bioreactor, somatic embryos, somaclonal variation, sugarcane
INTRODUCCIÓN
Para cada sistema de regeneración de plantas que se desarrolle es necesario validar la respuesta en campo de las plantas. Este paso debe ser realizado independientemente del uso final que se les dé (propagación o mejora genética). En caña de azúcar (Saccharum spp.) existe poca información sobre la respuesta en campo de plantas obtenidas a partir de la germinación de embriones somáticos. A pesar de ello la embriogénesis somática es, potencialmente, un método eficiente de regeneración para la clonación y la transformación genética de la caña de azúcar (Layla, 2003).
Cuando un sistema de regeneración de plantas favorece la aparición de variantes somaclonales se limita seriamente la utilidad de los protocolos para la propagación in vitro. Las investigaciones desarrolladas describen que la aparición de variaciones durante la propagación in vitro depende, principalmente, del genotipo, la naturaleza quimérica del explante utilizado, las condiciones de cultivo, el mantenimiento del cultivo y el tiempo in vitro del material vegetal (Lavanya et al., 2016).
La adición en los medios de cultivo de una mayor concentración de reguladores del crecimiento y subcultivos prolongados atenta, muy especialmente, contra la fidelidad genética de las plantas regeneradas ya que pueden causar anormalidades cromosómicas que dan lugar a la producción de plantas fuera de tipo (Suprasanna et al., 2011).
Para sistemas de regeneración de plantas que utilizan la embriogénesis somática se suman riesgos específicos para la aparición de plantas fuera de tipo, entre ellos el origen unicelular de los embriones somáticos y el uso frecuente de auxinas fuertes como el ácido 2,4 diclorofenoxiacético (2,4-D). El desarrollo de la embriogénesis somática puede efectuarse utilizando medios de cultivo semisólidos o líquidos, estos últimos dan la posibilidad de aplicar las experiencias obtenidas en agitadores orbitales a escala de biorreactores. Ello hace más competitivos los protocolos pues potencialmente son más eficientes y automatizables.
Varios autores han evaluado en campo poblaciones de plantas de caña de azúcar obtenidas por cultivo in vitro vía organogénesis (Lal, 1996; Lorenzo et al., 2001; Saini et al., 2004; Sood et al., 2006; Devarumath et al., 2007; Doule et al., 2008; Sandhu et al., 2008; Sobhakumari, 2012). Sin embargo, existen pocas referencias sobre la evaluación de la respuesta en campo de plantas obtenidas vía embriogénesis somática (en medios de cultivo semisólidos) con fines de propagación (Jiménez, 1995, Nieves et al., 2003). Aunque en este cultivo se han empleado medios de cultivo líquido para el desarrollo de la embriogénesis somática (Ahloowalia y Maretzki, 1983) no se encontraron referencias sobre evaluaciones realizadas en campo a plantas obtenidas en estas condiciones de cultivo.
El objetivo del presente trabajo fue determinar la variabilidad fenotípica en campo de plantas de caña de azúcar cv. ‘C87-51’ regeneradas vía embriogénesis somática en medio de cultivo líquido.
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon plantas in vitro de caña de azúcar cv. ‘C87-51’ regeneradas vía embriogénesis somática según el protocolo propuesto por Freire-Seijo et al. (2006) que describe la producción de embriones somáticos con el empleo de agitador orbital y biorreactores. En el estudio fueron incluidas, además, plantas in vitro en fase de enraizamiento propagadas por organogénesis (Jiménez, 1995) y estacas, de plantas cultivadas en campo, con tres yemas (método de propagación a escala productiva) como controles.
A condiciones ex vitro se transfirieron plantas in vitro regeneradas por embriogénesis somática (ES) a partir de la germinación de embriones somáticos obtenidos en agitador orbital y en biorreactor así como plantas in vitro propagadas por organogénesis. En todos los casos 2000 plantas.
La casa de cultivo estaba cubierta con malla de plástico, que redujo la intensidad luminosa en un 70%. Se utilizaron cajas de polipropileno con 70 orificios y un sustrato formado por una mezcla de materia orgánica y zeolita (3:1). En cada orificio se colocó una planta. El riego se realizó con microaspersores a través del sistema Microjet con una frecuencia de 2 minutos y seis irrigaciones por día. Con esta frecuencia, se garantizó una humedad relativa entre el 85-90%. Las plantas se mantuvieron en estas condiciones durante 45 días previos a su plantación en campo.
Variabilidad fenotípica en campo
Los experimentos de campo fueron ejecutados en la Estación Experimental Pedro Lantigua del Municipio de Remedios, Provincia Villa Clara, en suelo ferralítico rojo y con condiciones de secano.
Se realizaron dos ensayos y en ambos se empleó un diseño de bloques al azar con cuatro réplicas por tratamiento. Las parcelas tenían 7.5 m de largo y cinco surcos cada una. La densidad de plantación cuando se emplearon estacas fue de 12 yemas por metro lineal con estacas de tres yemas. En el caso de las plantas procedentes de cultivo in vitro (organogénesis y embriogénesis somática) se plantaron a una distancia de 0.50 m (15 plantas por surco) y se le realizaron riegos de supervivencia dos veces por semana durante el primer mes.
Se aplicó fertilización con fórmula completa en el momento de la siembra 75 kg ha-1 de nitrógeno, 50 kg ha-1 de P2O5 y 50 kg ha-1 de K2O y nitrógeno (75 kg) en forma de urea a los tres meses de la plantación.
En el primer ensayo se compararon plantas regeneradas por embriogénesis somática a partir de la germinación de embriones somáticos obtenidos en agitador orbital, con plantas propagadas por organogénesis y estacas.
En el segundo ensayo se compararon plantas regeneradas por embriogénesis somática a partir de la germinación de embriones somáticos obtenidos en biorreactor, con plantas propagadas por organogénesis y estacas. La plantación se realizó en el mes de marzo.
Las evaluaciones se efectuaron a los siete meses de la plantación en caña planta y primer retoño y las variables evaluadas a 90 plantas de cada bloque seleccionadas al azar fueron: altura del tallo (cm), diámetro del tallo (mm), número de tallos por plantón, número de hojas activas (hojas completamente extendidas) por tallo y Brix (%).
En ambos ensayos en las poblaciones de plantas se describieron variables morfológicas que caracterizan el cv. ‘C87-51’ según Bernal et al. (1999) tales como: color del tallo, forma de la yema, presencia de pelos, forma del dewlap (la última unión limbo-vaina visible), forma de la aurícula, forma del entrenudo y hábito de crecimiento.
Análisis estadístico
Los datos se procesaron mediante el con el paquete computacional StatGraphics versión 5.0 sobre Windows. Se comprobaron los supuestos de distribución normal y homogeneidad de varianzas. Para la comparación de las medias se utilizó la prueba de Duncan para p≤0.05.
RESULTADOS Y DISCUSIÓN
En los dos ensayos realizados no se encontraron plantas fuera de tipo en las poblaciones evaluadas.
Las plantas obtenidas a partir de la germinación de embriones somáticos producidos en agitador orbital presentaron hábito de crecimiento similar a las plantas regeneradas vía organogénesis, con aumento del número de tallos y disminución en el diámetro, respecto a las plantas de estacas. Además, no se encontraron diferencias en cuanto al Brix (19.5% – 19.8%), ni en el número de hojas activas por planta (9.23 – 9.85) (Tabla 1).
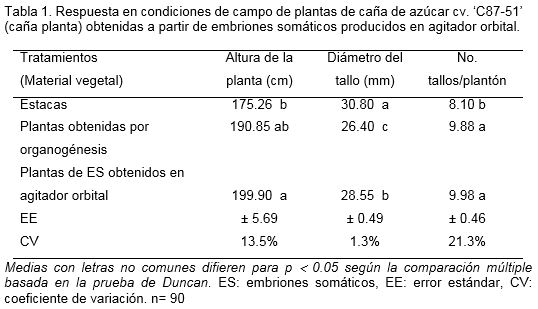
En el primer retoño no se encontraron diferencias significativas entre el diámetro del tallo y la altura de las plantas para los tres tipos de material vegetal empleados. Sin embargo, se mantuvo elevado el número de tallos por plantón en las plantas provenientes de embriones somáticos obtenidos en agitador orbital con diferencias significativas con respecto a los demás tratamientos (Tabla 2).
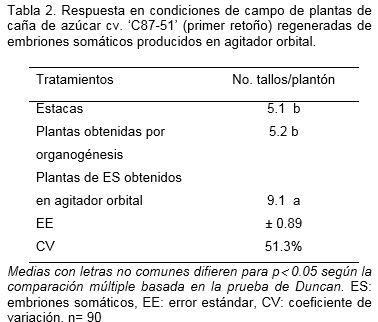
Los resultados indicaron que el sistema de regeneración utilizado tuvo influencia sobre el desempeño de las plantas en campo, es por ello que todo sistema desarrollado para el mejoramiento genético o la propagación de plantas debe concluir en evaluaciones de campo del material vegetal, donde se consideren indicadores morfo-fisiológicos (Pérez, 1998).En las plantas provenientes del cultivo de tejidos, tanto por la vía de embriogénesis somática como por organogénesis, se evidenció el efecto del rejuvenecimiento provocado por el cultivo in vitro.
Se observó un aumento del número de tallos por plantón y disminución de su diámetro. Los resultados mostrados coinciden con lo descrito por Cuenya et al. (2007) al comparar semilla de caña de azúcar micropropagada y semilla convencional o semilla tratada con calor, donde señalaron que la semilla micropropagada presentaba un incremento en el número de tallos y crecimiento y como consecuencia mostraron mayor rendimiento. De igual forma, Wendling et al. (2014) en su investigación respecto a las plantas propagadas in vitro indicaron que como resultado del rejuvenecimiento o cambios temporales, encontraron variaciones tales como incremento en el número de tallos o ramas, retardo en la floración, aumento de la susceptibilidad a una enfermedad y otras características, las cuales influyeron en el rendimiento en el campo.
El contenido de Brix (18.7% – 18.2%) y el número de hojas activas por planta (4.2 – 4.6) no mostraron diferencias entre los tratamientos en el primer retoño. Autores como Carrillo-Castañeda et al. (2002) también han concentrado sus investigaciones en comparar los cambios morfológicos y fisiológicos provocados por el cultivo de callos y yemas axilares en tres variedades de caña de azúcar y plantearon que no hubo variaciones genéticas discernibles y que la variación somaclonal y clonal fue de la misma magnitud independientemente de la variedad.
En el segundo experimento se corroboró la influencia del sistema de regeneración sobre las variables evaluadas. Se observó que a pesar de que el cultivo in vitro en general provocó incrementos en el número de tallos, las plantas procedentes de embriones somáticos producidos en biorreactor, presentaron diferencias significativas respecto a las plantas regeneradas vía organogénesis y el control de estacas (Tabla 3), lo que reafirmó que el sistema de regeneración utilizado también tuvo influencia sobre la respuesta de las plantas en campo.
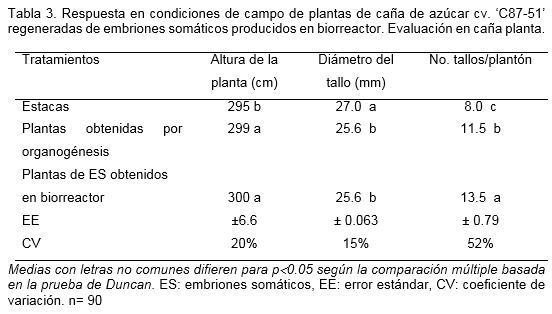
El incremento en el número de tallos en los dos tratamientos de plantas obtenidas in vitro se correspondió con una disminución en el diámetro en comparación con el control de estacas. El Brix (21.6% – 22.0%) y el número de hojas activas continuaron manifestándose como caracteres estables y no mostraron diferencias entre los tratamientos.
Estos resultados coinciden con los informados por otros autores que en caña de azúcar han observado que las principales alteraciones relacionadas con el rendimiento se relacionaron con el incremento en el número de tallos y aumento del vigor de las plantas (Jiménez, 1995; Martínez-Montero et al., 2002; Cuenya et al., 2007; Sandhu et al., 2008; Wendling et al., 2014).
En el primer retoño, las plantas obtenidas por organogénesis disminuyeron el número de tallos por plantón. Sin embargo, las plantas regeneradas vía embriogénesis somática mantuvieron un elevado número de tallos (Tabla 4). Similares resultados se obtuvieron en el experimento anterior en el tratamiento con plantas regeneradas de embriones somáticos formados en agitador orbital. El Brix se mantuvo entre 25.8% y 26.4%, sin diferencias significativas entre los tratamientos.
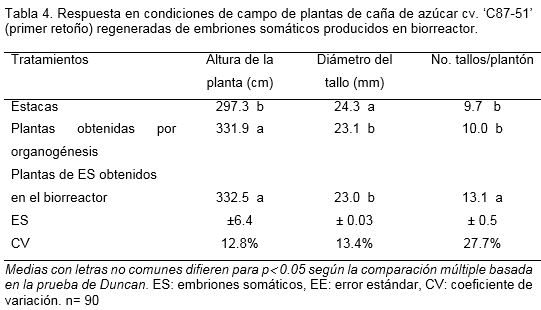
En las plantas obtenidas a partir de la germinación de embriones somáticos y por organogénesis se observó influencia del cultivo in vitro que provocó la disminución del grosor del tallo y aumento del número de tallos por plantón, resultado que se repite en ambos experimentos. La vía de regeneración tiene un efecto directo sobre la variabilidad somaclonal. Al respecto, Krishna et al. (2016) clasificó los sistemas de regeneración de forma ascendente, en cuanto a la variabilidad, de la forma siguiente: plantas propagadas in vitro vía yemas axilares (organogénesis), yemas adventicias, callos organogénicos y embriogénicos, suspensiones celulares y protoplastos. Todo ello está muy relacionado con el grado de desdiferenciación, las distintas vías de regeneración y los métodos de cultivo (Pérez, 1998).
Los caracteres cualitativos evaluados en las plantas no mostraron diferencias entre los tratamientos analizados y coincidieron con las características descritas para ‘C87-51’ por Bernal et al. (1999), que fueron las siguientes:
Color del tallo: morado con visos amarillentos
Forma de la yema: obovada y ovada
Presencia de pelos: pocos
Forma del dewlap: triangular y color verdoso
Forma de la aurícula: interna falcada y externa dentoide
Forma del entrenudo: cilíndrica, con banda cerosa abundante
Hábito de crecimiento: erecto
Los resultados demostraron que la vía de regeneración de plantas influye significativamente en el desarrollo de las plantas en condiciones de campo. Las variaciones fenotípicas observadas se relacionaron con el rejuvenecimiento que induce el cultivo in vitro. En este sentido, refuerzan lo planteado por Chowdhurry y Vasil (1993) quienes plantearon que, a pesar del origen unicelular de la embriogénesis somática, el uso de cultivos embriogénicos es menos propenso a la aparición de cambios genéticos debido al proceso de selección de las células durante la formación de los embriones somáticos. En otras especies tales como Elais quineensis Jacq. (palma de aceite) (Merkle et al., 1995), Theobroma cacao L. (cacao) (Maximova et al., 2008) y cafeto (Coffea spp.) (Etienne et al., 2016) se han realizado estudios en campo donde se ha demostrado la estabilidad genética de plantas obtenidas por embriogénesis somática.
A pesar de ello, de forma general, se continúa señalando la embriogénesis somática como probable causante de variaciones genéticas y cambios epigenéticos. El 2,4-D, la fuente del explante, el genotipo empleado y el tiempo de permanencia in vitro son algunos de los factores que influyen en la aparición de variaciones genéticas y que deben ser atendidos para desarrollar sistemas de regeneración de plantas con fidelidad genética (Moore et al., 2013).
CONCLUSIONES
La propagación de plantas de caña de azúcar cv. ‘C87-51’ por embriogénesis somática en medio de cultivo líquido solo induce variaciones fenotípicas en campo asociadas al rejuvenecimiento in vitro similares a las referidas previamente para plantas obtenidas por organogénesis y por tanto puede ser empleada como un método de propagación masiva de plantas.
REFERENCIAS
Ahloowalia BS, Maretzki A (1983) Plant regeneration via somatic embryogenesis in sugarcane. Plant Cell Rep 2(1): 21-5; doi: 10.1007/BF00269228
Bernal N, Morales F, Galvez Y, Jorge I (1999) Variedades de caña de azúcar, Uso y manejo. Publicaciones Imago, Ciudad de La Habana; ISBN: 959-7051-10-9
Brar DS, Jain SM (1998) Somaclonal variation: mechanism and applications in crop improvement. En: Jain SM, Brar DS, Ahloowalia BS (eds) Somaclonal variation and induced mutations in crop improvement, pp.15-36. Springer Netherlands, Ámsterdam; doi: 10.1007/978-94-015-9125-6
Carrillo-Castañeda G, Guillén A, Cárdenas S (2002) Differentiation of sugarcane cultivars for green energy using microscopy and tissue culture. Biotecnología Aplicada 19 (1): 30-33
Chowdhurry M, Vasil I (1993) Molecular analysis of plants regenerated from embryogenic cultures of hybrid sugarcane cultivars (Saccharum spp.). Theor Appl Genet 86 (2): 181-188; doi: 10.1007/BF00222077
Cuenya M, Garcia M, Díaz Romero C, Romero E (2007) Efectos de la calidad de la semilla en los componentes del rendimiento cultural en dos variedades de caña de azúcar. Revista industrial agrícola de Tucumán 84 (1): 9-14
Devarumath, RM, Doule RB, Kawar PG, Naikebawane SB, Nerkar YS (2007) Field performance and RAPD analysis to evaluate genetic fidelity of tissue culture raised plants vis-a`-vis conventional setts derived plants of sugarcane. Sugar Tech 9(1): 17–22
Doule RB, Kawar PG, Nerkar YS, Devarumath RM (2008) Field performance of promising somaclonal variants and RAPD analysis to assess genetic variation in sugarcane (Saccharum spp.). Indian Journal of Genetic and Plant Breeding 68(3): 301–306
Etienne H, Bertrand B, Dechamp E, Maurel P, Georget F (2016) Are genetic and epigenetic instabilities of plant embryogenic cells a fatality? The experience of coffee somatic embryogenesis. Human Genet Embryol 6 (1): 136; doi: 10.4172/2161-0436.1000136
Freire-Seijo M, Kosky G, Herrera IO, Reyes M (2006) Formación de callos y establecimiento de suspensiones celulares embriogénicas de caña de azúcar a partir de segmentos de hojas de plantas in vitro. Biotecnología vegetal 6 (1): 51-57
Jiménez E (1995) Propagación in vitro de la caña de azúcar (Saccharum spp. híbrido). Tesis para optar por el grado de Doctor en Ciencias Agrícolas. UCLV, Santa Clara, Cuba
Krishna H, Alizadeh M, Singh D, Singh U, Chauhan N, Eftekhari M, Sadh R K (2016) Somaclonal variations and their applications in horticultural crops improvement. 3 Biotech 6 (1): 54; doi: 10.1007/s13205-016-0389-7
Lal Nand (1996) Comparative field performance of micropropagated plant of sugarcane. Indian Journal of Sugarcane Technology 11(1): 29-31
Lavanya AR, Muthukumar M, Muthukrishnan S, Kumaresan V, Senthil T, Kumar M, Vijaya V, Rao MV (2016) Effect of plant growth regulators and additives on indirect organogenesis of Simarouba glauca. En: Anis M, Ahmad N (eds) Plant Tissue Culture: propagation, conservation and crop improvement, pp. 71-82, Springer, Dordrecht; ISBN: 978-981-10-1916-6
Layla AZ (2003) Sugar cane production. Patent EP1007629 B1, 24/09/2003
Lorenzo JC, Ojeda E, Espinosa A, Borroto C (2001) Field performance of temporary immersion bioreactor derived sugarcane plant. Biol Plant 37 (6): 803-806; doi: 10.1007/s11627-001-0133-8
Maximova SN, Young A, Pishak S, Guiltinan Mark J (2008) Field performance of Theobroma cacao L. plants propagated via somatic embryogenesis. In Vitro Cell Dev Biol-Plant (2008) 44: 487; doi: 10.1007/s11627-008-9130-5
Merkle SA, Parrot WA, Flinn BS (1995) Morphogenic aspects of somatic embryogenesis. En: Thorpe TA (ed) In vitro embryogenesis in plants, pp. 155–203. Kluwer Academic Publishers, Dordrecht; doi: 10.1007-978-94-011-0485-2_5-1
Moore LS, Stolovicki E, Braun E (2013) Population dynamics of metastable growth-rate phenotypes. PLoS ONE 8(12): 1671; doi: 10.1371/journal.pone.0081671
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant 15: 473–497
Nieves N, Zambrano Y, Tapia R, Cid M, Pina D, Castillo R (2003) Field performance of artificial seed-derived sugarcane plants. Plant Cell and Organ Culture 75: 279–282
Pérez J (1998) Variación somaclonal. En: Pérez Ponce JN (ed) Propagación y mejora genética de plantas por biotecnologia, pp.105-121. IBP, Santa Clara; ISBN: 959-7122-02-2
Saini Navinder, Saini ML, Jain RK (2004) Large-scale production, field performance and RAPD analysis of micropropagatd sugarcane plants. Indian J Genet 64(2): 102-107
Sandhu S, Gosal S, Thind K, Uppal S, Sharma B, Meeta M, Singh K, Cheema G (2008) Field performance of micropropagated plants and potential of seed cane for stalk yield and quality in sugarcane. Sugar Tech 11: 34–38
Sobhakumari V P (2012) Assessment of somaclonal variation in sugarcane. African Journal of Biotechnology 11(87): 15303-15309; doi: 10.5897/AJB12.1627
Sood Neeru, Gupta Piyush K, Srivastava RK, Gosal SS (2006) Comparative studies on field performance of micropropagated and conventionally propagated sugarcane plants. Plant Tissue Cult. & Biotech 16(1): 25-29; doi: 10.3329/ptcb.v16i1.1102
Suprasanna P, Patade VY, Desai NS, Devarumath RM, Kawar PG, Pagariya MC, Ganapathi A, Manickavasagam M, Babu KH (2011) Biotechnological Developments in sugarcane improvement: an Overview. Sugar Tech 13 (4): 13 (4); 322-335; doi: 10.1007/s12355-011-0103-3
Suprasanna, P, Desai NS, Choudhari Rupali S, Bapat VA (2007) RAPD markers for assessing culture induced variation in somatic embryogenesis-derived plants of sugarcane (Saccharum officinarum L.). Sugar Tech 9(4): 284–289
Wendling I, Trueman SJ, Xavier A (2014) Maturation and related aspects in clonal forestry—part II: reinvigoration, rejuvenation and juvenility maintenance. New Forests 45: 473-486; doi: 10.1007/s11056-014-9415-y
Recibido: 08-03-2016
Aceptado: 19-05-2016
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
