Artículo original
Biotecnología Vegetal Vol. 16, No. 4: 223 - 230, octubre - diciembre, 2016
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Caracterización bioquímica e histológica de plantas aclimatizadas in vitro de Agave fourcroydes Lem.
Biochemical and histological characterization of Agave fourcroydes Lem. plants in vitro acclimatized
Yunel Pérez Hernández, Maryla Sosa del Castillo, Leticia Fuentes Alfonso, Yasmary Rubio Fontanill, Aymara L Valdivia Ávila, Jovana Pérez Ramos
Facultad de Ciencias Agropecuarias, Universidad de Matanzas. Autopista a Varadero km 3/2. Matanzas. Matanzas. Cuba. CP 44740. e-mail: yunel.perez@umcc.cu
RESUMEN
El henequén (Agave fourcroydes Lem.) constituye un cultivo representativo de la provincia de Matanzas, Cuba, el cual ha sido explotado extensamente por la calidad de sus fibras. El presente trabajo tuvo como objetivo caracterizar desde el punto de vista bioquímico e histológico plantas de henequén cv. ‘Sac Ki’ aclimatizadas in vitro. Los indicadores bioquímicos analizados fueron concentración de fenoles solubles, carbohidratos solubles totales, azúcares reductores, proteínas solubles y clorofilas totales, así como los contenidos relativos de flavonoides, terpernos y antocianinas. Además, se realizó un análisis histológico de la epidermis y los resultados fueron comparados con plantas de un mes en medio de cultivo de enraizamiento. Las plantas aclimatizadas in vitro fueron transferidas posteriormente a condiciones ex vitro. Los contenidos de carbohidratos solubles totales, azúcares reductores y clorofilas disminuyeron, mientras que los niveles de fenoles solubles, proteínas y metabolitos secundarios fueron superiores en relación con las plantas in vitro enraizadas durante 30 días. La epidermis de las plantas aclimatizadas in vitro mostró un mayor desarrollo del aparato estomático que pudo incidir positivamente en la aclimatización ex vitro, donde se obtuvo un porcentaje de supervivencia del 87% y una reducción del tiempo de aclimatización.
Palabras clave: azúcares reductores, clorofila, fenoles, henequén
ABSTRACT
Henequen (Agave fourcroydes Lem.) is a representative crop of the province of Matanzas, Cuba, which has been exploited extensively for the quality of its fibers. The present work aimed to characterize from the biochemical and histological point of view henequen plants cv. 'Sac Ki' in vitro acclimatized. The biochemical indicators analyzed were concentration of soluble phenols, total soluble carbohydrates, reducing sugars, soluble proteins and total chlorophylls, as well as the relative contents of flavonoids, terpins and anthocyanins. In addition, a histological analysis of the epidermis was performed and the results were compared with plants of one month in rooting culture medium. In vitro acclimatized plants were subsequently transferred to the ex vitro conditions. The contents of total soluble carbohydrates, reducing sugars and chlorophylls decreased, whereas the levels of soluble phenols, proteins and secondary metabolites were higher in relation to in vitro plants rooted for 30 days. The epidermis of the in vitro acclimatized plants showed a greater development of the stomatal apparatus that could positively affect the ex vitro acclimatization, where a survival rate of 87% and a reduction of the acclimatization time were obtained.
Keywords: chlorophyll, henequen, phenol, reducing sugar
INTRODUCCIÓN
El henequén (Agave fourcroydes Lem.) es una especie que ha sido cultivada en Cuba desde principios del siglo XIX para la obtención de fibras, de uso en la elaboración de sogas, cordeles, cestos, alfombras, bolsas y prendas de vestir, entre otros productos (González et al., 2004). Al igual que otros agaves, también ha sido utilizada en la fabricación de bebidas alcohólicas y posee potencialidades en la industria biofarmacéutica, debido a los diferentes metabolitos que se encuentran en las hojas y otras partes de la planta (García-Curbelo et al., 2015).
Como una vía para recuperar las plantaciones henequeneras de la provincia de Matanzas, en el Centro de Estudios Biotecnológicos de la Universidad de Matanzas se obtuvo una metodología para la micropropagación de Agave fourcroydes Lem. (González, 2001; Abreu, 2009). La aclimatización de plantas constituye una etapa esencial al final de este proceso, ya que las condiciones in vitro inducen cambios anatómicos y fisiológicos notables en las plantas que provocan una elevada tasa de transpiración (Pérez-Santiago et al., 2014). El control de factores como el riego y la iluminación tienen una función esencial para la adaptación de las plántulas al ambiente ex vitro y garantizar el tránsito hacia un estado autotrófico (Abreu, 2009).
Varios autores han destacado la importancia de realizar pretratamientos de aclimatización in vitro para incrementar la calidad fisiológica de las plantas previo a su transferencia a condiciones ex vitro (Ziv, 1995; Kadlecek et al., 2001; Alvarez et al., 2012, Posada et al., 2016).
Existen diferentes estrategias desde las fases in vitro para aumentar el porcentaje de supervivencia y calidad de las plántulas durante la aclimatización ex vitro. Algunas han consistido en suministrar una ventilación forzada a los frascos para disminuir la tasa transpiratoria en la fase de aclimatización (Aguilar et al., 2000), reducir el potencial hídrico del medio de cultivo mediante el uso de sustancias osmóticamente activas como el polietilenglicol (Mahdia y Abd-Alla, 2010), incremento de la iluminación y ventilación (Álvarez et al., 2012), entre otras.
Estos tratamientos favorecen la producción de ceras epicuticulares y con ello la preadaptación de las plantas obtenidas in vitro. Sin embargo, la disminución del potencial hídrico puede inducir cambios bioquímicos significativos en las plantas como el estrés oxidativo, en el cual las especies reactivas del oxígeno (EROs) puede provocar cambios estructurales y funcionales a macromoléculas importantes como proteínas, ácido desoxirribonucleico, lípidos y a estructuras membranosas donde ocurren numerosas reacciones metabólicas como la fotosíntesis y la respiración (Xu et al., 2011; Heidari et al., 2011; Sabra et al., 2012).
Las plantas pueden responder frente a condiciones de estrés hídrico con diversos mecanismos. La eliminación de las EROs constituye una forma de atenuar el impacto de estos radicales reactivos sobre los componentes celulares. El sistema antioxidante de las plantas está integrado tanto por compuestos enzimáticos como de naturaleza no proteica. Entre las enzimas antioxidantes se encuentran superóxido dismutasa, catalasas y peroxidasas (Haghighi et al., 2014); mientras que en la vía no enzimática participan diferentes compuestos polifenólicos (flavononas, antocianinas), carotenoides (α-tocoferol, β-caroteno), ácido ascórbico, glutatión reducido, entre otros (Mervat y Dawood, 2014).
El alargamiento de la fase de enraizamiento sin reemplazo del medio de cultivo para pudiera constituirse en una estrategia para aclimatizar in vitro plantas de henequén. Ello podría contribuir a mejorar la calidad fisiológica de las plantas previo a su transferencia a la fase de aclimatización ex vitro, que garantice una supervivencia alta con menores exigencias de humedad e iluminación. Sin embargo, la disminución paulatina del potencial hídrico en el medio de cultivo puede conllevar a cambios bioquímicos y fisiológicos importantes. Por ello, el presente trabajo tuvo como objetivo caracterizar desde el punto de vista bioquímico e histológico plantas de henequén aclimatizadas in vitro.
MATERIALES Y MÉTODOS
Material vegetal
Se utilizaron dos grupos de plantas in vitro de A. fourcroydes cultivar ‘Sac Ki’ propagadas según lo establecido por González (2001). Un grupo permaneció en un medio de cultivo MS (Murashige y Skoog, 1962) para enraizamiento un mes y el otro grupo durante cinco meses para su aclimatización in vitro. Las plantas in vitro se mantuvieron en un cuarto de crecimiento a 25 ± 2ºC, con un fotoperíodo de 16 h de luz (35 µmol m-2 s-1).
Para el análisis de los indicadores bioquímicos se utilizaron cinco plantas de cada grupo (tratamiento) con tres réplicas por cada uno y se determinó el contenido de clorofilas, carbohidratos solubles totales, azúcares reductores, fenoles solubles, flavonoides, terpenoides y antocianinas.
Contenido de clorofilas a, b y totales
Las hojas de las plantas in vitro (0.5 g) fueron trituradas en un mortero de porcelana con 5 ml de solución acuosa de etanol (BDH) al 96% como solvente para la extracción de los pigmentos. Se emplearon las ecuaciones propuestas por Wintermans y de Mots (1965) para el cálculo de la concentración de clorofilas.
Ca (mg ml-1) = 13.95 (A665) -6.68 (A644)
Cb (mg ml-1) =24.96 (A644) -7.32 (A665)
Ca = concentración de clorofila a
Cb = concentración de clorofila b
Clorofila total: Ca+b (mg ml-1) = (20.2 A649)+(8.02 A665).
Contenido de carbohidratos solubles totales
El contenido de carbohidratos solubles (mg ml-1) totales se determinó en 0.5 g de hojas de plantas in vitro homogenizadas en 3 ml solución tampón de fosfato de sodio 20 mmol l-1, pH=7.0. Se aplicó el método del fenol–ácido sulfúrico con D-glucosa (Sigma) como azúcar patrón (Dubois et al., 1956). La absorbancia se midió a una longitud de onda de 490 nm.
Contenido de azúcares reductores
El contenido de azúcares (mg ml-1) se determinó por el método del ácido dinitrosalisílico con D-glucosa (Sigma) como azúcar patrón, en 0.5 g de hojas de plantas in vitro homogenizadas en 3 ml solución tampón de fosfato de sodio 20 mmol l-1, pH=7.0 (Miller, 1959). La absorbancia se midió a una longitud de onda de 456 nm.
Contenido de proteínas solubles totales
El contenido de proteínas solubles totales (mg ml-1) se determinó en 0.5 g de hojas de in vitro homogenizadas en 3 ml solución tampón de fosfato de sodio 20 mmol l-1, por el método descrito por Lowry et al. (1951). Se utilizó albúmina de suero bovino (ASB) como patrón y la absorbancia se determinó a una longitud de onda de 750 nm.
Contenido de fenoles solubles
La extracción de los fenoles solubles se realizó en 10 volúmenes de metanol. Las muestras (100 mg) fueron homogenizadas y centrifugadas a 10 000 rpm (Gurr et al., 1992). Para la determinación de la concentración de fenoles (mg g-1 masa fresca) se utilizó el ácido clorogénico (0.05 mol l-1) como patrón y los valores de absorbancia fueron determinados a 725 nm.
Contenido de flavonoides, terpenoides y antocianinas
El contenido relativo de flavonoides, terpenoides y antocianinas se determinó cualitativamente en 100 mg de tejido foliar fresco por plántula, los cuales fueron triturados en etanol al 96%. Los extractos se centrifugaron a 10 000 rpm durante 10 min e inmediatamente se realizaron las determinaciones fitoquímicas según la metodología descrita por Chigodi et al. (2013):
Prueba para flavonoides: se adicionó 1 ml de NaOH 0.1 mol l-1 a 100 mg de extracto y posteriormente se adicionó igual volumen de HCl 0.1 mol l-1. La presencia de un color amarillo en la solución que desaparece indicó la presencia de flavonoides.
Prueba para terpenoides: se mezclaron 100 mg de extracto con 1 ml de cloroformo y a continuación se adicionaron 2 ml de H2SO4 concentrado. Una coloración rojo-pardo en la interfase indicó la presencia de terpenoides.
Prueba para antocianinas: se mezclaron 100 mg de extracto con 3 ml de agua destilada y posteriormente se adicionó 1 ml de HCl 2 mol l-1 y solución amoniacal 2 mol l-1 a 1 ml de la mezcla anterior. La presencia de un color rosado-rojo que se torna azul-violeta indicó la presencia de antocianinas.
Se realizaron tres mediciones de las absorbancias de cada vial en un colorímetro para la determinación de clorofilas, carbohidratos solubles totales, azúcares reductores, proteínas solubles totales y fenoles solubles. En el caso del contenido de flavonoides, terpenos y antocianinas se realizó de manera cualitativa a través del sistema no paramétrico de cruces (+++ = contenido alto, ++ = moderado, + = bajo, - = ausencia).
Además, se realizó un estudio histológico y se describieron los cambios de la epidermis en las plántulas. Para ello, se realizaron desprendimientos epidérmicos por la técnica descrita por Rodés y Collazo (2006). Se seleccionaron porciones de aproximadamente 1.5 de la epidermis abaxial y se utilizó un microscopio óptico (NOVEL) para la observación a 100 y 400x. Finalmente se tomaron microfotografías de las muestras obtenidas.
Para la transferencia a condiciones ex vitro, las plantas se lavaron con agua corriente para eliminar el agar y se procedió a una inmersión en CuSO4 (200 µmol l-1) durante 60 minutos para el control de hongos. Posteriormente se plantaron en bandejas de polieturano con un sustrato compuesto por pulpa de henequén descompuesta y gravilla de diámetro promedio igual a 2 mm en una relación 3:1 (v/v) y una densidad de 1.73 g cm-3. La temperatura osciló entre 24 y 30ºC de acuerdo con las condiciones ambientales en el mes de abril de 2015.
La aclimatización ex vitro de las plantas se desarrolló en casa de cultivo con manejo de la intensidad luminosa, a través de diferentes condiciones creadas con el empleo de capas de malla Sarán de color negro. Durante los primeros 15 días se redujo la intensidad luminosa al 70% y en las últimas dos semanas las plántulas fueron transferidas a un área con una reducción del 30%. El riego se realizó mediante un aspersor manual con intervalos de una hora en el período comprendido de 10:00 am a 3:00 pm, con lo cual se proporcionó una humedad relativa del 70% durante los primeros 15 días y del 60% en los restantes 15 días. El control se realizó con un hidrotermógrafo tipo VEP.
Se cuantificó el número de plantas vivas y se calculó el porcentaje de supervivencia de las plantas a los 30 días de cultivo.
Análisis estadístico
Los datos fueron procesados con el paquete Statgraphic plus 5.1 sobre Windows. Se determinó el ajuste a una distribución normal mediante la prueba de bondad de ajuste Kolmogorov-Smirnov y la homogeneidad de varianza mediante las pruebas de Bartlett (Sigarroa, 1985). Se realizó un ANOVA de clasificación simple para p≤0.05 y p≤0.01.
RESULTADOS Y DISCUSIÓN
La caracterización bioquímica de las plantas indicó que el tiempo de enraizamiento in vitro influyó en los contenidos de los compuestos analizados (Tabla1). Se comprobó que hubo una disminución significativa en la concentración de clorofilas totales en las plantas enraizadas durante cinco meses con en comparación con las que permanecieron un mes en medio de cultivo de enraizamiento.

La disminución en los niveles de clorofilas puede estar asociada a una reducción en la biosíntesis de estos pigmentos o a un incremento de su degradación (Mehar et al., 2013). La disminución del potencial hídrico en el medio de cultivo pudo generar condiciones de estrés oxidativo debido a un aumento en la concentración de las especies reactivas del oxígeno (Gill y Tuteja, 2010; Krelavski et al., 2012). La acción de estos radicales reactivos como el anión hidroxilo, provoca la oxidación de clorofilas, proteínas y lípidos de membrana, lo cual genera inestabilidad en los complejos proteína-pigmentos presentes en los fotosistemas y las membranas tilacoidales donde tiene lugar la fotosíntesis (Achary et al., 2015; Del Rio, 2015). La degradación de los pigmentos clorofílicos también ha sido relacionada con un aumento de la actividad clorofilasa, que destruye estos pigmentos al separar el fitol del anillo tetrapirrólico en la molécula (Jamil et al., 2012). Otro factor que pudo incidir fue el agotamiento de magnesio en el medio, el cual es un constituyente estructural de las clorofilas (Barceló et al., 2002). Sin embargo, se requieren otros estudios para validar estas hipótesis en el cultivo de henequén.
De igual forma, las concentraciones de carbohidratos solubles totales y azúcares reductores fueron inferiores (Tabla 1). Esto puede estar asociado con el agotamiento de los nutrimentos en el medio de cultivo, en particular los azúcares, lo cual puede provocar que las plántulas utilicen las reservas energéticas de los tejidos en función del mantenimiento de la homeostasis celular. En condiciones de estrés por déficit de nutrientes, ocurre un aumento de la respiración de mantenimiento para generar energía metabólica en función de incrementar la síntesis de proteínas transportadoras de membrana y lograr un aumento en la absorción de los nutrientes (Barceló et al., 2002).
Sin embargo, las plantas con mayor tiempo de enraizamiento (aclimatizadas in vitro) mostraron un aumento significativo en el contenido de proteínas solubles totales, fenoles solubles, flavonoides, terpenos y antocianinas (Tabla 1). En relación con el contenido de proteínas solubles, estos resultados no coinciden con los obtenidos por Pant et al. (2014) quienes refirieron una disminución en la concentración de proteínas totales en plantas de Trigonella foenum-graecum L. var. ‘RMt-303’ sometidas a estrés hídrico.
El aumento en los niveles de proteínas observado en el presente trabajo puede estar relacionado con un mecanismo antiestrés para compensar la diferencia de potencial osmótico entre los tejidos de la planta y el medio de cultivo. De esta manera la planta puede reducir la pérdida de agua en un medio con déficit hídrico. Esto concuerda con otros autores quienes han encontrado un incremento en las concentraciones de proteínas y aminoácidos en plantas sometidas a estrés hídrico y salino (Sunita et al., 2014).
El aumento en la concentración de polifenoles solubles, flavonoides, terpenos y antocianinas pudo estar relacionado con una respuesta antioxidante de las plantas frente a condiciones de estrés. Los compuestos polifenólicos han sido descritos como agentes antioxidantes potentes, los cuales pueden contribuir a restablecer el estado redox celular (Zubair et al., 2013; Jain et al., 2015; Kendir y Köroğlu, 2015).
Los resultados coinciden con estudios realizados en Trifolium repens L., donde se observó un aumento en las concentraciones de flavonoles en condiciones de estrés por déficit hídrico (Hofmann et al., 2003). De manera similar, se observaron niveles constitutivamente elevados de flavonoles y antocianinas en diferentes variedades y ecotipos de esta especie, que mostraron una mayor tolerancia a sequía y a estrés por luz ultravioleta (Holfmann, 2003). Esto indica que niveles elevados de metabolitos fenilpropanoides pudieran tener una función protectora contra estreses abióticos en estas plantas (Dixon y Paiva, 1995).
De igual forma, el agotamiento de los nutrimentos y el ácido naftalenacético en el medio de cultivo de enraizamiento también pudieron incidir en los cambios bioquímicos observados, ya que éstos pueden atenuar los efectos fisiológicos de los estreses abióticos (Khan et al., 2012; Iqbal et al., 2013). El azufre por ejemplo, es un componente estructural de numerosos compuestos como el glutatión, cuya forma reducida constituye un agente antioxidante eficaz, especialmente en condiciones de estrés (Szalai et al., 2009).
El estudio histológico de la epidermis en las plantas mostró diferencias morfológicas (Figura 1). Los principales cambios con el tiempo de aclimatización in vitro estuvieron relacionados con un aumento del tamaño de las células epidérmicas típicas y un menor aguzamiento en los extremos, así como un incremento en el grosor de las paredes celulares y la presencia de estomas tetracíticos más desarrollados, lo que evidenció un mayor desarrollo del aparato estomático. Estos caracteres adaptativos se manifiestan normalmente en las plántulas durante la aclimatización ex vitro (González, 2001).
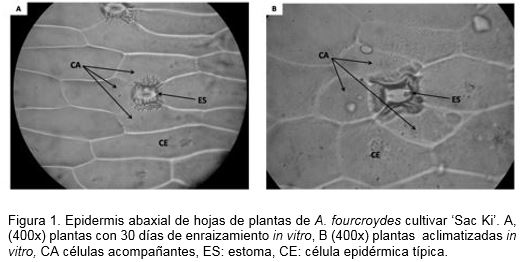
Las plantas aclimatizadas in vitro mostraron un porcentaje de supervivencia del 87% y alcanzaron las características fenotípicas deseadas para esta fase a los 25 días de cultivo. Estos resultados pueden estar relacionados con una preadaptación de las plantas durante un período de tiempo prolongado en la fase in vitro. Los cambios fisiológicos y bioquímicos desarrollados durante la aclimatización in vitro de las plantas pudieron contribuir a un mayor desarrollo y control del aparato estomático, del proceso de transpiración y del balance hídrico en las plántulas durante la etapa ex vitro. Otra característica anatómica que pudo influir en la supervivencia de las plantas fue el desarrollo de ceras epicuticulares que reducen la velocidad de transpiración (Hassanen y Khalil, 2013). Los valores de supervivencia fueron similares a los informados por Abreu (2009) en Agave fourcroydes Lem. con plantas in vitro de un mes en medio de cultivo de enraizamiento, pero utilizando una humedad relativa superior del 90%.
Las transformaciones fisiológicas como el desarrollo del aparato estomático en las plantas aclimatizadas in vitro, pudieron influir también en una reducción del tiempo de aclimatización de 25 días, en relación con los resultados informados por Abreu (2009) y Garriga et al. (2010) de 30 y 45 días respectivamente. Estos resultados pueden estar relacionados también con un incremento en el contenido de proteínas y otros compuestos antioxidantes como los fenoles y los pigmentos antociánicos y flavonoides que pudieron contribuir a atenuar el período de estrés a que están sometidas las plantas cuando se exponen al ambiente ex vitro lo que incidió en una diminución en el tiempo de aclimatización con un porcentaje de supervivencia elevado sin necesidad de humedad relativa tan alta. No obstante, es necesario realizar estudios posteriores para verificar si estas características se traducen en mayor calidad de las posturas para su traslado a la fase de vivero y un análisis económico de la factibilidad de este proceso.
CONCLUSIONES
La aclimatización in vitro de plantas de A. fourcroydes cultivar ‘Sac Ki’ provoca cambios bioquímicos y fisiológicos que se caracterizan por una disminución en los contenidos de clorofilas, carbohidratos solubles totales y azúcares reductores así como un aumento de la concentración de proteínas solubles totales y metabolitos secundarios como fenoles solubles, terpenos, flavonoides, antocianinas y un mayor desarrollo del aparato estomático en comparación con plantas que solo fueron enraizadas.
REFERENCIAS
Abreu EO (2009) Aclimatización de plántulas de henequén (Agave fourcroydes Lem.) y su evaluación en la etapa de previvero. Tesis presentada en opción al grado Científico de Doctor en Ciencias Agrícolas. Universidad de Matanzas, Matanzas, Cuba
Abreu E, González G, Ortiz R, Rodríguez P, Domech R, Garriga M (2007) Evaluación de vitroplantas de henequén (Agave fourcroydes Lem) durante la fase de aclimatización. Cultivos Tropicales 28 (1): 5-11
Achary VM, Reddy CS, Pandey P, Islam T, Kaul T, Reddy MK (2015) Glutathione reductase a unique enzyme: molecular cloning, expression and biochemical characterization from the stress adapted C4 plant, Pennisetum glaucum (L.). R Br Mol Biol Rep 42(5): 947-962; doi: 10.1007/s11033-014-3832-z
Aguilar ML, Espadas FL, Coello J, Maust BE, Trejo C, Robert ML, Santamaría JM (2000) The role of abscisic acid in controlling leaf water loss, survival and growth of micropropagated Tagetes erecta plants when transferred directly to the field. Journal of Experimental Botany 51 (352): 1861-1866
Barceló J, Nicolás G, Sabater B, Sánchez R (2002) Fisiología Vegetal. Editorial Félix Varela, La Habana
Chigodi MO, Samoei DK, Muthangya M (2013) Phytochemical screening of Agave sisalana Perrine leaves (waste). International Journal of Applied Biology and Pharmaceutical Technology 4 (4): 200-204
Del Rio LA (2015) ROS and RNS in plant physiology: an overview. J Exp Bot 66(10): 2827-2837
Dixon RA, Paiva NL (1995) Stress-induced phenylpropanoid metabolism. The Plant Cell 7 (7): 1085–1097
Dubois MK, Gilles A, Hamilton JK, Rebers PA, Smith F (1956) Colorimetric method for determination of sugars and related substances. Anal Chem 28 (3): 350–356
García-Curbelo Y, Bocourt R, Savón LL, García-Vieyra MI, López MG (2015) Prebiotic effect of Agave fourcroydes fructans: an animal model. Food Funct 6 (9): 3177-3182
Garriga M, González G, Alemán S, Abreu E, Quiroz K, Caligari P, García R (2010) Management of auxin-cytokinin interactions to improve micropropagation protocol of henequén (Agave fourcroydes Lem.) Chilean Journal of Agricultural Research 70 (4): 545-551
Gill SS, Tuteja N (2010) Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants. Plant Physiology and Biochemistry 48 (12): 909–930
González G (2001) Embriogénesis somática en henequén (Agave fourcroydes Lem). Tesis presentada en opción al grado Científico de Doctor en Ciencias Agrícolas. Universidad de Matanzas, Matanzas, Cuba
González G, Alemán S, Barredo F, Keb M, Ortiz R, Abreu E, Robert ML (2004) Una alternativa de la recuperación henequenera de Cuba, mediante el uso de técnicas biotecnológicas y moleculares. Biotecnología Aplicada 21(1): 44-49
Gurr SI, McPherson MI, Bowles DJ (1992) Lignin and associated phenolic acids in cell walls. Molecular Plant Pathology and Practical Approach 3: 62-69
Haghighi L, Majd A, Nematzadeh G, Shokri M, Kelij S, Irian S (2014) Salt-induced changes in cell wall peroxidase (CWPRX) and phenolic content of Aeluropus littoralis (Willd). Parl AJCS 8(2): 296-300
Hassanen SA, Khalil RMA (2013) Biotechnological Studies for Improving of Stevia (Stevia rebaudiana Bertoni) in vitro Plantlets. Middle-East Journal of Scientific Research 14(1):93-106
Heidari A, Toorchi M, Bandehagh A, Shakiba MR (2011) Effect of NaCl Stress on Growth, Water Relations, Organic and Inorganic Osmolytes Accumulation in Sunflower (Helianthus annuus L.) Lines. Universal Journal of Environmental Research and Technology 1 (3): 351-362
Hofmann RW, Campbell BD, Bloor SJ (2003) Responses to UV-B radiation in Trifolium repens L.: physiological links to plant productivity and water availability. Plant, Cell & Environment 26 (4): 603–612; doi: 10.1046/j.1365-3040.2003.00996.x
Iqbal N, Masood A, Khan MIR, Asgher M, Fatma M, Khan NA (2013) Cross-talk between sulfur assimilation and ethylene signaling in plants. Plant Signal Behav 8 (1): 1-9
Jain A, Sinha P, Jain A, Vavilala S (2015) Estimation of flavonoid content, polyphenolic content and antioxidant potential of different parts of Abrus precatorius (L.). International Journal of Pharmacy and Pharmaceutical Sciences 7(8):157-163
Jamil M, Bashir S, Anwar S, Bibi S, Bangash A, Ullah F, Shikrha E (2012) Effect of salinity on physiological and biochemical characteristics of different varieties of rice. Pakistan Journal of Botany 44 (1): 7-13
Kadlecek P, TichaI, Haisel D, Capkova V, Schafer C (2001) Importance of in vitro pretreatment for ex vitro acclimatization and growth. Plant Science 161 (4):695–701
Kendir G, Köroğlu A (2015) In vitro antioxidant effect of the leaf and branch extracts of Ribes L. species in Turkey. International Journal of Pharmaceutical Sciences Research 2(108): 1-6
Khan N, Nazar R, Iqbal N, Anjum N (2012) Phytohormones and abiotic stress tolerance in plants. Springer Heidelberg Dordrecht, London; ISBN: 978-3-642-25829-9
Krelavski V, Allakhverdiev Los DA, Kuznetsov VIV (2012) Signilling role of reactive oxygen species in plants under stress. Russian Journal Plant Physiology 59 (2): 141-154
Lowry OH, Rosebrough NJ, Farr AL, Randall R (1951) Protein measurement with the Folin phenol reagent. J Biol Chem 193 (1): 265–275
Mahdia FG, Abd-Alla MM (2010) Micro Propagation of Phoenix dactylifera L. var karama. New York Science 3(12): 64-69
Mehar F, Khan MIR, Massod A, Khan NA (2013) Coordinate changes in assimilatory sulfate reduction are correlated to salt tolerance: involvement of phytohormones. Annual Review and Research in Biology 3 (3): 267-295
Mervat ShS, Dawood MG (2014) Role of ascorbic acid and α tocopherol in alleviating salinity stress on flax plant (Linumus itatissimum L.). Journal of Stress Physiology & Biochemistry 10 (1): 93-111
Miller G (1959) Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal Chem 31 (3): 426-428
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia Plantarum 15(3): 473 – 497
Pant NC, Agarrwal R, Agrawal S (2014) Mannitol-induced drought stress oncalli of Trigonella foenum-graecum L. var. RMt-303. Indian Journal of Experiemental Biology 52 (11): 1128-1137
Posada L, Montesinos YP, Olmedo JG, Barbón R, Rodríguez R, Norman O, Rodriguez RC, Daniels D, Gómez-Kosky R (2016) Effect of phloroglucinol on rooting and in vitro acclimatization of papaya (Carica papaya L. var. Maradol Roja). In Vitro Cellular & Developmental Biology – Plant 52 (2): 196–203; doi: 10.1007/s11627-015-9733-6
Pérez-Santiago, R, Enríquez-del Valle JR, Castañeda-Hidalgo E, Velasco-Velasco VA, Rodríguez-Ortiz G, Campos-Ángeles G (2014) Dosis de fertirriego durante la aclimatización de plantas de Agave americana micropropagadas. Revista Mexicana de Agroecosistemas 1 (1): 20-27
Rodés GR, Collazo OM (2006) Manual de Prácticas de Fotosíntesis. Universidad Autónoma de México, México DF; ISBN: 970-32-3313-9
Sabra A, Daayf F, Renault S (2012) Differential physiological and biochemical responses of three Echinacea species to salinity stress. Scientia Hort 135 (24): 23-31
Sigarroa A (1985) Biometría y diseño experimental. Editorial Pueblo y Educación, La Habana
Sunita K, Srivastava M, Abbasi P (2014) Response of Tephrosia purpurea L. to salinity stress in relation to germination, carotenoid content and proline content. Biolife 2 (1): 276-281
Szalai G, Kellos T, Galiba G, Kocsy G (2009) Glutathione as an antioxidant and regulatory molecule in plants under abiotic stress conditions. J Plant Growth Regul 28: 66-80
Wintermans JF, de Mots A (1965) Spectrophotometric characteristics of chlorophylls a and b and their pheophytins in ethanol. Biochim Biophys Acta 109 (2): 448-453
Xu H, Sun X, Wang X, Shi Q, Yang X, Yang F (2011) Involvement of a cucumber MAPK gene (CsNMAPK) in positive regulation of ROS scavengence and osmotic adjustment under salt stress. Sci Hortic 127 (4): 488-493
Zubair SM, Rasool N, Mansha A, Anjum F, Munawar I, Muhammad M, Muhammad S (2013) Antioxidant, antibacterial, antifungal activities and phytochemical analysis of dagger (Yucca aloifolia) leaves extracts. Journal of Medicinal Plants Research 7 (6):243-249
Recibido: 06-09-2016
Aceptado: 03-11-2016
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
