Artículo original
Biotecnología Vegetal Vol. 17, No. 1: 25 - 32, enero - marzo, 2017
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Diferenciación de cultivares de Phaseolus vulgaris L. mediante respuesta del tejido foliar expuesto a estrés hídrico y salino
Differentiation of Phaseolus vulgaris L. cultivars by leaf tissue response exposed to drought and salinity stress
Raúl Collado1, Annerys Carabeo Pérez2, Ivian Poveda Martínez2, Luis E. Rojas1, Michel Leiva-Mora1, Lourdes R García1, Novisel Veitía1, Amanda Martirena1, Damaris Torres1, Leonardo Rivero1
1Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.
e-mail: raulc@ibp.co.cu
2Facultad de Ciencias Agropecuarias, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.
RESUMEN
La identificación de cultivares de Phaseolus vulgaris L. capaces de tolerar estrés abiótico sin que se afecte su rendimiento es un propósito de los programas de mejoramiento genético de esta leguminosa. El objetivo de este trabajo fue diferenciar cultivares de P. vulgaris mediante la respuesta de tejido foliar expuesto a estrés hídrico y salino inducido in vitro. Discos de hojas del cultivar ‘Cuba Cueto 25-9 Negro’ se colocaron en placas Petri sobre papel de filtro. En cada placa se añadieron 2 ml de solución de PEG 6000 al 6, 8, 10, 12, 14, 16 y 18% (m/v) o NaCl a 50, 100, 150, 200, 250 y 300 mM para inducir estrés hídrico o salino. Como control se empleó agua desionizada. Las placas se mantuvieron durante 48 h a 25 ± 2 °C. Se elaboró una escala de grados de afectación según el porcentaje de área foliar con necrosis. En diez cultivares se aplicó el ensayo y se registró su respuesta mediante la escala elaborada. El tejido foliar a las 48 h presentó áreas necróticas. La escala diseñada se estructuró con siete grados donde el grado 1 se correspondió con tejido no afectado y el siete con tejido con necrosis total. Se observó predominio de los grados 3, 4 y 5. La respuesta de los cultivares expuestos a PEG 6000 y NaCl estuvo influenciada por el tipo de agente estresante y se clasificó en alta, intermedia o baja. El ensayo de discos de hojas de P. vulgaris sometidos a estrés hídrico y salino inducidos in vitro permitió diferenciar la respuesta de cultivares a estas condiciones mediante una escala cualitativa elaborada basada en el porcentaje de área con necrosis.
Palabras clave: áreas necróticas, leguminosa, mejoramiento genético, NaCl, PEG 6000
ABSTRACT
The identification of Phaseolus vulgaris L. cultivars capable to tolerate abiotic stress without affecting its yield is a purpose of the breeding programs of this legume. The objective of this work was to differentiate P. vulgaris cultivars by the foliar tissue response exposed to hydric and saline stress in vitro induced. Leaf discs of 'Cuba Cueto 25-9 Negro' cultivar were placed in Petri dishes on filter paper. On each plate 2 ml of 6, 8, 10, 12, 14, 16 and 18% (w / v) PEG 6000 or 50, 100, 150, 200, 250, and 300 mM NaCl solution were added to induce hydric or saline stress. Deionized water was used as the control. The plates were maintained for 48 h at 25 ± 2 ° C. A scale of degrees of affectation was elaborated according to the percentage of foliar area with necrosis. In ten cultivars of P. vulgaris the assay was applied and its response recorded by the elaborated scale. Leaf tissue at 48 h showed necrotic areas. The designed scale was structured with seven grades where grade 1 corresponded with unaffected tissue and seven with tissue with total necrosis. The predominance of grade 3, 4 and 5 was observed. The response of cultivars exposed to PEG 6000 and NaCl was influenced by the type of stressor and it was classified as high, intermediate or low. The test of P. vulgaris leaf discs subjected to in vitro induced hydric and saline stress allows differentiation of the response of cultivars to these conditions through an elaborated qualitative scale based on the percentage of area with necrosis.
Keywords: necrotic areas, legume, genetic improvement, NaCl, PEG 6000
INTRODUCCIÓN
El frijol común (Phaseolus vulgaris L.), es la leguminosa más importante en la dieta diaria de los cubanos, por necesidades nutricionales y por estar al alcance de la mayoría. Su alto contenido en proteínas lo sitúa como un cultivo estratégico del país ya que permite palear el déficit de proteínas en la dieta alimentaria, uno de los mayores problemas de los países en desarrollo (Porrata et al., 2008). Según la Oficina Nacional de Estadística e Información de la República de Cuba (ONEI, 2016) la producción de frijol en el 2015 fue de 117.6 miles de toneladas, la que decreció en un 13.2% respecto al 2014.
El estrés hídrico, provocado por déficit de agua, constituye la segunda causa que limita la producción de frijol en Cuba (Polón et al., 2014) y en América Latina (Suárez et al., 2016). Cuando el déficit hídrico se presenta durante la etapa reproductiva tiene efectos adversos sobre el rendimiento del frijol (Boicet, 2010). El estrés salino es otro factor ambiental importante que afecta el crecimiento y desarrollo de este cultivo. Aunque P. vulgaris se considera una de las especies con tolerancia a la salinidad (Barrero et al., 2012), se ha informado que bajo condiciones de estrés salino se afecta la germinación de las semillas, su emergencia o el posterior establecimiento de las plántulas (Dantas et al., 2007, Kaymakanova, 2009), se reduce la formación de nódulos y se retarda el crecimiento vegetativo , todo lo cual repercute negativamente sobre la productividad de este cultivo. Por ello, se requiere de investigaciones que contribuyan con la identificación de cultivares de frijol tolerantes al estrés hídrico.
A nivel de laboratorio es posible, con el empleo de agentes estresantes, simular condiciones de estrés hídrico y salino para determinar el grado de tolerancia o afectación de tejido y plantas a estos ambientes adversos. En relación con esto, se han utilizado diferentes compuestos entre los que se recomiendan: manitol, sorbitol, cloruro de sodio (NaCl) (Zeng y Shannon, 2000; Ashraf y Harris, 2004; Zeid, 2004; Shereen et al., 2005) y el polietilenglicol (PEG) (Lu y Neumann, 1999; Basra et al., 2005). De ellos, los más utilizados son PEG y NaCl (Rai et al., 2011; Thiam et al., 2013).
Ante un escenario de estrés hídrico o salino, la planta se marchita y sobre las zonas afectadas es característica la aparición de manchas necróticas. En condiciones de laboratorio, la presencia de estos síntomas se han observado en discos de hojas, después de ser incubados durante dos días con diferentes concentraciones de PEG 6000 o NaCl (Schulze et al., 2005). El empleo de una escala basada en las dimensiones de estas áreas necróticas permitiría a través de un análisis cuantitativo, comparar la respuesta al estrés hídrico o salino de diferentes cultivares y podría ser un indicador de cuáles son las concentraciones de NaCl o PEG a tolerar por cada cultivar. Sin embargo, la formación de áreas necróticas en el tejido ha sido poco explorada como variable y en la literatura científica internacional no se han descrito escalas para equiparar el área de las zonas afectadas con valores cuantitativos de tolerancia a estrés abiótico en frijol común. Este trabajo se realizó con el objetivo de diferenciar cultivares de P. vulgaris mediante la respuesta de tejido foliar expuesto a estrés hídrico y salino inducido in vitro.
MATERIALES Y MÉTODOS
Material vegetal, condiciones de cultivo y colecta de muestras
Se emplearon semillas de P. vulgaris de los cultivares ‘ICA Pijao’, ‘I45R’, ‘L68.3’, ‘L84.9’, ‘L84.6’, ‘L84.4’, ‘Tomeguín-93’, ‘BAT-93’, ‘Cuba Cueto 25-9 Negro’ y ‘Guamá-23’, procedentes del banco de germoplasma del Centro de Investigaciones Agropecuarias de la Universidad Central “Marta Abreu” de Las Villas.
El material vegetal se mantuvo en una casa de cultivos protegidos con condiciones semicontroladas (temperatura ambiente de 27 ± 5 °C, humedad relativa de 84 ± 5% y una densidad de flujo de fotones fotosintéticos en el rango de 280-400 umol m-2s-1). La siembra se realizó en bolsas de polietileno rellenas con 1004.8 cm3 de mezcla de sustrato (materia orgánica y zeolita en proporción 4:1). Se colocaron tres semillas por bolsa y se emplearon 25 bolsas por cada cultivar. Se efectuaron dos riegos al día con un sistema automático de aspersores.
Se colectaron la segunda y tercera hoja trifoliada de plantas con 30-35 días después de la germinación. Los foliolos se seccionaron en discos de 1.1 cm de diámetro con un horadador. En todos los casos, las nervaduras principales y los extremos terminales de los foliolos se desecharon. Los discos de hojas obtenidos se utilizaron para evaluar la respuesta del tejido foliar en condiciones de estrés hídrico y salino.
Respuesta del tejido foliar expuesto a condiciones de estrés hídrico y salino
Con el objetivo de determinar la respuesta del tejido foliar bajo estrés hídrico y salino, se utilizaron placas Petri plásticas (8.5 cm diámetro) dentro de las cuales se colocó un papel de filtro (Whatman No. 42) que cubrió el área de la base de la placa. Se colocaron ocho discos de hojas en cada placa. Cada disco representó una unidad experimental, por lo que se establecieron ocho réplicas por cultivar. A cada placa se le añadieron 2 ml de solución de PEG 6000 o NaCl para inducir estrés hídrico o salino respectivamente. Como control se empleó agua desionizada.
El cultivar ‘Cuba Cueto 25-9 Negro’ sensible al estrés hídrico (Domínguez et al., 2014) se empleó para la elaboración de una escala cualitativa que se utilizó para la evaluación de los grados de afectación por necrosis. Para ello la solución de PEG 6000 y agua desionizada se preparó a las concentraciones 6, 8, 10, 12, 14, 16 y 18% (m/v) que equivalen a los potenciales osmóticos: 6% (-0.066 MPa), 8% (-0.103 MPa), 10% (-0.148 MPa), 12% (-0.201 MPa), 14% (-0.262 MPa), 16% (-0.330 MPa) y 18% (-0.407 MPa). En el caso del NaCl, se incluyeron seis concentraciones (50, 100, 150, 200, 250 y 300 mM), su equivalencia con los potenciales osmóticos es la siguiente: 50 mM (-0.2 MPa), 100 mM (-0.4 MPa), 150 mM (-0.6 MPa), 200 mM (-0.8 MPa), 250 mM (-1.0 MPa) y 300 mM (-1.2 MPa) según lo descrito por Sosa et al. (2005).
La escala se estructuró con grados definidos según el porcentaje de área afectada por necrosis. Se cuantificó el número de discos por grado de afectación y se realizó un análisis de frecuencia de aparición mediante el empleo de estadísticos descriptivos a través de tablas de frecuencia. Además, se hizo un análisis de regresión múltiple de los datos.
Con la escala elaborada se determinó la respuesta del tejido foliar de 10 cultivares de P. vulgaris expuesto a estrés hídrico inducido con PEG 6000 al 6% y salino con NaCl a 200 mM.
Las placas con las muestras expuestas a estrés hídrico y salino, así como el control, fueron mantenidas durante 48 h a 25 ± 2 °C. Luego de este período con la escala elaborada se comparó la respuesta de los cultivares incluidos en el estudio.
Análisis estadístico
Los datos experimentales se analizaron con el paquete estadístico SPSS versión 21.0. La normalidad y la homogeneidad de varianza, se comprobaron mediante las pruebas de Shapiro-Wilk y de Levene, respectivamente. Para los datos que no cumplieron los supuestos de normalidad y homogeneidad de varianza, se aplicó un análisis no paramétrico mediante las pruebas H de Kruskal Wallis y U de Mann Whitney para un nivel de confianza del 95%.
RESULTADOS Y DISCUSIÓN
Respuesta del tejido foliar expuesto a condiciones de estrés hídrico y salino
El tejido foliar del cultivar ‘Cuba Cueto 25-9 Negro’ expuesto a condiciones de estrés inducido con PEG 6000 y NaCl, a las 48 h presentó áreas necróticas, lo que podría estar relacionado con la muerte de las células que forman ese tejido. Atendiendo al porcentaje de área del disco foliar con necrosis la escala diseñada se estructuró con siete grados donde el grado 1 se correspondió con tejido no afectado y el siete con tejido con necrosis total (Tabla 1).

La frecuencia de aparición de los grados de afectación definidos varió en las muestras del cultivar ‘Cuba Cueto 25-9 Negro’ utilizadas para la confección de la escala con predominio de los grados 3, 4 y 5. El gráfico que se obtuvo mostró una distribución gaussiana por la normalidad con la que se distribuyeron los datos y se ajustó a un modelo polinómico de grado 2 (R² = 0.9847) (Figura 1).

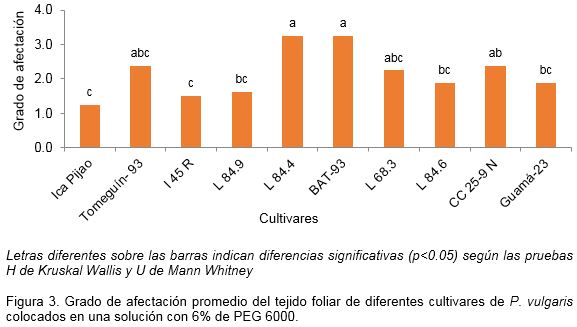
Cuando se analizó la respuesta de los diferentes cultivares expuestos a PEG 6000 y NaCl se observó que la frecuencia relativa de aparición de los grados de afectación estuvo influenciada por el tipo de agente estresante empleado (Figuras 2 y 3). A causa de ello tanto para las muestras expuestas al PEG 6000 como para aquellas tratadas con NaCl esta respuesta se clasificó en alta, intermedia o baja.
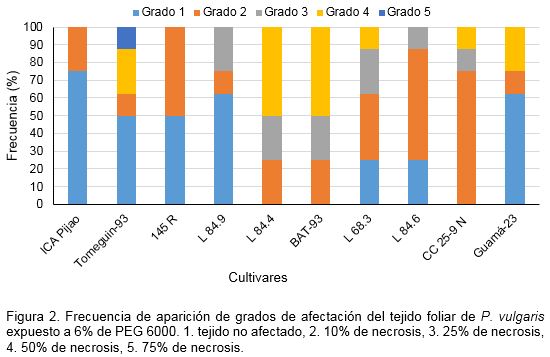
Con 6% de PEG 6000, se observó una respuesta variada en dependencia del cultivar (Figura 2). En este caso los cultivares que tuvieron menor grado de afectación fueron ‘ICA Pijao’ e ‘I45R’ que mostraron una respuesta alta, pues según la escala propuesta la afectación observada fue solo de grado 2. A ellos le siguieron los cultivares ‘Tomeguín-93’, ‘L84.9’, ‘L68.3’, ‘L84.6’ y ‘Guamá 23’ que mostraron respuesta intermedia, los que presentaron grados de afectación 2, 3 y 4. La respuesta más baja se identificó en los cultivares ‘L84.4’, ‘BAT-93’ y ‘Cuba Cueto 25-9 Negro’, estos presentaron el mayor grado de afectación promedio. Es de destacar que aunque en el tejido foliar de ‘L84.4’ y ‘BAT-93’ se identificaron varios grados de afectación, el 4 (disco con 50% de necrosis) tuvo la mayor frecuencia de aparición (Figura 3).
El estrés hídrico produce pérdida de clorofilas acompañada de clorosis característica y posteriormente necrosis del tejido (Wong y Nadeson, 1993). En la presente investigación se observó esta secuencia sintomatológica en los discos de hojas expuestos a diferentes concentraciones de PEG 6000. La formación de las áreas necróticas es una consecuencia de la senescencia del tejido foliar, pues bajo estrés hídrico, se afectan diferentes procesos metabólicos y bioquímicos como la reducción del contenido de clorofila y la síntesis de otros pigmentos que afectan el proceso de la fotosíntesis (Jaleel et al., 2009).
Hasta la fecha no se encontraron informes acerca de la respuesta al estrés hídrico y salino de la mayoría de los cultivares de P. vulgaris evaluados, de ahí su importancia para iniciar estudios que corroboren estos resultados en planta en condiciones de casa de cultivo y campo. Es de destacar que los resultados del cultivar ‘Cuba Cueto 25-9 Negro’ coincidieron con lo informado por Domínguez et al. (2014) que lo refieren como sensible en condiciones de estrés hídrico. Ello indicó que el ensayo de discos de hojas colocados en condiciones de estrés hídrico y salino puede ser una herramienta útil para la selección de cultivares de frijol común tolerantes a estrés hídrico.
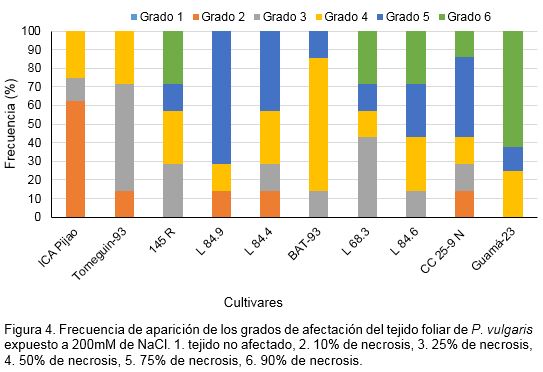
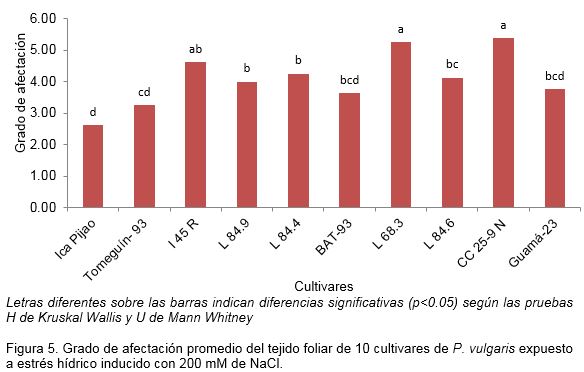
El tejido foliar de los diferentes cultivares tratados con 200 mM de NaCl también presentó afectaciones. El cultivar ‘ICA Pijao’ tuvo la respuesta más alta con el menor grado de afectación. En este cultivar el grado 2 de afectación presentó la mayor frecuencia de aparición, aunque también se observaron afectaciones de grado 3 y 4. En el caso de los cultivares ‘I 45 R’, ‘L68.3’ ‘L84.6’, ‘Cuba Cueto 25-9 Negro’ y ‘Guamá-23’ que presentaron mayor grado de afectación con una respuesta baja, se observó tejido con grado 6, pues este resultó afectado hasta en un 90% (Figura 5).
Respecto a la respuesta fisiológica de las leguminosas al estrés salino se han encontrado diferentes planteamientos. Por ejemplo, Garzón y García (2011) en el estudio del efecto de NaCl (100 mM) sobre la anatomía radicular y foliar en dos cultivares de frijol de la especie Vignia unguiculata (L.) Walp., revelaron una inducción de tricomas glandulares en las hojas primarias de las plantas estresadas, así como invaginaciones en las células del parénquima en empalizada y arreglo menos compacto del mesófilo. En tres cultivares también encontraron una reducción significativa del grosor de la hoja y de la epidermis adaxial del parénquima clorofílico en empalizada y esponjoso. Estos autores concluyeron que los mecanismos anatómicos de adaptación de esta especie al estrés por NaCl están relacionados con el mantenimiento de la integridad del tejido foliar. Sin embargo, las respuestas obtenidas en este trabajo en los diferentes cultivares evaluados no se han descrito para frijol común en la literatura científica consultada.
Los resultados demostraron que la formación de áreas necróticas bajo las condiciones establecidas en esta investigación permiten diferenciar la respuesta de los cultivares de frijol expuestos a estrés hídrico o salino. La validación de este procedimiento como una herramienta para seleccionar cultivares de frijol tolerantes al estrés hídrico o salino requiere de futuras investigaciones para correlacionar estos resultados con la respuesta de los cultivares expuestos a déficit hídrico y altas concentraciones de sales en condiciones de campo.
CONCLUSIONES
El ensayo de discos de hojas de P. vulgaris sometidos a condiciones de estrés hídrico y salino inducidos in vitro permite diferenciar la respuesta de cultivares mediante una escala cualitativas elaborada basada en el porcentaje de área con necrosis.
REFERENCIAS
Ashraf M, Harris P (2004) Potential biochemical indicators of salinity tolerance in plants. Plant Science 166: 3-16; doi: 10.1016/j.plantsci.2003.10.024
Barrero KYA, Sánchez RL, Flores RA, Garcés IA, Pascual MF (2012) Tolerancia a la salinidad de cuatros genotipos de frijol común (Phaseolus vulgaris L). Centro Agrícola 39 (4): 39-43
Basra S, Farooq M, Tabassam R, Ahmad N (2005) Physiological and biochemical aspects of pre-sowing seed treatments in fine rice (Oryza sativa L.). Seed Science and Technology 33 (3): 623-628; doi: 10.15258/sst.2005.33.3.09
Boicet T (2010) Estrés hídrico y la distribución de características vegetativas y reproductivas en genotipos de frijol común (Phaseolus vulgaris L). En: Ediciones INCA (ed) Libro Resumen XVII Congreso Científico Internacional del Instituto Nacional de Ciencias Agrícolas, pp. 145. INCA, La Habana
Dantas BF, Ribeiro LdS, Aragão CA (2007) Germinação, crescimento inicial e teor de proteína nos cotiledones de feijão em estresse salino. Revista Brasileira de Sementes 29 (1): 106-110; doi: 10.1590/S0101-31222007000200014
Domínguez A, Pérez Y, Alemán S, Sosa M, Fuentes L, Darias R, Demey J, Rea R, Sosa D, (2014) Respuesta de cultivares de Phaseolus vulgaris L. al estrés por sequía. Biotecnología Vegetal 14 (1): 29-36
García M, García G, Sanabria M (2010) Efecto de la salinidad sobre el crecimiento, daño oxidativo y concentración foliar de metabolitos secundarios en dos variedades de caraota (Phaseolus vulgaris L.). Interciencia 35 (11): 840-846
Garzón P, García M (2011) Efecto del estrés por NaCl sobre la anatomía radical y foliar en dos genotipos de frijol (Vigna unguiculata (L.) Walp.). Bioagro 23 (3): 153-160
Jaleel CA, Manivannan P, Wahid A, Farooq M, Al-Juburi HJ, Somasundaram R, Panneerselvam R (2009) Drought stress in plants: a review on morphological characteristics and pigments composition. Int J Agric Biol 11 (1): 100-105
Kaymakanova M (2009) Effect of salinity on germination and seed physiology in bean (Phaseolus vulgaris L.). Biotechnology & Biotechnological Equipment 23 (2): 326-329; doi: 10.1080/13102818.2009.10818430
Lu Z, Neumann PM (1999) Water stress inhibits hydraulic conductance and leaf growth in rice seedlings but not the transport of water via mercury-sensitive water channels in the root. Plant Physiology 120: 143-152; doi: 10.1104/pp.120.1.143
Oficinal Nacional de Estadística e Información (2016) Anuario estadístico de Cuba. 2016 Disponible en: http://www.one.cu/aec2015.htm Consultado 06/09/2016
Polón Pérez R, Miranda Caballero A, Ramírez Arrebato MA, Maqueira López LA (2014) Efectos del estrés de agua sobre el rendimiento de granos en la fase vegetativa en el cultivo del frijol (Phaseolus vulgaris L.). Revista Ciencias Técnicas Agropecuarias 23 (4): 33-36
Porrata Maury C, Hernández Triana M, Abuín Landín A, Campa Huergo C, Pianesi M (2008) Caracterización y evaluación nutricional de las dietas macrobióticas Ma-Pi. Revista Cubana de Investigaciones Biomédicas 27: 3-4
Rai MK, Kalia RK, Singh R, Gangola MP, Dhawan A (2011) Developing stress tolerant plants through in vitro selection—an overview of the recent progress. Environmental and Experimental Botany 71 (1): 89-98; doi: 10.1016/j.envexpbot.2010.10.021
Schulze ED, Beck E, Müller-Hohenstein K (2005) Plant Ecology. Springer-Verlag Berlin Heidelberg, New Delhi; ISBN: 978-3-540-20833-4
Shereen A, Mumtaz S, Raza S, Khan M, Solangi S (2005) Salinity effects on seedling growth and yield components of different inbred rice lines. Pak J Bot 37 (1): 131-139
Sosa L, Llanes A, Reinoso H, Reginato M, Luna V (2005) Osmotic and specific ion effects on the germination of Prosopis strombulifera. Annals of botany 96 (2): 261-267; doi: 10.1093/aob/mci173
Suárez AD, Davalo YM, Hernandez YP, Alfonso LF, Rodríguez RD, del Castillo MS, del Castillo, DS (2016) Comportamiento de variedades cubanas y venezolanas de frijol común, cultivados en condiciones de sequía. Revista Ciencia UNEMI 9 (20): 68-75
Thiam M, Champion A, Diouf D, Oureye M (2013). NaCl effects on in vitro germination and growth of some senegalese cowpea (Vigna unguiculata (L.) Walp.) cultivars. ISRN Biotechnology 2013(2013): 1-11; doi: 10.5402/2013/382417
Wong N, Nadeson R (1993) Water stress and leaf necrosis symptom of rambutan seedlings (Nephelium lappaceum Linn.). MARDI Res J 21 (1): 51-58
Zeid IM (2004) Response of bean (Phaseolus vulgaris) to exogenous putrescine treatment under salinity stress. Pakistan Journal of Biological Sciences 7 (2): 219-225; doi: 10.3923/pjbs.2004.219.225
Zeng L, Shannon MC (2000) Salinity effects on seedling growth and yield components of rice. Crop Sci 40 (4): 996–1003; doi: 10.2135/cropsci2000.404996x
Recibido: 12-12-2016
Aceptado: 26-01-2017
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
