Artículo original
Biotecnología Vegetal Vol. 17, No. 1: 41 - 49, enero - marzo, 2017
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Establecimiento de un banco clonal de Caesalpinia spinosa (Mol.) O. Kuntz mediante selección de árboles plus e injerto
Establishment of a clonal bank of Caesalpinia spinosa (Mol.) O. Kuntz by selection of plus trees and grafting
Jenny E Nuñez1,2, Elisa Quiala3, Manuel de Feria2, Saúl Mestanza3, Rafael Gómez-Kosky4, Franklin R Cuadrado1, Michel Leiva-Mora5
1Escuela Superior Politécnica de Chimborazo ESPOCH. Panamericana Sur km 11/2. Riobamba. Chimborazo. Ecuador. CP 060155 e-mail: jennyelizabethn@yahoo.com, jenunez@espoch.edu.ec
2Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.
3Instituto Nacional de Investigaciones Agropecuarias, INIAP. Avenida Eloy Alfaro N30-350 y Amazonas. Quito. Pichincha. Ecuador. CP 170517.
4Estación Territorial de Investigaciones de la Caña de Azúcar (ETICA) centro Villa Clara, Instituto de Investigaciones de la Caña de Azúcar (INICA). km 246 de la Autopista Nacional. Ranchuelo. Villa Clara, Cuba. CP 53100.
5AgritechbioCia Ltda. Venezuela 1128 entre Darquea y Cuba. Riobamba. Chimborazo. Ecuador. CP 060150.
RESUMEN
En Ecuador no se dispone de técnicas de propagación de plantas a nivel comercial que permitan establecer bancos clonales de árboles plus de Caesalpinia spinosa (Mol.) O. Kuntz (guarango), lo cual limita el desarrollo de protocolos de propagación in vitro de esta especie. El objetivo del presente trabajo fue establecer un banco clonal de C. spinosa mediante la selección de árboles plus e injerto. Se seleccionaron árboles plus de guarango pertenecientes a la provincia de Chimborazo, cantón Guano, en base a la altura total, altura al comienzo de la copa, altura de copa, superficie de copa, simetría de copa, floración, producción de frutos y contenido de taninos en la vaina. Las plantas patrones para realizar los injertos se obtuvieron a partir de semillas escarificadas, remojadas durante 48 horas a temperatura ambiente y sembradas en camas de 1.0 x 3.0 m. A los 40 días, las plántulas fueron trasplantadas a bolsas y a los 16 meses se realizaron los injertos en las plantas patrones. Se utilizaron tres tipos de injerto (hendidura simple en el patrón, hendidura simple en la púa y escudete). Por cada uno se usaron 100 patrones. De ocho árboles plus colectados en campo se seleccionó el ecotipo CHSt03 para realizar los injertos, pues fue quien mayor altura total (6.6m), altura al comienzo de la copa (2.2m), superficie de copa (>70%), volumen de copa (>10%), simetría de copa (1), Frutos (40kg/árbol) y contenido de polifenoles totales en vainas (5870 µgEAGgMS-1) mostró. El injerto mediante hendidura simple en el patrón tuvo el mayor porcentaje de prendimiento (80%). Estos resultados permitieron establecer un banco clonal de 80 plantas injertadas de C. spinosa del ecotipo CHSt03, lo cual sienta las bases para desarrollar protocolos de propagación in vitro de esta especie forestal, nativa de Ecuador.
Palabras clave: biodiversidad, biotecnología, forestal, industria, taninos
ABSTRACT
In Ecuador, plant propagation techniques are not available commercially to establish clonal banks of Caesalpinia spinosa (Mol.) O. Kuntz (guarango) plus trees, which limits the development of in vitro propagation protocols of this specie. The objective of the present work was to establish a clonal bank of C. spinosa by selecting plus trees and grafting. Guarango trees belonging to the province of Chimborazo, Guano canton were selected based on total height, height at the beginning of the crown, height of crown, crown surface, crown symmetry, flowering, fruit production and content of tannins in the pod. The patron plants to make the grafts were obtained from scarified seeds, soaked for 48 hours at room temperature and planted in beds of 1.0 x 3.0 m. At 40 days, the seedlings were transplanted into pockets and at 16 months the grafts were made in the patron plants. Three types of graft were used (simple slit in the patron, single slit in the spike and bud grafting). For each, 100 patron were used. Of the eight trees plus collected in the field, the ecotype CHSt03 was used to make the grafts. It was showed the highest total height (6.6m), height at the beginning of the cup (2.2m), cup surface (> 70%), cup volume (> 10%), cup symmetry (1), fruit (40kg / tree) and total polyphenol content in pods (5870 μgEAGgMS-1). The graft by simple slit in the patron had the highest stuck percentage (80%). These results allowed to establish a clonal bank of 80 plants grafted of C. spinosa of the ecotype CHSt03, which establish the bases to develop protocols for in vitro propagation of this forest species, native of Ecuador.
Keywords: biodiversity, biotechnology, forestry, industry, tannins
INTRODUCCIÓN
Caesalpinia spinosa (Mol.) O. Kuntz conocida comúnmente como guarango o tara es una especie leguminosa forestal muy importante en Perú y Ecuador. Este árbol se encuentra en los bosques secos tropicales que prosperan en lugares áridos o desérticos, donde puede tener una alta productividad (Balaguer et al., 2011).
La especie tiene un gran valor ecológico y comercial. Sus vainas y semillas se usan para la extracción de taninos y otros compuestos de valor industrial (de la Cruz, 2004; Larrea, 2011). Debido a su tala indiscriminada en Ecuador ha decrecido significativamente la cantidad de ejemplares, motivo por el cual se requiere establecer una pronta recuperación de este valioso recurso fitogenético (Rodríguez y Apolinario, 2015). La biotecnología vegetal pudiera resultar una valiosa herramienta para en un corto tiempo propagar masivamente árboles plus en relación con su respuestas dasométricas y productivas. Un factor indispensable es que los materiales vegetales seleccionados estén bien adaptados a las regiones ecológicas del país (Bonilla et al., 2016).
Sin embargo, en Ecuador no se conoce en condiciones de campo cuáles son los árboles de C. spinosa con mejores características dasométricas ni de mayor contenido de taninos en sus vainas. Adicionalmente no se dispone de técnicas de propagación de plantas a nivel comercial que permitan establecer bancos clonales de árboles plus de C. spinosa, lo cual limita el desarrollo de protocolos de propagación in vitro de esta especie.
En base a la problemática anterior el presente trabajo se propuso como objetivo establecer un banco clonal de C. spinosa mediante la selección de árboles plus e injerto.
MATERIALES Y MÉTODOS
El presente trabajo se realizó en la Escuela Superior Politécnica de Chimborazo (ESPOCH) en el período de enero del 2012 a diciembre del 2014. Los sitios muestreados se ubicaron en la provincia de Chimborazo (Fig. 1).

Selección de árboles plus
El proceso de selección de árboles plus se comenzó con la definición de las características de un árbol plus, según los objetivos. Estas variaron de acuerdo con la especie y la orientación de la explotación. Se utilizó el Método de valoración Individual (Ipinza, 1998). Se recorrió previamente la población, a fin de tener una idea completa de la variación.
Los pasos en la selección de árboles plus fueron los siguientes:
se definió el método de selección: método de valoración individual,
se definió el rasgo de interés y los requisitos mínimos de los árboles candidatos,
se eligieron las áreas y poblaciones de selección,
se recorrieron sistemáticamente las áreas elegidas y se seleccionaron los árboles candidatos,
se descartaron los árboles candidatos que no cumplieron con los requisitos preestablecidos,
se aplicaron las pautas contenidas en el formulario de evaluación de campo a los árboles que quedaron,
se calculó el puntaje final de cada árbol candidato y se seleccionó el puntaje superior,
se determinó si era o no un árbol plus.
Para determinar si los árboles candidatos seleccionados se consideraban árboles plus fueron seguidas las pautas (Tabla 1) y formularios para la selección de árboles plus de C.spinosa propuestos por Flores y Chávarry (2005).

Los formularios empleados contenían como acápites:
una información general (institución, seleccionador, fecha, croquis, número de árbol plus, edad, propietario, origen, distribución, exposición, pendiente, tipo de suelo, especies asociadas, tratamientos silviculturales, zona de vida, altitud, área, departamento, provincia, localidad, ubicación: coordenadas UTM),
los datos dasométricos (se consideró un mínimo de cinco árboles de comparación, en caso de poblaciones coetáneas y en caso de árboles de edades múltiples y dispersos, se tomaron solo los datos correspondientes al árbol candidato),
otorgamiento de un puntaje a cada árbol candidato según una valoración subjetiva de los árboles de comparación ( en caso de árboles de edades múltiples y dispersos, se tomaron solo los datos del árbol candidato),
registros de puntajes (se emplearon las variables objetivas y subjetivas de acuerdo con los criterios para la selección de árboles plus).
Además, se cuantificó el contenido de polifenoles totales en vainas de los árboles seleccionados. Para ello, se colectaron vainas maduras y se trasladaron al laboratorio. Se separaron las vainas sanas de aquellas consideradas como defectuosas (quemadas, presencia de hongos, picadas, etc.). Las semillas fueron eliminadas mediante el rompimiento manual de las vainas. Se procedió a la molienda de las vainas con ayuda de un molinillo manual hasta obtener un polvo fino que se almacenó en bolsas de polietileno selladas, en un lugar seco a temperatura ambiente.
Para la obtención del extracto supercrítico de vainas de tara se utilizó un equipo extractor supercrítico (Speed SFE unit, modelo 7071, AppliedSeparations, Allentown PA), el cual consiste en un enfriador (Julabo F200 con refrigerante R134a. Seelbach, Alemania), una bomba de alta presión para CO2, una bomba para ingresar el etanol (de desplazamiento positivo HPLC- Pumpe K-501), una cámara de calentamiento, un vaso de extracción, un regulador de presión, recipientes para recibir el extracto y un medidor de flujo de salida de CO2. A 5.0 g de polvo en un vaso de precipitado de 250 ml de capacidad se agregaron 5.0 ml de etanol absoluto gota a gota, tratando de humectar en forma uniforme el polvo. Luego el vaso se tapó con Parafilm y se dejó por 16 horas hasta el momento de la extracción súper crítica.
Posteriormente, en un vaso extractor de 50 ml de acero inoxidable se cargó aproximadamente 5.0 g de muestra (previamente tratada con co-solvente) usando como soportes lana de vidrio y tierra de diatomea Celite. La extracción se realizó a una temperatura constante de 40ºC y una presión variable entre 500 y 550 bar; durante un tiempo de extracción de 30 min, un flujo de salida de CO2 de 2.5 l min-1 y una temperatura de la válvula de 120ºC. El extracto se recibió en tubos de vidrio (propios del equipo), inmersos en un baño de agua/hielo. Cuando fue necesario el extracto se filtró en embudo analítico con ayuda de algodón y posteriormente se aforó a 10 ml con etanol absoluto.El extracto se almacenó a -20ºC hasta su análisis. Se preparó un pool de extractos obtenido de las extracciones realizadas.
El procedimiento de cuantificación del contenido de polifenoles consistió en una adaptación del método descrito por Gutfinger (1981) para polifenoles en aceite de oliva. Este método se refiere a una mezcla de ácido fosfotúngstico (H3PW12O40) y ácido fosfomolíbdico (H3PMo12O40), que se reduce; por oxidación de los fenoles, a una mezcla de óxidos de tungsteno (W8O23) y de molibdeno (Mo8O23). La coloración azul producida posee una absorción máxima a 700 nm y es proporcional al contenido de compuestos fenólicos (Ribéreau et al., 1970). Se determinó la absorbancia de la solución con un espectrofotómetro UV/VIS (BeckmanCoulter DU1800) a 700 nm. El contenido de fenoles totales se calculó con el empleo de una curva patrón de ácido gálico (AG), de un rango de linealidad de 1000-8000 mg l-1 (R2= 0.9954). Los resultados son la media de tres muestras analizadas, repetidas tres veces, por cada árbol seleccionado, expresados como microgramos equivalentes de ácido gálico (AG) por gramos de masa seca (µgEAG gMS-1).
Establecimiento de un banco clonal
Se utilizaron semillas colectadas en el mes de marzo del 2012, las cuales fueron escarificadas, remojadas en agua durante 48 horas a temperatura ambiente y sembradas en camas de 1.0 x 3.0 m. El sustrato que se utilizó estuvo compuesto por turba y tierra negra en una proporción de 4:1. Se usó un cobertor por una semana para mantener una humedad relativa superior al 70% y una intensidad luminosa del 25%. Posteriormente se retiró el cobertor.
A los 40 días de la siembra, las plántulas obtenidas fueron trasplantadas en bolsas de polietileno negro (9.0 x 12.0 pulgadas) y mantenidas en condiciones de casa de cultivo protegido. A los 15 meses las plantas fueron utilizadas como patrones para realizar los injertos. Se emplearon tres tipos de injerto y por cada uno se utilizaron 100 plantas patrones.
Injerto de hendidura simple en el patrón: las plantas fueron decapitadas mediante un corte transversal a una altura de 20 cm de la base y se realizó en el patrón una hendidura con una profundidad de 4.0 a 5.0 cm, acorde con lo descrito por Flores y Chávarry (2005). Una vez realizado el corte, se selló en su parte terminal con Parafilm® con el fin de evitar la deshidratación del tejido cortado y su oxidación.
Para preparar la púa, en su extremo terminal se practicó un corte biselado en forma longitudinal, de manera que al realizar el otro corte en la púa coincidieran uniformemente. La púa fue colocada cuidadosamente en la hendidura del patrón para que los tejidos cambiales de ambas porciones coincidieran.
Injerto de hendidura simple en la púa: se invirtió el manejo del corte del tratamiento anterior, donde en el patrón se efectuó un corte en forma de bisel hasta alcanzar forma de púa, mientras en la púa se realizó un corte en forma de V. Este tipo de injerto se conoce comúnmente como injerto de caballito. El procedimiento de sellado se efectuó de modo similar al descrito anteriormente.
Injerto escudete: se realizó un corte en la rama adulta de alrededor de 1.2 cm por debajo de la yema y de 1.9 cm de profundidad. En la planta patrón se eligió una zona sin yemas y se realizó un corte en forma de T y se colocó el esqueje con la yema por debajo de la corteza del patrón cuidadosamente.
En los tres tipos de injertos para mantener el esqueje o la yema en su lugar se rodeó el patrón con una cinta para injertos se ajustó y se cubrió la yema.
Previo a la colocación de la cinta se aplicó una pasta cicatrizante (Fertiberia, Ref 7258303). Finalmente se colocó una funda plástica blanca, invertida boca abajo, se utilizó como soporte un tutor de madera de una longitud que sobrepasó los 10 cm de la altura de la planta injertada, de tal manera que el injerto o la púa quedó en el interior. La abertura de la funda fue atada a la base del patrón y se practicó un corte de 5.0 cm para facilitar el intercambio gaseoso entre la púa y el medio exterior y reducir la temperatura en el interior de la bolsa y la condensación de agua.
A los cinco meses de realizados los injertos, se evaluó el número de injertos prendidos en diez bloques aleatorios que contenían diez plantas cada uno y se calculó el porcentaje de prendimiento.
Procesamiento estadístico
Para la selección del árbol mejor candidato para iniciar el cultivo in vitro se realizó un análisis estadístico de las variables cuantitativas referidas a la cantidad de frutos por árbol y al contenido de polifenoles. Para comprobar la homogeneidad y normalidad de los datos se utilizó la prueba de Kolmogorov-Smirnov y para comprobar las diferencias estadísticas entre las medias la prueba H de Kruskall-Wallis. Se utilizó un diseño completamente aleatorizado en los tres tipos de injertos para su ubicación en vivero. En cada tipo de injerto se establecieron 10 grupos de 10 plantas y en cada uno de ellos se determinó el porcentaje de prendimiento a los cinco meses. El análisis estadístico del contenido de polifenoles de los extractos supercríticos de vaina se realizó a partir de los datos experimentales de tres muestras repetidas tres veces (n=9) por cada árbol seleccionado. Para el procesamiento estadístico de los ensayos se utilizó el paquete IBM SPSS Statistics versión 22.00.
RESULTADOS Y DISCUSIÓN
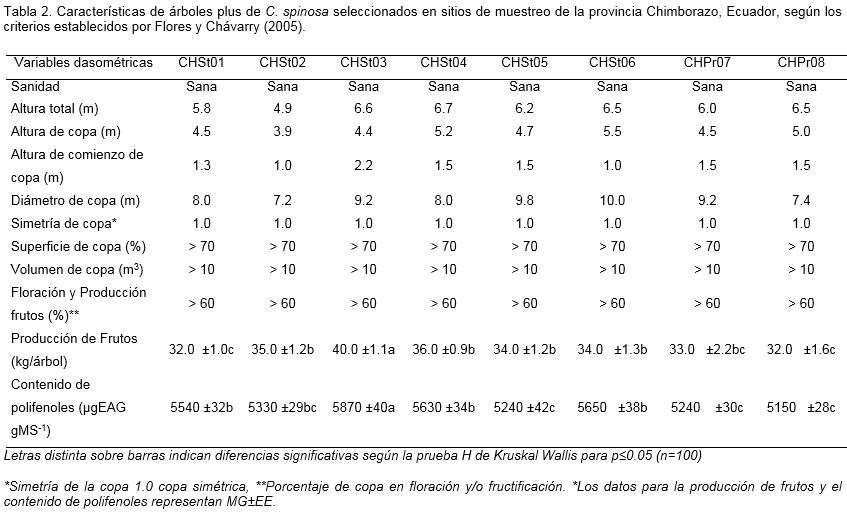
Atendiendo a los criterios seguidos, en los sitios de muestreo se seleccionaron ocho árboles plus (Tabla 2). Los ocho cumplieron con los demás estándares de selección prefijados, como es el caso de ser un árbol sano, con una copa simétrica (=1), la superficie de la copa >70%, el volumen de la copa > 10 m3, la altura de la copa superior a 3.5, con un porciento de floración y producción de frutos >60%. Sin embargo, dentro de ellos, las variables más importantes para la selección, en este caso la producción de frutos por árbol (kg/árbol) y el contenido de polifenoles, fueron significativamente superiores en el ecotipo CHSt03.
Autores como Díaz et al. (2015) evaluaron la respuesta de diferentes variables dasométricas de Caesalpinia platyloba S. Watson de un modo similar al utilizado en el presente trabajo. Sin embargo, aunque los autores utilizaron estas variables para estimar el potencial de secuestro de carbono de esta especie y seleccionar árboles promisorios, este método de evaluación sirvió para seleccionar árboles plus de C. spinosa, los cuales permitirían disponer de material vegetal para apoyar programas de propagación in vitro vía biotecnológica.
Así mismo, Olivares et al. (2013) identificaron especies promisorias de leguminosas (Pithecellobium dulce (Roxb.) Benth, Haematoxylum brasiletto Karts y Gliricidia sepium (Jacq.) Kunth, mediante el uso de variables dasométrica. Sin embargo, el objetivo de estos autores fue seleccionar aquellas que mejores perspectivas reunían para ser utilizadas en ranchos ganaderos del sur del Estado de México como fuente de alimentación sin utilizar la micropropagación.
Las características que se elijan para la selección de un árbol plus deben ser aquellas que estén directamente relacionadas con el objetivo del programa de mejoramiento genético o de propagación. Una vez definidas, se estima la ponderación económica de cada variable, es decir, su efecto en el producto económico. Por ejemplo, en un proceso de producción de pulpa, las variables que exhiben mayor importancia económica son el rendimiento pulpable, la densidad de la madera y finalmente el volumen. Esto implica que desde el punto de vista práctico la densidad de la madera y el volumen no pueden quedar fuera del proceso de selección. Posteriormente, si no se dispone de valores de heredabilidad de la especie y de la localidad en estudio, se pueden estimar a base de valores estándar, en este caso se recomienda utilizar valores conservadores (Ipinza, 1998). En el caso de C. spinosa, las variables como cantidad de frutos por árbol (kg/árbol), floración y producción de frutos (%) y el contenido de polifenoles, las cuales están relacionadas con el producto comercial, en este caso el fruto, fueron las predominantes para la selección de este ecotipo.
En relación con la importancia de los frutos de C. spinosa, como fuente de compuestos fenólicos, se han logrado aislar gomas que tienen amplio uso en la producción de alimentos, así como ingredientes de pinturas. Asimismo, numerosos compuestos metabólicos se obtienen a partir de sus vainas como productos cosméticos, medicinas, compuestos químicos y farmacéuticos debido a su actividad antitumoral, antimicrobiana y antioxidante (Chanwitheesuk et al., 2007). En los árboles seleccionados en este trabajo se obtuvieron niveles de polifenoles en cantidades aproximadas a las descritas en la literatura internacional. Mancero (2008) determinó que en las vainas de C. spinosa existía un contenido de taninos superior a 6200 µg EAG gMS-1, con la presencia de 40% a un 60% de taninos hidrosolubles como el ácido gálico, lo cual fue superior a los resultados de este trabajo. Sin embargo, estos resultados podrían ser consecuencia de que los árboles seleccionados procedían de una región más seca que la descrita en este estudio. Se conoce que la acumulación de compuestos fenólicos está influenciada por las condiciones climáticas, y la sequía es un factor estresante que favorece su acumulación (Vargas-Álvarez et al., 2005).
Entre los ocho árboles plus se seleccionó el ecotipo CHSt03 para realizar los injertos, pues fue el de mayor altura total (6.6 m), altura al comienzo de la copa (2.2 m), superficie de copa (>70%), volumen de copa (>10%), simetría de copa (1), Frutos (40 kg/árbol) y contenido de taninos (5870 µgEAG gMS-1) (Tabla 2 y Fig. 2A).

Después de cinco meses de realizados los injertos se observó que el de hendidura simple en patrón, tuvo el mayor porcentaje de prendimiento (80%) mientras que, el menos eficiente fue el injerto por escudete (3.0%) (Fig. 3).
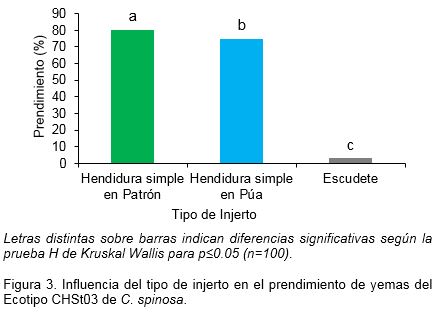
Los resultados de este trabajo fueron superiores a los referidos por Flores y Chávarry (2005), quienes lograron un 73.3% de prendimiento al utilizar el injerto diametral simple en el patrón. Así mismo, el injerto por hendidura diametral simple fue el que mejores resultados arrojó para estos autores, lo cual coincide con la presente experiencia. Este tipo de injerto también puede ser utilizado para clonar plantas adultas de C. spinosa y establecer sistemas de macropropagación eficientes que mantengan la estabilidad genética. La técnica de propagación por injerto depende principalmente de la experiencia del injertador, del estado fenológico de crecimiento que presenten las púas de los árboles seleccionados, el vigor de las plantas utilizadas como portainjertos y en especial, los cuidados requeridos para su mantenimiento en vivero y campo, por lo que estos son los factores más importantes que deben tenerse en cuenta para el éxito del injerto (Aparicio-Rentería et al., 2013).
A partir del material vegetal revigorizado mediante injerto diametral en la púa y en el patrón se logró establecer un banco de plantas donantes en casa de cultivo (Fig.2D). La revigorización de material adulto constituye un elemento importante en el proceso de propagación clonal mediante cultivo in vitro de la gran mayoría de las especies leñosas. El establecer un banco de plantas donantes en condiciones semicontroladas, permite controlar mejor la calidad fisiológica y sanitaria del material vegetal, lo que garantiza un mayor éxito durante el establecimiento in vitro de los explantes.
CONCLUSIONES
Mediante la selección de árboles plus del ecotipo CHSt03 e injerto por hendidura diametral simple del patrón se logró establecer un banco clonal de C. spinosa, aspecto que sienta las bases para el desarrollo de protocolos de propagación in vitro de esta especie.
REFERENCIAS
Aparicio A, Viveros, H, Rebolledo V (2013) Clonal seed orchards: an alternative for reforestation programs in Veracruz. Revista mexicana de ciencias forestales 4 (20): 90-97
Balaguer L, Arroyo R, Jiménez P, Jiménez MD, Villegas L, Cordero I, Rubio de Casas R, Fernández R, Ron ME, Manrique E, Vargas P, Cano E, Pueyo JJ, Aronson J (2011) Forest restoration in a fog oasis: evidence indicates need for cultural awareness in constructing the reference. PLoSOne 6(8) 1-10; doi: 10.1371/Journal.pone.0023004
Bonilla H, López A, Carbajal Y, Siles M (2016) Análisis de variables morfométricas de frutos de tara provenientes de Yauyos y Ayacucho para identificar caracteres agromorfológicos de interés. Scientia Agropecuaria 7(SPE): 157-164
Chanwitheesuk A, Teerawutgulrag A, Kilburn JD, Rakariyatham N (2007) Antimicrobial gallic acid from Caesalpinia mimosoides Lamk. FoodChem 100 (3):1044–1048; doi: 10.1016/j.foodchem.2005.11.008
de la Cruz P (2004) Aprovechamiento integral y racional de la tara Caesalpinia spinosa-Caesalpinia tinctoria. Revista del Instituto de Investigación de la facultad de ingeniería geológica, minera, metalúrgica y geográfica 7(14): 64-73
Díaz N, Martínez M, García JL, Norzagaray M, Luna A, González HA (2015) Carbon Sequestration of Caesalpinia platyloba S. Watt (Leguminosae) (Lott 1985) in the Tropical Deciduous Forest. PLoS ONE 10(5): e0125478; doi: 10.1371/journal.pone.0125478
Flores F, Chávarry L (2005) Edad óptima del patrón, época oportuna de injertado y producción masiva de injertos de Caesalpinia spinosa (Molina) Kuntze – Tara. Asociación Civil para la Investigación y el Desarrollo Forestal, Lima
Gutfinger T (1981) Polyphenols in olive oils. Journal of American oils Chemistry Society 58 (11): 966-968
Ipinza R (1998) Métodos de selección de árboles plus. En: Roberto Ipinza, Braulio Gutierrez, Veronica Emhart (eds) Curso Mejora Genética Forestal Operativa, pp. 105 -127. Universidad Austral de Chile/INFOR/CONAF, Valdivia – Chile; doi: 10.13140/RG.2.1.3815.0884
Larrea M (2011) La tara, guarango o taya (Caesalpinia spinosa) en la Región Andina: criterios ambientales para la sustentabilidad de su aprovechamiento y manejo en Bolivia, Ecuador y Perú. Programa Regional ECOBONA-INTERCOOPER, Quito
Mancero L (2008) La Tara (Caesalpinia spinosa) en Perú, Bolivia y Ecuador: análisis de la cadena Productiva en la Región. Programa Regional ECOBONA - INTERCOOPERATION, Quito
Olivares J, Avilés F, Albarrán B, Rojas S, Castelán OA (2011) Identificación, usos y medición de leguminosas arbóreas forrajeras en ranchos ganaderos del sur del estado de México. Tropical and subtropical agroecosystems 14(2): 739-74
Ribéreau P, Sudraud P, Milhe JC, Canbas A (1970) Recherches technologiques sur les composes phénoliques des vins rouges. Conn Vigne Vin 4 (2):133-144
Rodríguez A, Apolinario B (2015) Estudio de factibilidad para la implementación de una finca productora de Guarango (Caesalpinia spinosa) en el sector San Guillermo, Imbabura, Ecuador (Tesis de diploma) Universidad Salesiana, Quito, Ecuador
Vargas-Álvarez D, Soto-Hernández M, González-Hernández V A, Engleman E M, Martínez-Garza Á (2005) Variación de contenido de flavonoides en hojas de guayaba en condiciones de estrés. Revista Chapingo Serie Horticultura XI (1): 89-92; doi: 10.5154/r.rchsh.2004.02.014
Recibido: 23-11-2016
Aceptado: 09-01-2017
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
