Artículo original
Biotecnología Vegetal Vol. 18, No. 2: 87 - 95, abril - junio, 2018
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Efecto del Vitrofural® en la calidad morfofisiológica de brotes de caña de azúcar var. C 1051-73 propagados en Biorreactores de Inmersión Temporal
Effect of Vitrofural® on morphophysiological quality of sugarcane var. C1051-73 shoots propagated in Temporary Immersion Bioreactors
Alina Martínez Rivero1, Osbel Mosqueda Frómeta2, Marcos Daquinta2, Maritza M Escalona Morgado2
1Biofábrica de Ciego de Ávila, Empresa Productora y Comercializadora de Semillas, UBB Ciego de Ávila. Carretera a Ceballos km 3 ½. Ciego de Ávila. Ciego de Ávila. Cuba. CP 65100.
2Centro de Bioplantas, Universidad de Ciego de Ávila. Carretera a Morón km 9. Ciego de Ávila. Ciego de Ávila. Cuba. CP 65100. e-mail: osbel71@gmail.com; omosqueda@bioplantas.cu
RESUMEN
La caña de azúcar (Saccharum spp.) se propaga por cultivo in vitro tanto en medio de cultivo semisólido como líquido. Este último se emplea en Biorreactores de Inmersión temporal (BIT) y se esteriliza en autoclave. El objetivo del presente trabajo fue determinar el efecto de la esterilización del medio de cultivo con Vitrofural® en la calidad morfofisiológica de brotes de caña de azúcar var. C 1051-73 propagados en BIT. Se compararó la esterilización de los medios de cultivo por autoclave (control) y esterilización química (Vitrofural®) en las fases de multiplicación, crecimiento y enraizamiento de los brotes en BIT. Al finalizar la fase de enraizamiento y previo a la fase de la aclimatización ex vitro, los brotes se individualizaron y se evaluaron las variables: número de brotes por explante, longitud de los brotes (cm), número de hojas por brote, número de raíces, longitud de la raíz más larga (cm), masa fresca y seca de los brotes y las hojas. La propagación in vitro de caña de azúcar var. C1051-73 fue posible en BIT con el uso de Vitrofural® para la esterilización química del medio de cultivo. No se observaron síntomas de fitotoxicidad del Vitrofural® sobre los brotes. Se encontraron valores significativamente superiores para las variables evaluadas en todas las fases de la micropropagación desarrolladas en BIT donde se utilizó el medio de cultivo que contenía Vitrofural®. La esterilización química con Vitrofural® de los medios de cultivo para la propagación in vitro de caña de azúcar var. C1051-73 en Biorreactores de Inmersión temporal favorece la calidad morfofisiológica de los brotes.
Palabras clave: esterilización química, medios de cultivo, micropropagación, Saccharum
ABSTRACT
Sugarcane (Saccharum spp.) is propagated by in vitro culture in both semi-solid and liquid culture media. The last one is used in temporary immersion bioreactors (BIT) and sterilized in autoclave. The objective of this work was to determine the effect of sterilization of the culture medium with Vitrofural® on the morphophysiological quality of sugarcane var. C 1051-73 shoots propagated in BIT. It was compared the sterilization of the culture media by autoclaving (control) and chemical sterilization (Vitrofural®) in the stages of multiplication, growth and rooting of the shoots in BIT. At the end of the rooting stage and prior to the ex vitro acclimatization stage, the shoots were individualized and the variables: number of shoots per explant, length of shoots (cm), number of leaves per shoot, number of roots , length of the longest root (cm), fresh and dry mass of shoots and leaves were evaluated. It was possible the in vitro propagation of sugarcane var. C1051-73 in BIT with the use of Vitrofural® for the chemical sterilization of the culture medium. No phytotoxicity symptoms of Vitrofural® were observed on the shoots. Significantly higher values were found for the variables evaluated in all the stages of the micropropagation developed in BIT where the culture medium containing Vitrofural® was used. The chemical sterilization with Vitrofural® of the culture media for in vitro propagation of sugarcane var. C1051-73 in temporary immersion bioreactors improve the morphophysiological quality of the shoots.
Keywords: chemical sterilization, culture media, micropropagation, Saccharum
INTRODUCCIÓN
En el cultivo de caña de azúcar (Saccharum spp.), la forma de propagación más empleada a nivel comercial es a través de estacas por seccionamiento del tallo. Este sistema de multiplicación tiene como principal deficiencia el empleo de grandes extensiones de tierra que se necesitan para fomentar los distintos bancos de semillas establecidos. El tallo que se planta podría ser aprovechado también en el proceso productivo y aumentaría los rendimientos. También la alta incidencia de plagas y enfermedades afectan los rendimientos del cultivo. Es por ello que la producción de semillas resulta importante, ya que se preserva el material genético, sirve como base para la posterior producción a gran escala y para mantener plantaciones saludables (Pérez et al., 2013).
La micropropagación de caña de azúcar es una importante alternativa y una herramienta de gran beneficio por el elevado número de plantas que se obtienen en corto tiempo. Además, tiene la ventaja de proporcionar plantas libres de patógenos y rejuvenecidas con gran calidad genética y fitosanitaria. Puede ser empleada tanto para la producción de semillas como para la introducción de nuevas variedades o la sustitución por otras ante problemas sanitarios (Arellano et al., 2009; Castañeda et al., 2014).
En Cuba, el uso de la inmersión temporal en la propagación in vitro de caña de azúcar se inició por Lorenzo et al. (1998). Otros autores que han empleado este método de cultivo también han demostrado que favorece la tasa de multiplicación y la calidad morfológica de los brotes así como la supervivencia en el ambiente ex vitro (Rodríguez et al., 2008; Medeiros de Araujo et al., 2015). En este sentido, la producción de plantas con el empleo de Biorreactores de Inmersión Temporal (BIT) constituye una herramienta eficaz para la propagación in vitro con la cual se elevan los coeficientes de multiplicación y se aumenta la calidad del material vegetal propagado (Escalona et al., 1999; Aragón et al., 2005; Cejas et al., 2011; Mosqueda et al., 2017; Vives et al., 2017).
Por otra parte, en el cultivo in vitro, el empleo de la esterilización por calor húmedo mediante la autoclave es una práctica generalizada. Sin embargo, muchos de los componentes del medio de cultivo se desnaturalizan (compuestos con actividad biológica), lo que afecta el desarrollo de las plantas y no se logra evitar que aparezcan microorganismos contaminantes varios días después de haberse esterilizado el medio de cultivo (Castañedo et al., 1999).
Con el objetivo de disminuir la contaminación microbiana de los explantes en todas las fases del cultivo in vitro, se ha empleado con buenos resultados el Vitrofural® (2-bromo-5-(2-bromo-2-nitrovinil)-furano) (http://www.cbq.uclv.edu.cu/es/producto/5/) que se obtiene a partir del furfural de la caña de azúcar, un aditivo químico que se desarrolló en Cuba, en el Centro de Bioactivos Químicos (CBQ) de la Universidad Central Marta Abreu de Las Villas (Castañedo et al., 1999).
El esterilizante químico Vitrofural® se incorpora a los medios de cultivo para eliminar los contaminantes microbianos (Castañedo et al., 1999; Quiala et al., 2002) y es una práctica generalizada en las biofábricas cubanas y en otros laboratorios comerciales a nivel internacional (Orlikowska et al., 2012).
También ha sido utilizado en la propagación de piña (Ananas comosus L.) en Biorreactores de Inmersión Temporal con la consecuente reducción de los contaminantes microbianos, incrementos de la tasa de multiplicación y mejoramiento de la calidad morfofisiológica de los brotes en comparación con los medios de cultivo esterilizados con autoclave (Lovaina, 2001; Escalona et al., 2010). Sin embargo, hasta el momento, no se tiene información de la utilización de Vitrofural®, en la propagación in vitro de caña de azúcar con el empleo de Biorreactores de Inmersión Temporal. Con la incorporación de este agente antimicrobiano en la esterilización de los medios de cultivo se podría mejorar la calidad morfofisiológica de los brotes de caña de azúcar. Atendiendo a lo anterior, el objetivo del presente trabajo fue determinar el efecto de la esterilización del medio de cultivo con Vitrofural® en la calidad morfofisiológica de brotes de caña de azúcar var. C 1051-73 propagados en Biorreactores de Inmersión Temporal (BIT).
MATERIALES Y MÉTODOS
Los experimentos se desarrollaron en el Laboratorio de Cultivo de Células y Tejidos del Centro de Bioplantas, Universidad Máximo Gómez Báez de Ciego de Ávila.
Material vegetal
Se utilizaron plantas in vitro de caña de azúcar variedad C1051-73 procedentes del Banco de Semillas Básico de Jovellanos, Matanzas. Los brotes provenían de la fase de multiplicación y tenían entre cuatro y seis subcultivos.
Medios de cultivo
En todos los experimentos se empleó la composición basal del medio de cultivo propuesto por Murashige y Skoog (1962). Para la multiplicación de los brotes en BIT se utilizó el medio de cultivo propuesto por Lorenzo et al. (1998). El pH de los medios de cultivo se ajustó a 5.8 antes de la esterilización en autoclave a 121°C y 1.2 kg cm-2 y antes de la adición del Vitrofural®. El tiempo de esterilización estuvo en dependencia del volumen del medio de cultivo (Burger, 1988). La composición específica de los medios de cultivo en las tres fases de la micropropagación en estudio: multiplicación, crecimiento y enraizamiento de los brotes en el BIT se describen posteriormente.
Para la preparación de los medios de cultivo con Vitrofural® se siguió el procedimiento indicado por los fabricantes (CBQ, Villa Clara, Cuba). La homogenización del producto en el medio de cultivo líquido se logró por calentamiento (80 °C) previo a su adición a los BIT.
Condiciones de cultivo
Se emplearon Biorreactores de Inmersión Temporal (BIT) propuestos por Escalona et al. (1999) y Escalona et al. (2003). El sistema consistió de dos recipientes de vidrio de un litro de capacidad, mangueras de silicona, filtros hidrofóbicos de 0.2 µm, electroválvulas y un compresor de aire. Un frasco se utilizó para el cultivo de los explantes y el otro para el medio de cultivo líquido. Ambos frascos se conectaron a través de las mangueras de silicona. Las condiciones de esterilidad se lograron mediante el empleo de filtros hidrofóbicos de 0.2 µm. Se colocaron en estantes de aluminio de 0.7 m de ancho x 2.3 m de largo x 2.5 m de alto. Cada piso en el estante contó con un panel de luces (blancas fluorescentes) que garantizaron un Flujo de Fotones Fotosintético (FFF) entre 30 y 40 µmol m-2 s-1 y un fotoperiodo de 16 horas luz y 8 horas oscuridad.
La frecuencia y el tiempo de inmersión se controlaron a través de un autómata y en la experimentación fue de ocho frecuencias por día con cuatro minutos de duración (Lorenzo et al., 1998).
La esterilización de los BIT fue de 40 minutos a 1.2 kg cm-2 de presión en autoclave (marca LDZX -75KBS) y 121 °C (Burger, 1988). La temperatura del cuarto de cultivo fue de 25 °C. Se colocaron diez explantes (un brote axilar con dos brotes pequeños) con una longitud de 4 cm aproximadamente, en los BIT de 1000 ml de capacidad, los cuales contenían 500 ml de medio de cultivo líquido (50 ml por explantes).
Efecto del tipo de esterilización del medio de cultivo sobre la calidad morfofisiológica de los brotes
Con el objetivo de determinar el efecto de la esterilización del medio de cultivo sobre la calidad morfofisológica de brotes de caña de azúcar en las fases de la micropropagación desarrolladas en el BIT (multiplicación, crecimiento y enraizamiento), se compararon dos procedimientos de esterilización de los medios de cultivo: esterilización por autoclave (control) y esterilización química (Vitrofural®) (Figura 1).

En las fases de multiplicación y crecimiento de los brotes de caña de azúcar en el BIT, se utilizó el protocolo propuesto por Lorenzo et al. (1998). El medio de cultivo utilizado fue el de Murashige y Skoog (1962) (MS), con 0.3 mg l-1 de Benciladenina (BA) y 1 mg l-1 de Paclobutrazol (PBZ). La duración de la fase de multiplicación fue de 28 días. La fase de crecimiento de los brotes se realizó en el mismo BIT sólo que se cambió el frasco de medio de cultivo por otro con la misma composición del medio de cultivo MS, con 1 mg l-1 de Ácido Giberélico (AG3). La duración de esta fase fue de 15 días.
El enraizamiento de los brotes se realizó en el mismo BIT, pero en esta fase se procedió a variar la composición del medio de cultivo (reducción de las sales MS al 50% y sacarosa 40 g l-1) y se adicionó Ácido Naftalenacético (ANA) 1 mg l-1 (Nápoles et al., 2017). El volumen de medio de cultivo para esta fase fue de 750 ml para garantizar la inmersión completa de todos los brotes y la duración fue de 15 días.
Al finalizar la fase de enraizamiento, y previo a la fase de la aclimatización ex vitro, los brotes se individualizaron y se realizaron las siguientes evaluaciones: número de brotes por explante, longitud de los brotes (cm) medidos desde la base hasta la inserción de la última hoja, número de hojas por brote, número de raíces, longitud de la raíz más larga (cm).
La masa fresca de los brotes se determinó mediante el pesaje en balanza (SARTORIUS TE 412) y se expresó en gramos. Para la masa seca los brotes se secaron en estufa (HS 62A) a 70 °C durante 72 h; después de este tiempo se determinó la masa a peso constante y se expresó en gramos.
Se emplearon tres BIT por tratamiento con diez explantes iniciales cada uno para un total de 30 explantes por tratamiento.
Análisis estadístico
Se utilizó el programa SPSS (versión 11.5 para Windows). Los datos fueron sometidos a la prueba de normalidad (Kolmogorov-Smirnov) y a la prueba de homogeneidad de varianzas (Levene). En el caso de que las variables no cumplían con uno de los criterios señalados con anterioridad se procedió a la transformación de los datos. El tipo de transformación se explica en cada una de las tablas y/o figuras. Se realizó el análisis a partir de la prueba t de Student para experimentos monofactoriales con dos niveles y prueba de rangos múltiples de Tukey para valores de p<0.05. Los datos de variables discretas se transformaron con la ecuación x`=(x+0.5)1/2.
RESULTADOS Y DISCUSIÓN
Efecto del tipo de esterilización del medio de cultivo sobre la calidad morfofisiológica de los brotes
La propagación in vitro de caña de azúcar var. C1051-73 fue posible en BIT con el uso de Vitrofural® para la esterilización química del medio de cultivo. No se observaron síntomas de fitotoxicidad del Vitrofural® sobre los brotes que se mantuvieron de color verde intenso como en el control de esterilización por autoclave. Tampoco se detectó la presencia de contaminantes microbianos en el medio de cultivo en las fases de la micropropagación evaluadas.
Se encontraron valores significativamente superiores para las variables evaluadas en todas las fases de la micropropagación desarrolladas en BIT donde se utilizó el medio de cultivo que contenía Vitrofural® en comparación con el tratamiento que empleó el medio de cultivo esterilizado por autoclave, lo cual coincidió con los resultados informados en piña por Escalona et al. (2010). En este sentido, en la fase de multiplicación el uso del Vitrofural® no solo fue efectivo para la estilización química del medio de cultivo, sino que además influyó positivamente en la multiplicación de los brotes (Figura 2).
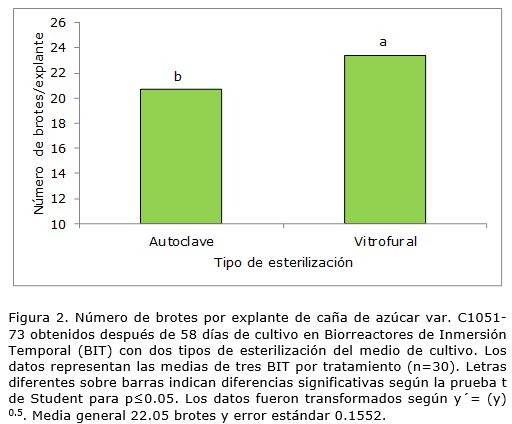
Por otra parte, las ventajas de los BIT en la propagación in vitro en diferentes cultivos es bien conocida. Por ejemplo, en pistacho (Pistacia vera L.) (Akdemir et al., 2014), Chrysanthemun (Hahn y Paek, 2005), bananos (Basail et al., 2013), en Psidum guajava (Nápoles et al., 2015), entre otros. También en caña de azúcar se han logrado incrementos de la tasa de multiplicación (Lorenzo et al., 1998; Yadav et al., 2014; Medeiros de Araujo et al., 2015). Sin embargo, los resultados demostraron que la aplicación del Vitrofural®, además de eliminar la necesidad del uso de autoclave para la esterilización de los medios de cultivo aumentó el número de brotes en esta variedad.
De igual forma, en la longitud de los brotes (Figura 3 A) y el número de hojas por brote (Figura 3 B), se observó que el tipo de esterilización tuvo influencia. La esterilización química con Vitrofural® fue la de mejores resultados, con diferencias significativas con respecto al tratamiento de esterilización por autoclave.
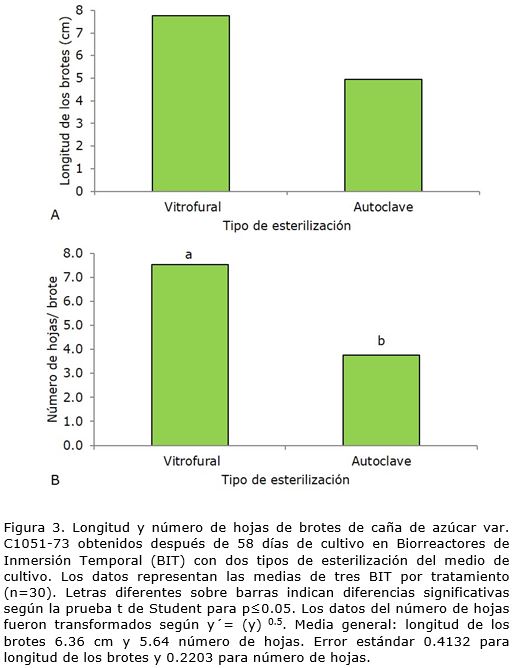
En el cultivo en inmersión temporal de caña de azúcar Lorenzo et al. (1998) en esta misma variedad, informaron un aumento en la longitud de los brotes en comparación con el medio de cultivo semisólido. Un resultado similar se obtuvo cuando se utilizó el Vitrofural® al aumentar la longitud y número de hojas de los brotes pero con diferencias significativas para estas variables en el tratamiento de la esterilización del medio de cultivo con Vitrofural®.
Al igual que para las variables anteriores, los brotes que se mantuvieron expuestos a la acción del medio de cultivo esterilizado con Vitrofural® lograron los mejores resultados en cuanto al número y longitud de las raíces, con diferencias significativas con respecto al tratamiento de esterilización por autoclave (Figura 4 A, Figura 4 B).
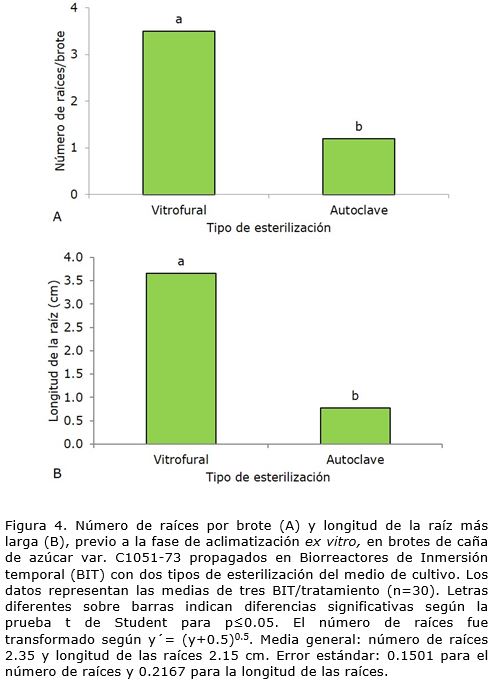
En la micropropagación de la caña de azúcar en inmersión temporal Lorenzo et al. (1998) realizaron la individualización de los brotes y posterior enraizamiento en frascos convencionales con medio de cultivo líquido por lo cual no informaron el efecto de la inmersión temporal en la formación de raíces. Más adelante, Nápoles et al. (2017) propusieron una modificación del medio de cultivo con la reducción de las sales MS al 50%, sacarosa 40 g l-1 y 1 mg l-1 de ANA para mejorar la calidad de los brotes y aumentar su supervivencia a las condiciones ex vitro. En el presente estudio se siguió el procedimiento establecido por dichos autores, sin embargo se logró una mayor formación de raíces cuando se empleó el medio de cultivo esterilizado con Vitrofural®.
Al analizar la masa fresca y seca de los brotes y de las hojas de cada brote por separado, previo a la fase de aclimatización ex vitro, se encontraron diferencias significativas para ambos tipos de esterilización del medio de cultivo (Tabla 1). Los brotes que se cultivaron desde la fase de multiplicación al enraizamiento in vitro en BIT con el medio de cultivo esterilizado con Vitrofural® mostraron resultados superiores al tratamiento de esterilización por autoclave. En este sentido, la masa seca de los brotes, fue ocho veces superior al tratamiento de esterilización con autoclave y la masa seca de las hojas fue de 5.5 veces superior a dicho tratamiento. La calidad que presentan los brotes en el cultivo in vitro es un factor importante para su posterior supervivencia al ambiente ex vitro (Aragón et al., 2010) En general, los brotes de caña de azúcar que enraizaron en BIT en el medio de cultivo esterilizado con Vitrofural® presentaron los mejores indicadores morfofisiológicos de calidad.
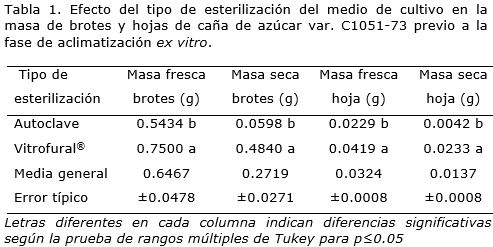
Al analizar estos resultados, podría considerarse que el Vitrofural® unido al intercambio gaseoso que se logra en el BIT permite condiciones que favorecen el fotoautotrofismo y el consiguiente aumento de fotosintetatos lo cual se comprobó con el incremento significativo de la masa seca. Es evidente que los brotes al tener mayor masa tienen mejores condiciones para enfrentar las condiciones de estrés a las que van estar expuestos durante el tránsito in vitro- ex vitro.
El efecto favorable del tratamiento donde se empleó Vitrofural® en las variables evaluadas pudo ser debido a la no utilización de la autoclave para la esterilización del medio de cultivo. Durante este proceso las altas temperaturas provocan efectos negativos sobre los componentes del medio de cultivo, como la degradación de los azúcares, reguladores del crecimiento, aminoácidos, reducción de la calidad de los agentes gelificantes entre otros (Hurtado, 1987). Por tanto, cuando este no se utiliza, el efecto se minimiza, lo que hace que aumente la estabilidad de los componentes del medio de cultivo y posibilita que los nutrientes puedan ser aprovechados mejor por los explantes. El Vitrofural® ha sido efectivo para la esterilización química de los medios de cultivo, y ha permitido eliminar el uso de la autoclave en la micropropagación convencional a escala comercial de otros cultivos como papa (Solanum tuberosum L.), bananos (Musa spp.) y piña en medio de cultivo semisólido (Castañedo et al., 1999). Se considera que tanto el medio de cultivo como su composición son factores que determinan un adecuado crecimiento y desarrollo de los brotes en la micropropagación (Montes et al., 2016).
CONCLUSIONES
La esterilización química con Vitrofural® de los medios de cultivo para la propagación in vitro de caña de azúcar var. C1051-73 en Biorreactores de Inmersión temporal favorece la calidad morfofisiológica de los brotes.
REFERENCIAS
Akdemir H, Süzerer V, Onay A, Tilkat E, Ersali Y, Ozden Y (2014) Micropropagation of the pistachio and its rootstocks by temporary immersion system. Plant Cell, Tissue and Organ Culture 117(3): 65-76; doi:10.1007/s11240-013-0421-0
Aragón C, Escalona M, Capote M, Pina I, Cejas I, Rodríguez R, Cañal M, Sandoval J, Roels, Debergh S, González J (2005) Photosynthesis and carbon metabolism in plantain (Musa AAB) growing in Temporary Immersion Bioreactor and ex vitro acclimatization. In vitro Cellular, Developmental Biology Plant 41: 550–554; doi:10.1079/IVP2005640
Aragón C, Escalona M, Rodríguez R, Cañal M, Capote I, Pina D (2010) Effect of sucrose, light and carbon dioxide on plantain micropropagation in temporary immersion bioreactors in vitro. In vitro Cellular, Developmental Biology Plant 46(1): 89-94; doi:10.1007/s11627-009-9246-2
Arellano A, Korneva S, Fischer F, Cabanilla L, Tola N, Ochoa A, Ramos- Leal M, Pincay A (2009) Micropropagación de caña de azúcar en Ecuador. Biotecnología Vegetal 9(4): 235-238.
Basail M, Medero V, Torres M, López J, Santos A, Rayas A, Bauta M, Beovidez Y, Ortega A (2013) Nueva alternativa para la micropropagación en inmersión temporal del cultivar de plátano vianda ‘INIVITPV2011’ (AAB). Revista Colombiana de Biotecnología 15(1): 98-107
Burger W (1988) Guidelines for autoclaving liquid media used in plant tissue culture. HortScience 23(6): 1066-1068
Castañeda O, Gómez C, Trejo I, Morales V, González T, Martínez M, Gámez R, Pastelín C (2014) Aplicaciones del cultivo de tejidos vegetales en caña de azúcar. Agroproductividad 7(2): 16-21
Castañedo N, Díaz G, Agramonte D, Martín E, Salazar E, Ramírez A, Alvarado Y, González M, Cueto M, González E, Pérez J, González C, Jiménez F, Pérez M, Gutiérrez O, Ramírez D, Silveira E, Peñate E, Acosta M (1999) Empleo de sustancias de acción antimicrobiana en la esterilización química de los medios de cultivo en la micropropagación de plantas, Registro del Vitrofural en Registro Central de Plaguicidas No 013/99, Tomo 3, Folio 249. Ministerio de la Agricultura, Cuba
Cejas I, Capote I, Aragón C, Escalona M, González J, Rodrígues R, Noceda C, Caňal M, Sandoval J, Roels S, Debergh P (2011) Optimizing protocol of plantain propagation cv. CEMSA ¾ in Temporary Immersion Bioreactors. Agrociencia Uruguay 15: 13-18
Escalona M, Lorenzo J, Borroto C, Daquinta M (2003) Procedimiento y equipo para la propagación de plantas por inmersión temporal, Patente Cubana. Cuba 22947, 13/04/2004
Escalona M, Fundora Z, Aragón C, Capote I, Castañedo N, Pina D, González O (2010) Chemical sterilization for propagation of pineapple plantlets in temporary immersion bioreactor. Pineapple News 17: 9–14
Escalona M, Lorenzo JC, González B, Daquinta M, González JL, Desjardins Y, Borroto CG (1999) Pineapple (Ananas comosus L. Merr) micropropagation in temporary immersion systems. Plant Cell Report 18(9): 743-748; doi:10.1007/s002990050653
Hahn J, Paek KY (2005) Multiplication of Chrysanthemum shoots in bioreactors as affected by culture method and inoculation density of single node stems. En: Hroslef-Eide AK, Preil W (eds). Liquid culture systems for in vitro plant propagation, pp. 143-153. Springer, Berlin; doi:10.1007/1-4020-3200-5
Lorenzo JC, González B L, Escalona M, Teisson C, Espinosa P, Borroto C (1998) Sugarcane shoot formation in an improved temporary immersion system. Plant Cell, Tissue and Organ Culture 54(3): 197-200; doi:10.1023/A: 1006168700556
Lovaina T (2001) Efecto del Vitrofural G1 en la propagación in vitro de la piña (Ananas comusus (L) Merr) en Biorreactores de inmersión temporal. Tesis de maestría en Biología vegetal, Universidad de la Habana Facultad de Biología, La Habana, Cuba
Medeiros de Araujo M, Cabral E, Mota GV, Willadino L, Camara T (2015) Propagación in vitro en Sistemas de Inmersión Temporal de plantas de caña de azúcar variedad ‘RB 872552’ obtenidas de embriones somáticos. Biotecnología Vegetal 15(3): 187–191
Mosqueda O, Escalona M, Teixeira da Silva J, Pina D, Daquinta M (2017) In vitro propagation of Gerbera jamesonii Bolus ex Hooker f. in a temporary immersion bioreactor. Plant Cell, Tiss Organ Cult 129(3): 543-551; doi:10.1007/s11240-017-1186-7
Montes SM, Aguirre JML, Félix JME, Torres SMS (2016) Factores bióticos y abióticos que influyen en la aclimatación de las vitroplantas en invernadero. Dominio de las Ciencias 2(2): 63-89
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassay with tobacco tissue culture. Physiol Plant 15: 473-479; doi:10.1111/ j.1399-3054.1962.tb08052.x
Nápoles L, Escalona M, Trujillo R, Concepción O (2015) Propagación in vitro del guayabo (Psidium guajava L.) cv. EEA 18-40 con el uso de los Biorreactores de Inmersión Temporal (BIT®). Memorias del 10mo congreso Internacional de Biotecnología Vegetal. Centro de Bioplantas, Ciego de Avila; ISBN: 978959-16
Nápoles L, Cid M, Escalona M, Marrero P, Vásquez N, Concepción O (2017) Caracterización histológica del enraizamiento in vitro de brotes de caña de azúcar en medio de cultivo líquido. Biotecnología Vegetal 17(2): 113–123
Orlikowska T, Zawadzka M, Azenkteler E, Sobiczewskr P (2012) Influence of the biocides PPM™ and Vitrofural on bacteria isolated from contaminated plant tissue cultures and on plant microshoots grown on various media. Journal of Horticultural Science & Biotechnology 87(3): 223-230; doi:10.1080/14620316.2012.11512856
Pérez HI, Santana I, Rodríguez I (2013) Manejo sostenible de tierras en la producción de caña de azúcar. AZCUBA. IRÉ PRODUCTION 4: 57-78
Quiala E, Jiménez E, de Feria M, Alvarado Y, Chávez M, Agramonte D, Ramírez D, Acosta M, Pérez N, Capote A (2002) Empleo del Vitrofural en la esterilización química del endospermo artificial de los embriones somáticos encapsulados de Saccharum spp. híbrido var Cuba 87- 51. Biotecnología vegetal 2(4): 221-226
Rodríguez R, Aragón C, Escalona M, González J, Desjardins Y (2008) Carbon metabolism in leaves of micropropagated sugarcane during acclimatization phase. In Vitro Cell Dev Biol Plant 44: 533-539
Vives K, Andújar I, Lorenzo JC, Concepción O, Hernández M, Escalona M (2017) Comparison of different in vitro micropropagation methods of Stevia rebaudiana B. including temporary immersion bioreactor (BIT®). Plant Cell, Tissue and Organ Culture (PCTOC) 131(1): 195-199; doi:10.1007/s11240-017-1258-8
Yadav S, Ahmad A, Rastogi J, Lal M (2014) Effect of propagule trimming on shoot multiplication rate in sugarcane micropropagation. J Sugarcane Research 4(1): 82-85
Recibido: 31-01-2018
Aceptado: 30-03-2018
Copyright (c) 2018 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
