Artículo original
Biotecnología Vegetal Vol. 19, No. 1: 35 - 42, enero - marzo, 2019
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Influencia de maltosa y sacarosa en la maduración de embriones somáticos de Glycine max cv. 'Incasoy-27'
Influence of maltose and sucrose on somatic embryos maturation of Glycine max cv. 'Incasoy-27'
Jorge Pérez Pérez1,2*, Lourdes R García2, Novisel Veitía2, Idalmis Bermúdez-Caraballoso2, Raúl Collado2, Berkis Roque2
1Centro de Estudios de Biotecnología Vegetal, Universidad de Granma. Carretera a Manzanillo km 17,5 Peralejo. Bayamo. Granma. Cuba. CP 85100.
2Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.
*Autor para correspondencia: e-mail: jperez@udg.co.cu
RESUMEN
La embriogénesis somática en el cultivo de soya (Glycine max) tiene como limitante el bajo porcentaje de conversión a planta que se obtiene, atribuido a la presencia de embriones somáticos con morfologías anormales durante la fase de maduración. Este trabajo tuvo como objetivo determinar la influencia de maltosa y sacarosa en la maduración de embriones somáticos de soya cultivar 'Incasoy-27'. Se empleó un medio de cultivo que contenía como fuentes de carbono maltosa o sacarosa 6.0% y carbón activado. Los embriones se colocaron en cámara de crecimiento con luz solar durante ocho semanas. Se logró en presencia de la maltosa, el mayor porcentaje de embriones somáticos maduros con morfología dicotiledonal (29.75%). El empleo de la sacarosa, incrementó el número de embriones somáticos con morfologías anormales en forma de tipo trompeta, fasciados, fusionados, cotiledón rudimentario e hipocótilo largo. Estos resultados indicaron que la fuente de carbono influye en la maduración de los embriones somáticos de soya cultivar 'Incasoy-27'. Los embriones somáticos cultivados con maltosa, incrementan las morfologías de tipo dicotiledonal, monocotiledonal y policotiledonal, con desarrollo de los meristemos apical y radical.
Palabras clave: cultivo de tejidos, in vitro, osmótico, regeneración, soya
ABSTRACT
The somatic embryogenesis in soybean crop (Glycine max)has as limitation the low percentage of conversion to plant that is obtained, attributed to the presence of somatic embryos with abnormal morphologies during the maturation phase. This work aim was to determine the influence of maltose and sucrose on somatic embryos maturation of soybean cultivar 'Incasoy-27'. A culture medium containing 6.0% maltose or sucrose and activated carbon as carbon sources was used. The embryos were placed in sunlight growth chamber for eight weeks. The higher percentage (29.75%) of mature somatic embryos with dicotyledonal morphology was achieved when maltose was used. The use of sucrose increased the number of somatic embryos that showed abnormal morphologies as trumpet shape, fasciated, fused, rudimentary cotyledon and long hypocotyl type. These results indicated that carbon source influences the maturation of soybean somatic embryos cultivar 'Incasoy-27'. The somatic embryos cultivated in maltose, increase the morphologies dicotyledonal shape, monocotyledonal and polycotyledonal type, with development of apical and radical meristems.
Keywords: in vitro, osmotic, regeneration, soy, tissue culture
INTRODUCCIÓN
La soya [Glycine max (L.) Merrill] es uno de los cultivos de mayor importancia a nivel mundial debido a su alto contenido de proteínas y aceites en sus semillas. No obstante, es susceptible a diversos factores de estrés bióticos y abióticos (Mariashibu et al., 2013).
Además, el desarrollo de programas de mejora genética con empleo de la hibridación, han sido limitados debido a que es un cultivo que se autopoliniza y en consecuencia tiene un bajo potencial de variabilidad genética (Souza et al., 2014; Raza et al., 2017).
A nivel internacional muchos de los trabajos de mejoramiento genético en soya, están dirigidos al uso de las técnicas de cultivo de tejidos e ingeniería genética. Sin embargo, un prerrequisito para el empleo de estas técnicas, es disponer de un procedimiento que permita la regeneración de plantas in vitro. En este sentido, la embriogénesis somática es considerada uno de los métodos más eficientes para obtener plantas, aunque diferentes estudios han encontrado diferencias en la respuesta embriogénica entre los cultivares de soya (Huynh et al., 2017; Pathak et al., 2017).
Existen protocolos que describen una respuesta eficiente durante las fases de formación y multiplicación de embriones somáticos, no así durante la maduración y germinación, que resultan en una baja frecuencia de conversión de los embriones somáticos en plantas (Huynh et al., 2017). Entre los factores que determinan la capacidad de los embriones somáticos de convertir a plantas, se encuentran la acumulación de sustancias de reservas y tolerancia a la desecación (Mata et al., 2016).
En este sentido, la fuente de carbono juega un papel primordial durante la fase de maduración de los embriones somáticos, al actuar tanto como fuente de nutrientes como agente osmótico en el medio de cultivo. Por tal motivo, el objetivo de este trabajo fue determinar la influencia de maltosa y sacarosa en la maduración de los embriones somáticos de soya cultivar 'Incasoy-27'.
MATERIALES Y MÉTODOS
El trabajo se realizó en el Instituto de Biotecnología de las Plantas en Santa Clara, Villa Clara, Cuba. Se empleó el cultivar cubano de soya 'Incasoy-27', obtenido en el Instituto Nacional de Ciencias Agrícolas (INCA), Mayabeque, Cuba, mediante hibridación natural en el genotipo brasileño BR-32.
Material vegetal
Se emplearon embriones somáticos en etapa globular procedentes del medio de cultivo de multiplicación (Wright et al., 1991), y cultivados en cámara de crecimiento con luz solar e intensidad de flujo de fotones fotosintéticos entre 50.0 a 65.0 µmol m-2 s-1 durante 21 días, según el procedimiento obtenido por Pérez et al. (2012).
Medios de cultivo
Los embriones somáticos fueron colocados en placas de Petri (100 x 20 mm) que contenían 10 ml de medio de cultivo de maduración (Bailey et al., 1993), con las sales MS (Murashige y Skoog, 1962), vitaminas B5, carbón activado 0.5%, pH 5.8 y Gelrite® 0.3%. Como fuente de carbono se incluyó: maltosa (6.0%) o sacarosa (6.0%), las cuales constituyeron los dos tratamientos objeto de investigación.
Condiciones de cultivo
El experimento se desarrolló en cámara de crecimiento con empleo de la luz solar, con una duración del período luminoso de 12 a 13 horas de luz y una intensidad de flujo de fotones fotosintéticos entre 68.0 a 72.0 µmol m-2 s-1 a 26±1°C.
A los 28 días de cultivo los embriones somáticos fueron individualizados y transferidos a medio de cultivo fresco, por igual periodo de tiempo.
Histología
Para realizar los cortes histológicos, los embriones somáticos fueron colocados en una solución de fijación que contenía formaldehído al 37.0%, ácido acético glacial 100% y etanol 70.0%, en proporción 5:5:90 durante 24 horas. La deshidratación de las muestras se realizó mediante inmersión en un gradiente ascendente, que inició con etanol 70.0% hasta llegar al etanol absoluto, e inclusión en bloques de parafina (Kraus y Arduin, 1997).
Se realizaron cortes longitudinales de 10.0 µm de espesor, con un micrótomo rotatorio (Heidelberg, Alemania); luego fijados en portaobjetos y teñido con safranina o Fast green 0.5%. Las imágenes de las secciones histológicas fueron tomadas con una cámara digital acoplada a un microscopio óptico (Axioskop, Alemania) 400x.
Para el desarrollo de este experimento se utilizó un diseño completamente al azar. Después de 28 días de cultivo, se cuantificó el número de embriones somáticos por tipo de morfología (%), con ayuda de un microscopio estereoscópico (Olympus, Japón) (100x). Además se evaluó el grado de madurez de los embriones somáticos a partir de los cambios en la morfología celular mediante cortes histológicos.
Análisis estadístico
Para determinar las diferencias de respuesta a las dos fuentes de carbono, se empleó la prueba de Mann Whitney (p<0.05), previa comprobación de que los datos no cumplían los supuestos de normalidad y homogeneidad de varianza. Se empleó el programa estadístico SPSS (Statistic Package for Social Science) versión PASW Statistics 18.
RESULTADOS
Se encontró que tanto la sacarosa como la maltosa influyeron en la maduración de los embriones somáticos de soya cultivar 'Incasoy-27’. En ambas fuentes de carbono, los embriones somáticos desarrollaron diferentes variaciones en su morfología. Sin embargo, cuando se utilizó maltosa se logró mayor porcentaje de embriones somáticos maduros con morfología normal (dicotiledonal), y con diferencias significativas con el tratamiento que incluyó la sacarosa (Tabla 1).
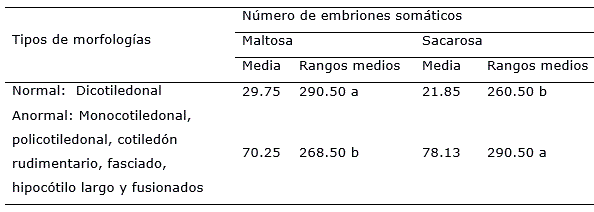
Tabla 1. Efecto de la maltosa y la sacarosa en el porcentaje de embriones somáticos maduros por tipo de morfología en soya 'Incasoy-27’ a los 28 días de cultivo.
Aunque en las dos fuentes de carbono se observaron embriones somáticos maduros con morfologías de tipo anormal, en presencia de maltosa se encontraron los mayores porcentajes (40.5%) que correspondieron a los monocotiledonales y policotiledonales, los cuales difirieron significativamente de los porcentajes para estos tipos de morfologías (30.1%) en el medio de cultivo con sacarosa (Figura 1).
Con el uso de sacarosa también se incrementó el porcentaje de embriones somáticos maduros de tipo trompeta, fasciado, fusionados, cotiledón rudimentario e hipocótilo largo, los cuales prácticamente duplicaron a los obtenidos en presencia de maltosa, con diferencias significativas entre ambos tratamientos (Figura 1).

Figura 1. Porcentaje de embriones somáticos maduros con morfología anormal en medio de cultivo con maltosa o sacarosa a los 56 días de cultivo.
Los embriones somáticos desarrollaron las diferentes etapas de desarrollo, siendo visibles la etapa globular, torpedo y cotiledonal, además presentaron un color verde pálido que luego se tornó de color crema. Además presentaban una consistencia dura, y los que tenían una simetría bilateral (dicotiledonal), en su totalidad contaban con los meristemos caulinar y radical (Figura 2 A y B). Sin embargo, en el tratamiento que incluyó la sacarosa los embriones somáticos eran más vigorosos.
En el tratamiento con maltosa los embriones somáticos tenían un tamaño inferior a un centímetro de longitud, con predominio de morfologías anormales pero con capacidad para germinar al contar con el desarrollo de ambos meristemos. Entre estas morfologías se encontraban los tipos policotiledonal (Figura 2 C), monocotiledonal (Figura 2 D) y el denominado cotiledón rudimentario (Figura 2 E); estos últimos aunque tenían un desarrollo dicotiledonal no llegaron a desarrollar uno de los cotiledones en su totalidad.
Los embriones somáticos con menor presencia en ambos tratamientos, fueron los que presentaron morfología del tipo hipocótilo largo (Figura 2 F). Estos se caracterizaron por contar con el meristemo caulinar pero en ningún caso tuvieron formación del meristemo radical. En las morfologías tipo fasciado (Figura 2 G) y trompeta (Figura 2 H), no hubo formación de los meristemos; mientras que los que tenían los cotiledones fusionados, solo desarrollaron del meristemo radical (Figura 2 I).
Los análisis histológicos también confirmaron la existencia de embriones somáticos en la etapa de desarrollo cotiledonal, con formación de ambos primordios cotiledonales y el meristemo caulinar (Figura 2 I). De igual manera, se observó que había ocurrido una expansión de las células y el desarrollo de vacuolas (Figura 2 K), propicio para la acumulación de sustancia de reserva durante el proceso de maduración de los embriones somáticos.
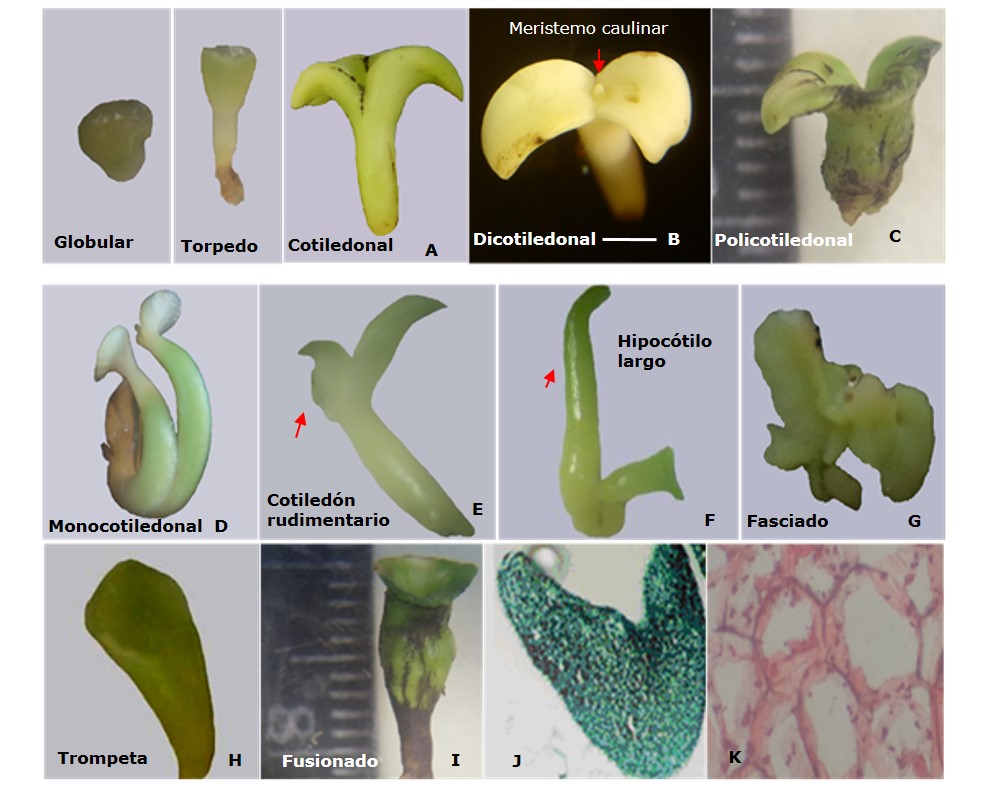
Figura 2. Morfologías de los embriones somáticos de soya cultivar 'lncasoy-27' en medio de cultivo de maduración a los 56 días de cultivo. (A) Embriones somáticos en diferentes etapas de desarrollo. (B) Embrión somático con morfología normal. (C-I) Embriones somáticos con morfologías de tipo anormales. (J) Sección histológica de embrión somático diferenciado en etapa cotiledonal teñido con Fast Green 0.5% (400x). (K) Corte histológico en embrión somático maduro teñido con safranina 0.5% (400x). Barra= 1.0 mm
DISCUSIÓN
Los tejidos vegetales cultivados in vitro generalmente son heterótrofos, debido a que se les proporciona una fuente de carbono en los medios de cultivo (Kouadio et al., 2018). Por ello, su tipo y concentración, juegan un rol importante en el desarrollo de procesos morfogenéticos como la embriogénesis somática y organogénesis. Al respecto, Sarkar y Roy (2015), plantearon que la mayoría de los medios de cultivo contienen sacarosa como principal fuente de carbono y energía, pero también se ha empleado fructosa, manitol, sorbitol y maltosa.
El efecto beneficioso de la maltosa en la maduración de embriones somáticos en soya, pudiera ser debido a que el bajo metabolismo de este compuesto produce una cierta concentración de oxígeno que permite el desarrollo de los embriones somáticos. Además, la baja hidrólisis de la maltosa con respecto a la sacarosa, pudiera implicar un descenso de los carbohidratos dentro de la célula que provoca una reorientación en los programas de desarrollo a nivel genético; o que la propia molécula de maltosa tiene un efecto específico sobre la reorientación de estos programas (Yaseen et al., 2013). Por el contrario, la sacarosa es hidrolizada por las invertasas de la pared celular, hasta formar glucosa y fructosa antes de entrar en la célula donde es metabolizada (Sarkay y Roy, 2015).
En el presente trabajo la maltosa también tuvo un efecto favorecedor ya que se obtuvo un 29.0% de embriones somáticos con morfología dicotiledonal. Este resultado es superior al obtenido por Bailey et al. (1993), quienes al emplear un medio de cultivo que también contenía como fuente de carbono maltosa 6.0%, lograron 25.0% de embriones somáticos con morfología de tipo dicotiledonal en el cultivar PI417138.
Al comparar ambas fuentes de carbono se evidenció, que en presencia de sacarosa los embriones somáticos eran más vigorosos respecto a los formados en maltosa. Esto pudiera estar relacionado con el genotipo y su capacidad para la absorción de dicho agente osmótico del medio de cultivo. Una descripción similar fue realizada por Schmidt et al. (2005), al comparar el efecto de maltosa y sacarosa en la maduración de embriones somáticos de soya, pero en medio de cultivo líquido. Según estos autores, los embriones somáticos cultivados en maltosa necesitaron más tiempo para alcanzar la madurez fisiológica, pero tuvieron el doble de eficiencia de conversión que los cultivados en sacarosa. Esto último pudo haber estado relacionado con las morfologías desarrollas.
En el medio de cultivo que contenía maltosa 6.0% se obtuvo entre 7.1 a 10.0% de embriones somáticos con morfologías de tipo trompeta, cotiledones fusionados e hipocótilo largo. Estos valores fueron inferiores a los referidos por Hiraga et al. (2007) en seis cultivares japoneses de soya. Según estos autores al emplear este agente osmótico a igual concentración, observaron entre 15.0 y 40.0% de embriones somáticos con estos tipos de morfologías.
En el presente trabajo se encontraron embriones somáticos con morfologías de tipo fasciada y trompeta, sin desarrollo del meristemo apical. Al respecto, Hiraga et al. (2007), refieren que los embriones somáticos con morfología fasciada, son capaces de formar el meristemo radical pero nunca desarrollan el meristemo caulinar. De igual forma, los que tienen forma de trompeta, aunque tienen un procambium bien definido (Fernando et al., 2002; Santos et al., 2006), el pobre desarrollo del meristemo caulinar afecta la eficiencia de germinación y conversión a planta como ha sido descrito previamente en el cultivar de soya INCASoy-27 (Pérez et al., 2017).
Los resultados descritos en la presente investigación son comparables con los informados previamente por Bermúdez-Caraballoso et al. (2011), quienes refieren la presencia de embriones somáticos con morfologías anormales en los cultivares cubanos INCASoy-1, INCASoy-27 y el cultivar William-82 de origen norteamericano. No obstante, estos autores obtuvieron un 15% de embriones somáticos con morfologías anormales, un valor inferior al observado en este trabajo, atribuido a que en su mayoría fueron excluidos del conteo.
Es posible que la diversidad de morfologías de los embriones somáticos, esté relacionada con un efecto acumulativo de las altas concentraciones de ácido 2,4-diclorofenoxiacético (2,4-D), utilizadas en los medios de cultivo de formación (40 mg l-1) y multiplicación (20 mg l-1) de embriones somáticos de soya. En este sentido, Liu et al. (1993), indicaron que los cambios en la simetría bilateral de los embriones somáticos, pueden ser causados por factores endógenos como los inhibidores del transporte polar de las auxinas durante el desarrollo del embrión somático. La continua exposición del tejido a las altas concentraciones de 2,4-D, interfiere con el gradiente de auxina polar que se establece en la embriogénesis somática, y bloquea la expresión de los genes involucrados en la transición del patrón de simetría en el eje apical-basal durante el paso de los embriones somáticos de la etapa globular a corazón.
Similar a los resultados de este estudio, los autores, Huynh et al. (2015) y posteriormente Huynh et al. (2017), obtuvieron la mayor eficiencia en la maduración de los embriones somáticos al emplear 6.0% de maltosa y carbón activado (0.5%), lo que favoreció la morfología de embriones somáticos en comparación a cuando se utilizó sacarosa como fuente de carbono en el medio de cultivo. En su informe, refieren que el carbón activado pudo haber absorbido el 2,4-D del medio de cultivo y favorecer el desarrollo de embriones somáticos con una morfología normal.
Por otro lado, los cortes histológicos demostraron la existencia de vacuolas y la expansión celular, durante el proceso de maduración de los embriones somáticos, elementos que permitieron confirmar la ocurrencia de cambios en la composición de las células. Autores como Schmidt et al. (2005) y Nishizawa e Ishimoto (2009), plantearon que durante esta etapa del desarrollo del embrión somático en soya, también ocurren cambios en la concentración de sustancias de reservas como proteínas y aceites. En este sentido, He et al. (2011), encontraron mayor acumulación de proteínas, azúcares solubles, almidón y lípidos en embriones somáticos de soya cultivar Jack, en los primeros 21 días en medio de cultivo de maduración. Sin embargo, la cantidad de lípidos como ácidos palmítico y esteárico aumentaron, mientras que el de linoléico y linolénico, declinó al final del período de cultivo, atribuido a una remobilización o degradación durante la senescencia, como ocurre en otros tejidos vegetales.
El cambio de color de los embriones somáticos en el cultivar INCASoy-27, fue otro elemento que permitió demostrar la ocurrencia de cambios morfo-fisiológicos. Esta variable, también se ha empleado en otras investigaciones para determinar la madurez fisiológica de los embriones somáticos. Según lo descrito por Schmidt et al. (2005), los embriones somáticos incrementan la masa fresca y alcanzan la madurez fisiológica, de igual forma cambian de color verde a amarillo y luego toman un color blanco. Esta variación también está influenciada por la fuente de carbono empleada, de manera que los embriones somáticos eran más vigorosos con empleo de la sacarosa. Atendiendo al criterio de Rahman et al. (2010), esto pudo deberse a que la rápida hidrólisis de la sacarosa a monosacáridos permite incrementar el contenido de hexosas y compuestos de almacenamiento, que estimulan la proliferación celular.
Las dificultades en la maduración de los embriones somáticos en soya, también han sido documentadas en diferentes especies vegetales como en Citrus reticulata. Un trabajo realizado por Widoretno et al. (2017), en esta especie demostró que entre los tres tipos de azúcares evaluados, la galactosa fue más efectiva que maltosa y sorbitol, en el crecimiento y desarrollo de los embriones somáticos. En sus resultados agregaron que en medio de cultivo sin adición de sorbitol, el crecimiento de los embriones somáticos fue lento y tuvieron un color rojizo. Por el contrario, además del mejor crecimiento de los embriones somáticos en medio de cultivo con galactosa o maltosa, también fueron más maduros en comparación con el tratamiento con sorbitol, y adquirieron un color amarillo verdoso o verde. Esta descripción es similar a lo observado en el presente trabajo pero en una especie leguminosa como la soya.
CONCLUSIONES
La fuente de carbono influye en la maduración de los embriones somáticos de soya cultivar ʿINCASoy-27ʾ. Los embriones somáticos cultivados con maltosa, incrementan las morfologías de tipo dicotiledonal, monocotiledonal y policotiledonal, con desarrollo de los meristemos apical y radical.
Conflicto de interés
Los autores no declaran conflicto de intereses.
REFERENCIAS
Bailey MA, Boerma HR, Parrott WA (1993) Genotype effects on proliferative embryogenesis and plant regeneration of soybean. In Vitro Cell Dev Biol-Plant 29(3): 102-108; doi:10.1007/BF02632279
Bermúdez-Caraballoso I, Blanco TS, Pérez-Pérez J, García LR, Veitía N, Collado R, Torres D, Romero C (2011) Multiplicación y germinación de embriones somáticos en las variedades cubanas de soya IS-1 e IS-27. Biotecnología Vegetal 11(1): 49-54
Fernando J, Carneiro ML, Olívio I, Appezzato-Da-Gloria B (2002) Anatomical study of somatic embryogenesis in Glycine max L. Merrill. Braz Arch Biol Technol 45(3): 277-286; doi:10.1590/S1516-89132002000300005
He Y, Young TE, Clark KR, Kleppinger-Sparace KF, Bridges WC, Sparace SA (2011) Developmental profile of storage reserve accumulation in soybean somatic embryos. In Vitro Cell Dev Biol-Plant 47(6): 725-733; doi:10.1007/s11627-011-9375-2
Hiraga S, Minakawa H, Takahashi K, Takahashi R, Hajika M, Harada K, Ohtsubo N (2007) Evaluation of somatic embryogenesis from immature cotyledons of Japanese soybean cultivars. Plant Biotechnology 24(4): 435-440; doi:10.5511/plantbiotechnology.24.435
Huynh HN, Lal SK, Singh SK, Prabhu KV, Talukdar A (2015) High frequency regeneration in soybean [Glycine max (L.) Merrill.] through direct somatic embryogenesis from immature cotyledons. Ind J Plant Physiol 20(3): 232-239; doi:10.1007/s40502-015-0166-3
Huynh HN, Lal SK, Singh SK, Talukdar A, Vinod L (2017) Screening of soybean [Glycine max (L.) Merrill] genotypes for somatic embryogenesis and plant regeneration potential. Indian J Genet 77(3): 387-393; doi:10.5958/0975-6906.2017.00052.9
Kouadio KO, Sopie YE, Oumar S, Yao AB, Tanoh K (2018) Influence of carbohydrates on callus proliferation during somatic embryogenesis in pineapple [Ananas comosus (L.) Merr. (Bromeliaceae) Var. Cayenne Smooth Cultivar CI 16]. European Scientific Journal 14 (15): 1857-7881; doi:10.19044/esj.2018.v14n15p287
Kraus JE, Arduin M (1997) Manual básico de métodos em morfologia vegetal. Ed. Universidade Federal Rural do Rio de Janeiro, Seropédica, EDUR, Brazil
Mariashibu TS, Subramanyam K, Arun M, Mayavan S, Rajesh M, Theboral J, Manickavasagam M, Ganapathi A (2013) Vacuum infiltration enhances the Agrobacterium- mediated genetic transformation in Indian soybean cultivars. Acta Physiol Plant 35(1): 41-54; doi:10.1007/s11738-012-1046-3
Mata M, Quiroz-Figueroa F, Shannon LM, Ruiz-May E (2016) The Current Status of Proteomic Studies in Somatic Embryogenesis. En: Loyola-Vargas VM, Ochoa-Alejo N (eds). Somatic Embryogenesis: Fundamental Aspects and Application, pp. 103-119. Springer International Publishing, Switzerland; doi:10.1007/978-3-319-33705-0_7
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum 15: 473-497; doi:10.1111/j.1399-3054.1962.tb08052.x
Nishizawa K, Ishimoto M (2009) Maturation of somatic embryos a model for soybean seed development. Plant Biotechnology 26 (5): 543-550; doi:10.5511/plantbiotechnology.26.543
Pathak N, Tiwari S, Mishr MK (2017) Regeneration of plantlets from immature explants culture in Glycine max (L.) Merrill. Legume Research 40(1): 69-73; doi:10.18805/lr.v0i0.7020
Pérez JL, Blanco TS, García L, Veitía N, Bermúdez I, Collado R, Torres D, Romero C (2012) Influencia del tipo e intensidad de luz en la formación y multiplicación de embriones somáticos de soya. Revista Colombiana de Biotecnología 14(2): 139-146
Pérez JL, García L, Veitía N, Bermúdez I, Collado R, Torres D (2017) Efecto de la morfología de los embriones somáticos en la regeneración de plantas de soya (Glycine max L. Merrill). Cultivos Tropicales 38(2): 28-35
Rahman MH, Islam R, Hossain M, Islam MS (2010) Role of sucrose, glucose and maltose on conventional potato micropropagation. Journal of Agricultural Technology 6(4): 733-739
Raza G, Singh MB, Bhalla PL (2017) In Vitro Plant Regeneration from Commercial Cultivars of Soybean. BioMed Research International, 2017, Article ID 7379693, 9 pages; doi:10.1155/2017/7379693
Santos KGB, Mariath JE, Moço MCC, Bodanese-Zanettini MH (2006) Somatic embryogenesis from immature cotyledons of soybean (Glycine max (L.) Merr.): Ontogeny of somatic embryos. Braz Arch Biol Technol 49(1): 49-55; doi:10.1590/S1516-89132006000100006
Sarkar M, Roy SC (2015) Influences of medium parameters on somatic embryogenesis from leaf explants of Glycyrrhiza glabra L.. Indian J Sci Res 10(1): 63-67
Schmidt MA, Tucker DM, Cahoon EB, Parrott WA (2005) Towards normalization of soybean somatic embryo maturation. Plant Cell Rep 24(7): 383-391; doi:10.1007/s00299-005-0950-z
Souza E, Albuquerque ACS, Teichert S, Madruga L, Mendes OL (2014) Estimate of the gene flow between transgenic and non transgenic soybean cultivars. Brazilian Journal of Applied Technology for Agricultural Science, Guarapuava-PR 7(1): 97-102; doi:10.5935/PaeT.V7.N1.11
Widoretno W, Indriyani S, Martasari C, Hakin R (2017) Effects of sugar type and concentration on Batu 55 Mandarin (Citrus reticulata Blanco.) somatic embryo maturation. AGRIVITA Journal of Agricultural Science 39(1): 100-110; doi:10.17503/agrivita.v39i1.714
Wright MS, Launis KL, Novitzdy R, Duesiing JH, Harms CT (1991) A simple method for the recovery of multiple fertile plants from individual somatic embryos of soybean [Glycine max (L.) Merrill]. In Vitro Cell Dev Biol-Plant 27(3): 153-157; doi:10.1007/BF02632200
Yaseen M, Ahmad T, Sablok G, Standardi A, Hafiz IA (2013) Review: role of carbon sources for in vitro plant growth and development. Mol Biol Rep 40(4): 2837-2849; doi:10.1007/s11033-012-2299-z
Recibido: 13-11-2018
Aceptado: 21-01-2019
Copyright (c) 2019 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
