ARTÍCULO ORIGINAL
Biotecnología
Vegetal Vol. 14, No. 3: 179 - 183, julio - septiembre, 2014
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
Instituto de Biotecnología de las Plantas. UCLV. MES.
Compuestos hidrofílicos en los filtrados de cultivos
de Fusarium oxysporum f. sp. cubense GCV [01210] inducen protección
a hojas de plantas de banano frente al principal componente fitotóxico
del patógeno
Hydrophilic compounds in culture filtrates of Fusarium oxysporum f. sp. cubense GCV [01210] induce protection to banana leave toward a main pathogen phytotoxic component
Nayanci Portal González1*, Jenella Garraway1, Osbel Pino1, Ermis Yanes Paz2, Karlina García Sosa3, Barbarita Companioni2, Luis Manuel Peña Rodríguez3, Ramón Santos Bermúdez2 *Autora para correspondencia
1Facultad
de Ciencias Agropecuarias. Universidad de Ciego de Ávila Máximo
Gómez Báez. Carretera a Morón km 9. Ciego de Ávila.
Cuba. e-mail: nayanci@agronomia.unica.cu
2Centro
de Bioplantas. Universidad de Ciego de Ávila Máximo Gómez
Báez. Carretera a Morón km 9. Ciego de Ávila. Cuba
3Centro de Investigación Científica de Yucatán (CICY). Mérida. Yucatán. México
RESUMEN
El Mal de Panamá, causado por Fusarium oxysporum f. sp. cubense (Foc) , se encuentra entre las enfermedades más importante de Musa spp. Foc es un hongo necrotrófico, sus fitotoxinas juegan un papel fundamental en el desarrollo de la enfermedad. Previamente se obtuvo un filtrado de cultivo (FCC) de 15 días de incubación con actividad fitotóxica diferencial frente a dos cultivares de Musa. A partir de este se purificó la principal fracción con actividad fitotóxica no específica frente a ambos cultivares. En el presente trabajo se determinó la actividad biológica de la fase acuosa y de la principal fracción fitotóxica purificada del extracto orgánico del FCC de Fusarium oxysporum f. sp. cubense GCV [01210] raza 1 sobre hojas de bananos cv. `Gros Michel' (susceptible) y `FHIA-01' (resistente). Se corroboró el efecto fitotóxico del FCC de Foc. La fase acuosa no mostró actividad fitotóxica sobre ambos cultivares, mientras que la aplicación simultánea de la fase acuosa con la fracción fitotóxica principal indujo una respuesta diferencial de los tejidos en los cultivares susceptible y resistente evaluados. Los resultados indicaron que los compuestos presentes en la fase acuosa se requieren para inducir la protección de los tejidos foliares frente al principal componente fitotóxico del patógeno.
Palabras clave: filtrado de cultivo, Mal de Panamá, resistente, susceptible
Abstract
Panama disease caused by Fusarium oxysporum f. sp. cubense (Foc), is among the most important diseases in Musa spp. Foc is a necrotrophic fungus, their phytotoxins play a role in disease development. Previously culture filtrate (FCC) 15 days incubation with differential phytotoxic activity against two Musa cultivars was obtained. From this, the main fraction with nonspecific phytotoxic activity against both cultivars was purified. In this study, the biological activity of the aqueous phase and the main phytotoxic fraction purified from organic extract of Fusarium oxysporum f. sp. cubense VCG [01210] Race 1 FCC was determined on banana leaves of cv. `Gros Michel' (susceptible) and `FHIA-01' (resistant). Foc FCC phytotoxic effect was confirmed. The aqueous phase showed no phytotoxic activity on both cultivars, while the simultaneous application of the aqueous phase with the main phytotoxic fraction induced a differential response of tissues in susceptible and resistant cultivars evaluated. The results indicated that the compounds present in the aqueous phase are required to induce the protection of leaf tissue against phytotoxic main component of the pathogen.
Key words: culture filtrate, Panama disease, resistant, susceptible
INTRODUCCIÓN
Durante décadas, las toxinas hospedero-específicas o selectivas fueron los únicos agentes conocidos de especificidad en cualquier interacción planta-microorganismo, pues provocan los síntomas de la enfermedad sólo en plantas que son hospederas del patógeno que las produce. En ocasiones, la secreción de toxinas por parte del patógeno es esencial para la patogenicidad (Walton, 1996). Fusarium oxysporum f. sp. cubense (E.F. Sm.) W.C. Snyder & H.N. Hansen (Foc) es un hongo necrotrófico (Ploetz, 2006). Las fitotoxinas en este microorganismo juegan un papel fundamental en el desarrollo de la enfermedad en las plantas susceptibles.
Varios estudios han demostrado la utilidad de emplear filtrados de cultivo (FCC) de especies de Fusarium para discriminar entre cultivares resistentes y susceptibles en ensayos con plantas in vitro o tejidos vegetales. En este sentido, Campanioni et al. (2003) informaron sobre un ensayo de punteadura en hojas con filtrados de cultivo de F. oxysporum f.sp. cubense que permitió clasificar cultivares de Musa en base a su respuesta y asociarlo a fenotipos de resistencia a la enfermedad Mal de Panamá observados en condiciones de campo.
Más adelante, Portal et al. (2011) en estudios de caracterización del FCC de este patógeno refirieron que el extracto orgánico ocasionó una respuesta inespecífica de los tejidos de hojas de ambos cultivares. Cuando se purificó por cromatografía en columna flash y se recuperó en una sola fracción (2E) la referida actividad fitotóxica inespecífica se mantuvo. Dando continuidad a dichos estudios sobre la interacción de Musa-Foc, el objetivo del presente trabajo estuvo encaminado a determinar la actividad biológica de la fase acuosa y de la principal fracción fitotóxica purificada del extracto orgánico de Fusarium oxysporum f. sp. cubense GCV [01210] raza 1 (2E) sobre hojas de bananos susceptibles y resistentes a la enfermedad.
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon muestras foliares de plantas de banano de ocho a nueve meses de plantadas en el Banco de Germoplasma del Instituto Nacional de Viandas Tropicales (INIVIT) de los cultivares `Gros Michel' (Musa AAA) y `FHIA-01' (Musa AAAB). Cepa fúngica
Fusarium oxysporum f. sp. cubense GCV [01210] (raza 1), procedente del Instituto de Investigaciones de Sanidad Vegetal (INISAV), La Habana.
Filtrado de cultivo
Para la obtención del filtrado de cultivo se siguió el procedimiento descrito por Portal et al. (2007). De igual forma, el extracto orgánico, su fraccionamiento y la purificación de la fracción fitotóxica (2E) por cromatografía en columna flash se realizó según Portal et al. (2011).
El bioensayo de punteadura en hojas (Companioni et al., 2003) se empleó para determinar la respuesta de los cultivares frente a la fracción acuosa (FA) y de la principal fracción fitotóxica purificada del extracto orgánico de Fusarium oxysporum f. sp. cubense GCV [01210] raza 1 (2E).
Los tratamientos incluyeron la aplicación de las fracciones FA y 2E simultáneamente, así como la aplicación de la fracción 2E a los 15 y 30 min. del tratamiento con la fracción FA. Se utilizaron como control positivo el FCC de Foc GCV [01210] raza 1 de 15 días de incubación y concentrado al 80% de su volumen inicial, el extracto orgánico (1 mg ml-1), la fase acuosa (FA, 0.25 mg ml-1 proteínas) y la fracción 2E (1mg ml-1). Una solución H2O:MeOH (9:1, v/v) se empleó como control negativo.
El contenido de proteínas totales en las hojas se determinó mediante el método de Lowry et al. (1951). El precipitado obtenido de la fracción acuosa se resuspendió en 2 ml de agua con Dimetilsulfóxido (DMSO) al 1%. Alícuotas de 0.5 ml de la muestra se mezclaron con 6 ml de Reactivo C y 0.6 ml del Reactivo de Folin Ciocalteu diluido dos veces. Se determinó la A650 transcurridos 60 min y la concentración de proteínas se expresó en mg ml-1, referido a una curva patrón de albúmina de suero bovino (BSA).
Análisis estadístico
En el procesamiento estadístico de los datos se utilizó el utilitario Statistical Package for Social Sciences (SPSS para Windows, versión 17, Copyright SPSS). La comparación de medias se realizó mediante la prueba de Kruskal-Wallis, Student-Newman-Keuls (p<0.05).
RESULTADOS Y DISCUSIÓN
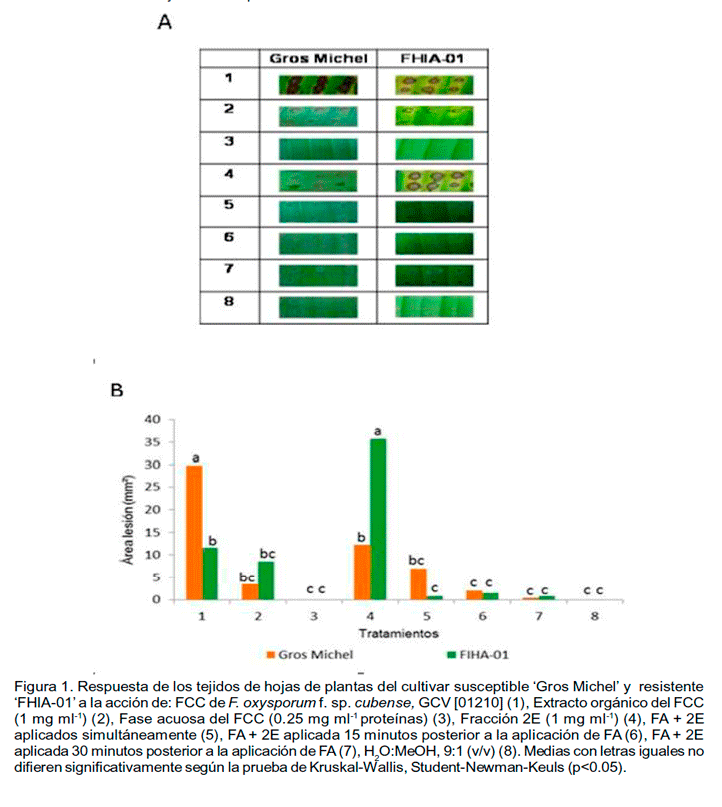
En la figura 1 se muestra la respuesta in vitro de los tejidos de las hojas plantas de Musa sp. susceptibles y resistentes al Mal de Panamá frente al FCC de 15 días de cultivo de F. oxysporum f.sp. cubense GCV [01210] y sus componentes principales.
El bioensayo de
punteadura en hojas empleado (Figura 1A) corroboró
el efecto fitotóxico diferencial del FCC en la respuesta de los tejidos
de hojas correspondientes a los
cultivares susceptibles y resistentes al patógeno in vivo (Figura
1B). Sin embargo, el carácter selectivo de los FCC no se observó
en el extracto orgánico, el cual indujo daños sobre los tejidos
de hojas de ambos cultivares.
Esta pérdida de especificidad se hizo más evidente en la fracción 2E, obtenida durante la purificación por particiones sucesivas con solventes orgánicos de polaridad variable y cromatografía en columna flash del extracto orgánico del FCC, asociado a una mayor pureza de la fracción fitotóxica. Esto supone la posible implicación de toxina(s) no-hospedero específica(s) como factor de patogenicidad y/o virulencia de este aislado del patógeno.
De este modo, la fracción responsable de inducir la respuesta diferencial mostrada por los tejidos de las plantas resistentes al patógeno in vivo frente a la acción del FCC fue excluida en la fase acuosa durante la purificación de la fracción fitotóxica 2E. Adicionalmente, la fase acuosa no ejerció efecto fitotóxico alguno sobre ambos cultivares ensayados, indicando que la actividad fitotóxica total de los FCC fue recuperada en el extracto orgánico.
La aplicación conjunta de la fracción acuosa resultante de la partición del filtrado crudo de cultivo y la fracción 2E purificada a partir del extracto orgánico, mostró la especificidad mostrada por el filtrado de cultivo de Foc de 15 días de incubación en la respuesta de los cultivares frente al componente fitotóxico ensayado, similar a la respuesta de las plantas frente al patógeno in vivo, aunque sin diferencias significativas en el daño ocasionado sobre ambos grupos de plantas. Sin embargo, con la aplicación de la fracción 2E a intervalos de 15 y 30 min posteriores a la aplicación de la fracción acuosa, se redujo el daño causado también sobre los tejidos foliares del cv. susceptible. Esta respuesta retardada, en lugar de una carencia en el reconocimiento inicial de componentes del patógeno, parece operar en la respuesta de susceptibilidad en este patosistema.
El aislamiento y caracterización de estas moléculas hidrofílicas pudiera aportar nuevos elementos para el entendimiento de los mecanismos de respuesta de las plantas a los patógenos potenciales, y en especial en la interacción Musa sp. F. oxysporum f. sp. cubense. Varios autores atribuyen un papel determinante a los productos de genes de avirulencia del patógeno o proteínas efectoras en la resistencia de las plantas a las enfermedades (Rep et al. 2005; Boller, 2008; Stergiopoulos y De Wit, 2009; Catanzariti y Jones, 2010; Zhang y Zhou, 2010).
Adicionalmente, los resultados sugieren tener en consideración, para futuros estudios de la interacción Foc Musa sp. basados en la expresión génica y de las sendas de traducción de señales, enmarcar los procedimientos analíticos durante los primeros 30 minutos de exposición de los tejidos de las plantas a la acción de estas moléculas protectoras de la acción de componentes fitotóxicos del patógeno.
CONCLUSIONES
Se comprobó que la fase acuosa, resultado del fraccionamiento del FCC de Foc, no tuvo efecto fitotóxico sobre hojas de los cultivares susceptible (`Gros Michel') y resistente (`FHIA-01') al Mal de Panamá en el ensayo de punteadura en hojas. Sin embargo, los resultados indicaron que los compuestos presentes en ella se requieren para inducir la protección de los tejidos foliares frente al principal componente fitotóxico del patógeno.
REFERENCIAS
Boller T (2008) Stabbing in the BAKAn Original Target for Avirulence Genes of Plant Pathogens. Plant Science: 5-7
Catanzariti AM, David A Jones (2010) Effector proteins of extracellular fungal plant pathogens that trigger host resistance. Functional Plant Biology 37: 901906
Companioni B, Arzola M, Rodríguez Y, Mosqueda M, Pérez MC, Borrás O, Lorenzo JC, Santos R (2003) Use of culture-derived Fusarium oxysporum f. sp. cubense, race 1 filtrates for rapid and non-destructive in vitro differentiation between resistant and susceptible clones of field-grown banana. Euphytica 130: 341-347
Ingle A, Ingle R (2013) Isolation and Identification of Fusarium oxysporum infecting Musa plants in Maharashtra region and their molecular characterization. Asiatic J Biotechnology Resources 4 (1):28-34
Ploetz RC (2006) Fusarium wilt of banana is caused by several pathogens referred to as Fusarium oxysporum f. sp. cubense. Phytopathology 96: 653-656
Portal N, Companioni B, Achade C, Mvila B, Arzola M, Persaud I, Acosta-Suárez M, Sánchez-García C, Leiva-Mora M, Roque B, Alvarado-Capó Y, Santos Ramón (2007) Evaluación de la actividad fitotóxica sobre plantas de Musa spp. y contenido de proteínas totales de fitrados de cultivo de Fusarium oxysporum f. sp. cubense raza 1. Biotecnología Vegetal 7(3): 181 186
Portal N, Companioni B, Achade C, Mvila B, Arbola M, Persuad I, Acosta M, Sánchez C, Roque B, Alvarado Y, Yanes E, Santos R (2009) Evaluación de la Actividad fitotóxica sobre plantas de Musa sp. y contenido de proteínas totales de filtrados de cultivo de Fusarium oxysporum f. sp. cubense raza 1. Biotecnología Vegetal 7(3):181-186
Portal N, García K, Iglesias A, Garraway J, Companioni B, Peña LM, Santos R (2011) Purificación de metabolitos fitotóxicos a partir del filtrado de cultivo de Fusarium oxysporum f. sp. cubense gcv 01210 (raza 1). Biotecnología Vegetal 11(2):99106
Rep M, M Meijer, P M Houterman, H C van der Does, B J C Cornelissen (2005) Fusarium oxysporum Evades I-3-Mediated resistance without altering the matching avirulence gene. MPMI 18 (1):1523
Stergiopoulos I, PJGM De Wit (2009) Fungal effector proteins. Annu Rev Phytopathol 47:23363
Walton J D, Daniel G P (1996) Host-selective toxins and disease specificity: Perspectives and progress. Annu. Rev. Phytopathol 31:275-303
Zhang J, JM Zhou (2010) Plant immunity triggered by microbial molecular signatures. Molecular Plant (3)5: 783793
Recibido: 19-2-2014
Aceptado: 11-7-2014
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.