ARTÍCULO ORIGINAL
Biotecnología
Vegetal Vol. 14, No. 4: 223 - 227, octubre - diciembre, 2014
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
Instituto de Biotecnología de las Plantas. UCLV. MES.
Obtención de plantas in vitro de Moringa oleifera Lam.
var. `PKM criolla' a partir de segmentos nodales
Obtention of Moringa oleifera Lam. cv. `PKM criolla' in vitro plants from nodal segments
Daniel Agramonte*, Mileidy Pons-Corona, Martha Pérez, Mariana la O, Leyanis García-Águila, Marisol Freire-Seijo, Felipe Jiménez-Terry. *Autor para correspondencia
Instituto de Biotecnología de las Plantas (IBP). Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5. Santa Clara. Villa Clara. Cuba. CP 54 830. e-mail: agramonte@ibp.co.cu
RESUMEN
Moringa oleifera L. se considera una planta perenne que posee cualidades nutricionales excepcionales. Esta especie es muy rica en proteínas, vitaminas y minerales; es por ello que resulta un complemento importante en la alimentación humana y animal. Entre los fines estratégicos de Cuba se encuentra su introducción a escala comercial, pero no existe suficiente disponibilidad de plantas para su siembra en campo. La propagación in vitro de esta especie pudiera ayudar a resolver la creciente demanda de material vegetal de plantación. El objetivo de este trabajo fue obtener plantas in vitro de Moringa oleifera L. var. `PKM criolla' a partir de segmentos nodales. En la fase de establecimiento con 1.5% de Hipoclorito de sodio (NaClO) se obtuvieron los valores más altos de número de yemas brotadas con baja contaminación microbiana y necrosis de los explantes. En la fase de multiplicación el mayor coeficiente de multiplicación se logró cuando en el medio de cultivo se adicionó 2.22 µM de 6-bencilaminopurina. Se definieron las condiciones de cultivo para establecer y multiplicar in vitro la Moringa oleifera L. como herramienta útil para futuros planes de propagación in vitro de esta especie.
Palabras clave: establecimiento, 6-bencilaminopurina (BA), multiplicación
ABSTRACT
Moringa oleifera L. is considered a perennial plant that has exceptional nutritional qualities. This species is very rich in protein, vitamins and minerals; that is why it is an important complement to the food and feed. Among the strategic goals of Cuba is its introduction on a commercial scale, but there is insufficient availability of plants for planting in the field. The in vitro propagation could help to solve the growing demand for planting material. The objective of this work was to obtain in vitro plants of Moringa oleifera L. var. `PKM criolla' from nodal segments. In the establishment phase with 1.5% sodium hypochlorite the highest values of number of sprouted buds with low microbial contamination and necrosis of the explants were obtained. In the multiplication stage the largest multiplication coefficient was achieved when at the culture medium was added 2.22 µM 6-benzylaminopurine. Growing conditions were defined to establish and in vitro multiplication of Moringa oleifera L. nodal segments as a useful tool for future in vitro propagation of this specie.
Key words: establishment, 6-benzylaminopurine (BA), multiplication
INTRODUCCIÓN
Moringa es el único género de la familia Moringaceae. Este comprende 13 especies, las cuales son árboles de climas tropicales y subtropicales. La especie más utilizada es Moringa oleifera Lamk (Steinitz et al., 2009). Se le conoce como Paraíso francés y otros nombres comunes, tales como: Acacia, Ben y Palo jeringa, así como Tilo francés y Tilo americano y se utilizan principalmente las flores como tilo (Roig, 1991).
En los últimos años en Cuba se aprecia un florecimiento y `redescubrimiento' de M. oleifera. Esta es una planta con reconocido contenido alimenticio, con innumerables características nutritivas y terapéuticas, por lo cual pudiera ser considerada como uno de los alimentos que contribuyen al bienestar y a la prevención de enfermedades por sus efectos antioxidantes. Es apremiante ampliar su cultivo, utilización y consumo racional, no solo por sus propiedades, sino también como parte de un estilo de vida sano, sobre todo muy degustada por animales de los campos cubanos como chivos, ovejos y ganado vacuno, por citar algunos (Bonal et al., 2012).
Muchas de las trece especies de Moringa son conocidas por encontrarse en peligro de extinción, sin embargo, la especie M. oleifera es ampliamente cultivada y puede ser utilizada para desarrollar técnicas de micropropagación que puedan ser aplicables a los miembros más amenazados de este género (Stephenson y Fahey, 2004).
En este sentido, se han desarrollado técnicas de cultivo in vitro para Moringa con el objetivo de asegurar el mantenimiento de germoplasma (Crosby y Craker, 2007) y propagación rápida (Saini et al., 2012).
Varios autores han descrito la micropropagación de M. oleifera a partir de segmentos nodales o por semillas (Stephenson y Fahey, 2004; Islam et al., 2005; Steinitz et al., 2009; Marfori, 2010; Saini et al., 2012). Sin embargo, se requiere estandarizar los protocolos para cada variedad de interés.
Por su alta demanda y comercialización es necesario impulsar el cultivo de esta especie y las técnicas biotecnológicas pueden contribuir a esta estrategia del país con la micropropagación de variedades específicas en dependencia de su utilidad. En este trabajo se empleó la variedad `PKM criolla', la cual es muy utilizada para satisfacer la alta necesidad de plantas para la alimentación del ganado vacuno y ovino. Por los precedentes antes descritos es que este trabajo tuvo como objetivo obtener plantas in vitro de Moringa oleifera L. var. `PKM criolla' a partir de segmentos nodales.
MATERIALES Y MÉTODOS
Material vegetal
Se utilizaron plantas de Moringa oleifera L. var. `PKM criolla' procedentes del Banco de plantas donantes del Instituto de Biotecnología de las Plantas (Figura 1 A) cultivadas en recipientes de cultivo con un sustrato que contenía humus de lombriz y zeolita en proporción 3:1 (v/v) en casa de cultivo. Las plantas fueron rociadas una vez por semana con una solución de Benlate® (1 g l -1 ) durante 21 días.
Establecimiento in vitro de yemas axilares
Se tomaron segmentos nodales que cada uno contenía un fragmento de peciolo con una yema axilar (Figura 1B). Posteriormente, se sumergieron en agua corriente y detergente comercial a razón de 5-7 g l-1. Se lavaron varias veces durante 3 a 5 minutos con un cepillo de cerdas finas y se enjuagaron varias veces.
Seguidamente, se colocaron 10 explantes por frasco estéril (500 ml de capacidad) y se les realizó una primera desinfección superficial con una solución de alcohol (70%) durante un minuto. A continuación se determinó el efecto de la inmersión de los segmentos nodales durante 20 minutos en una solución de hipoclorito de sodio (NaClO) (1.0, 1.5 y 2.0%). A cada tratamiento de desinfección se le añadió Tween 20 a razón de 1.0 ml l-1. Se enjuagaron tres veces con agua destilada estéril.
Los segmentos nodales con una yema axilar se colocaron sobre medio de cultivo con sales MS (100%) (Murashige y Skoog, 1962). El pH del medio fue ajustado a 5.8 y se esterilizó en autoclave a 121°C con una presión de 1.1 kg cm-2 durante 15 minutos. A cada tubo de ensayo se le añadieron 10 ml de medio de cultivo. Se emplearon 10 tubos de ensayo por tratamiento y el experimento se repitió tres veces. Los explantes fueron colocaron en cámaras de crecimiento de luz solar a 26 ± 2ºC.
Las evaluaciones se realizaron de forma visual y diaria durante 25 días de cultivo para determinar el tiempo de brotación de las yemas axilares (días), se cuantificó el número de yemas axilares brotadas por tratamiento, así como se observaron las posibles afectaciones por contaminación microbiana en cada uno.
Multiplicación de brotes
Para multiplicar los brotes se adicionaron al medio de cultivo MS varias concentraciones de 6-bencilaminopurina (BA) (0.44, 2.22, 4.44 y 6.66 µM) y se solidificó con agar al 0.7% (m/v) (Plant agar, Duchefa).
Se colocaron seis explantes por frasco de cultivo que contenía 30 ml de medio de cultivo. Se utilizaron 10 frascos por tratamiento y el experimento se repitió tres veces.
Después de 4 semanas de cultivo, se midió la longitud de los brotes (cm), se cuantificó el número de brotes por explante y se calculó el coeficiente de multiplicación por el número de brotes obtenido por segmento nodal inicial.
Las variables evaluadas fueron analizadas mediante el paquete estadístico SPSS PASW Statistic 18 (SPSS Inc., Chicago, IL, USA). Se realizaron pruebas de comprobación de los supuestos de normalidad y homogeneidad de varianza y las medias se compararon mediante la prueba de Tukey para p<0.05.
RESULTADOS Y DISCUSIÓN
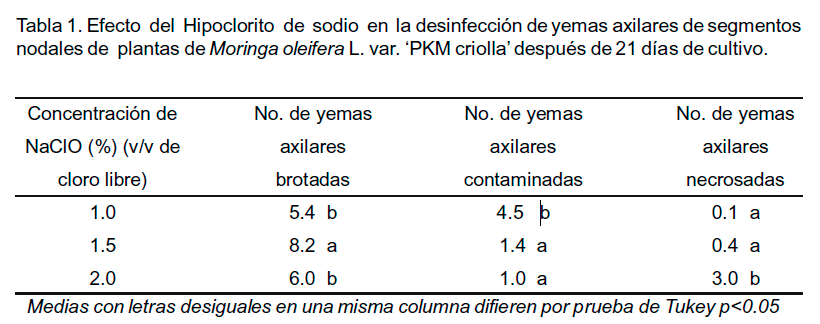
Con los tratamientos de desinfección ensayados se logró disminuir la incidencia de contaminantes microbianos. La aplicación de NaClO al 1.5% produjo el mayor número de yemas brotadas con baja contaminación microbiana y necrosis (Tabla 1).
La brotación de las yemas axilares comenzó a partir de 15 días de cultivo (Figura 1C). Aunque en cuanto a la contaminación microbiana no hubo diferencias significativas con el tratamiento con 2% de NaClO, el mayor número de yemas necrosadas fue con esta concentración lo cual ha sido descrito en investigaciones anteriores. Por ejemplo, autores como Borges et al. (2004) y De Feria et al. (2007) informaron en Guadua angustifolia y en Phalaenopsis, respectivamente, que los mayores porcentajes de muerte en yemas desinfectadas con NaClO, coincidieron con los tratamientos de mayor concentración (2.0 y 3.0%). Ellos plantearon que concentraciones mayores eliminaron la contaminación microbiana pero ocasionaron daños al material vegetal.
En este ensayo se demostró la acción como agente desinfectante del NaClO que es uno de los más usados en los procesos de desinfección en la fase de establecimiento de muchos cultivos, aunque los resultados dependen del tipo de material vegetal, el tiempo de desinfección y las concentraciones empleadas. En este sentido, Steinitz et al. (2009) emplearon el tratamiento con NaClO al 1.0% durante 20 minutos para la desinfección de semillas para el establecimiento in vitro de tres especies de Moringa y el 100% mostró contaminación bacteriana.
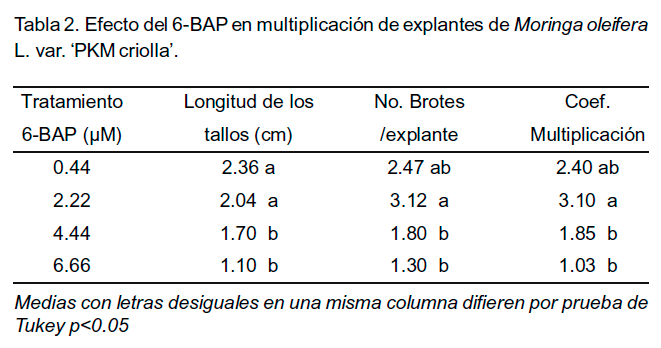
Las concentraciones de 6-BAP empleadas en la fase de multiplicación tuvieron un efecto positivo sobre el número de brotes por explante, la longitud de los tallos y el coeficiente de multiplicación (Tabla 2). Con la adición de 2.22 µM al medio de cultivo semisólido de multiplicación se obtuvieron 3.12 brotes por explante y el coeficiente de multiplicación resultó ser el más alto. Con esta selección se logró una proliferación de brotes con rápido crecimiento y un número mayor de plantas.
La concentración de 6-BAP seleccionada en este experimento está por debajo de la referida por otros autores. Por ejemplo, Stepheson y Fahey (2004) utilizaron 4.44 µM de 6-BAP para la inducción de brotes, Islam et al. (2005) emplearon de 4.44 - 6.66 µM, así como Xiang et al. (2007) encontraron que la combinación de 2.66 µM de 6-BAP y 0.54 µM de ácido naftalenacético (ANA) fue la mejor opción para la inducción de brotes.
En este trabajo se pudo demostrar que es posible obtener plantas in vitro de Moringa oleífera L. var. `PKM criolla' a partir de segmentos nodales. Se lograron las condiciones en la fase de establecimiento y multiplicación que permiten introducir material vegetal élite con características deseables para la propagación comercial de esta especie ya sea para el uso humano o animal, así como para la producción de metabolitos secundarios por el alto potencial genético que posee esta especie para fines farmacéuticos. Esto es una ventaja ya que se puede aplicar estas condiciones de cultivo para otros genotipos de la misma especie que tengan gran importancia y aplicación económica.
REFERENCIAS
Bonal, R, Rivera RM, Bolívar ME (2012) Moringa oleifera: una opción saludable para el bienestar. MEDISAN 16(10): 1029-3019
Borges, M, Ros C, Castellanos Y, Milanes S, Velásquez R (2004) Efecto de diferentes métodos de desinfección en el establecimiento in vitro de Guadua angustifolia Kunth. Biotecnología Vegetal 4(4): 237-242
Crosby, G, Craker W, LE (2007) Development of soilless culture methods for production of moringa (Moringa oleifera Lam) root and leaf biomass. Acta Horticulturae 756: 139-146
De Feria, M, Chávez M, Quiala E (2007) Establecimiento in vitro de Phalaenopsis. Biotecnología Vegetal 7(1): 27-33
García Roa M (2003) Producción de semillas forestales de especies forrajeras enfatizados en sistemas silvopastoriles. INAFOR [En línea] En: http://www.inafor.gob.ni/index.php/publicaciones. Consultado el 15 de febrero de 2010
Islam, S, Jahan M AA, Khatum R (2005) In vitro multiplication of year- round fruit bearing Moringa oleifera.L J. Biol. Sci. 5: 145-148
Sánchez N, Ledin S, Ledin I (2006) Biomass production and chemical composition of Moringa oleifera L. under different management regimes in Nicaragua. Agrofor. Syst. 66: 231-242
Steinitz, B, Tabib Y, Gaba V, Gefen T, Vaknin Y (2009) Vegetative micro-cloning to sustain biodiversity of threatened Moringa species. In Vitro Cell. Dev. Biol.-Plant 45: 65-71
Stephenson, KK, Fahey JW (2004) Development of tissue culture methods for the rescue and propagation of endangered Moringa spp. germplasm. Econ. Bot. 58: 116-S124
Marfori E C (2010) Clonal micropropagation of Moringa oleifera L. Philipp Agric Scientist 93(4): 454-457
Morton J F (1991) The horseradish tree, Moringa pterigosperma (Moringaceae). A boon to arid lands? Economic Botany 45(3): 318
Murashige, T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant 15: 473-497
Recibido: 01-10-2013
Aceptado:
12-03-2014
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.